人教版高二化学选修4第三章第一节 弱电解质的电离(共18张PPT)
文档属性
| 名称 | 人教版高二化学选修4第三章第一节 弱电解质的电离(共18张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-03 20:51:14 | ||
图片预览






文档简介
(共18张PPT)
人教版选修四高三复习
第三章第一节
弱电解质的电离
1、了解电解质的概念。了解强电解质和
弱电解质的概念。
2、理解电解质在水溶液中的电离,以及
电解质溶液的导电性。
3、理解弱电解质在水中的电离平衡,
4
、能利用电离平衡常数进行相关计算。
考纲要求
1、因为NH3的水溶液能够导电,
所以NH3属于电解质(
)
2、Cu能导电,属于电解质(
)
3、氯化钠溶液能导电,属于电解质(
)
4、能够完全电离的电解质称为强电解质(
)
5、BaSO4难溶于水,但它是强电解质(
)
6、弱电解质溶液的导电能力不一定比强电解质弱
×
×
×
思考判断
夯实基础
牛刀小试
下列物质在一定条件下能够导电,
但是不属于电解质的是(
)
A.
石墨
B.
食盐
C.
硫酸
D.
蔗糖
A
1、了解强电解质和弱电解质的概念。
2、了解电解质在水溶液中的电离,以及
电解质溶液的导电性。
3、理解弱电解质在水中的电离平衡.
4、能利用电离平衡常数进行相关计算
考纲要求
2、了解电解质在水溶液中的电离
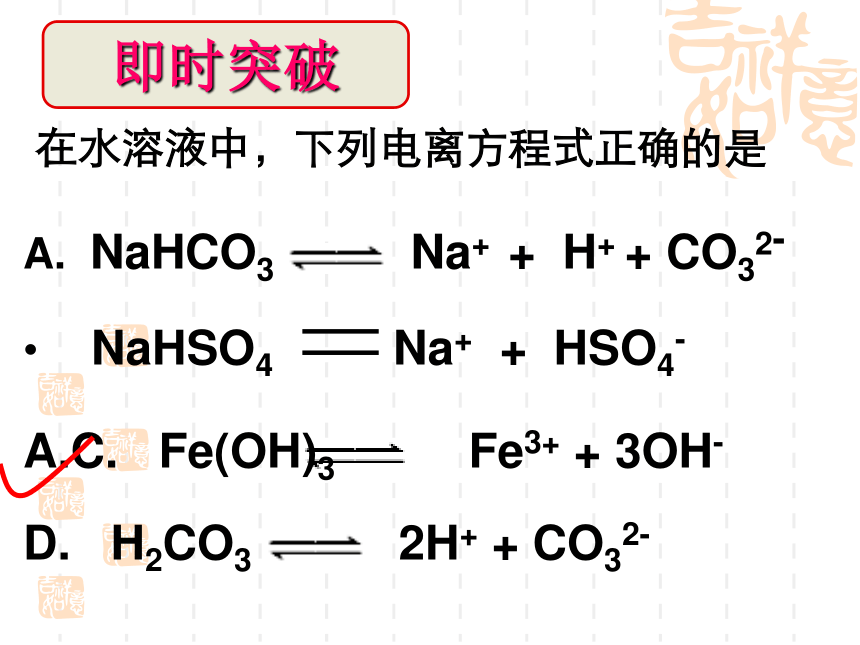
在水溶液中,下列电离方程式正确的是
NaHCO3
Na+
+
H+
+
CO32-
NaHSO4
Na+
+
HSO4-
C.
Fe(OH)3
Fe3+
+
3OH-
D.
H2CO3
2H+
+
CO32-
=
即时突破
1、了解强电解质和弱电解质的概念。
2、了解电解质在水溶液中的电离,以及
电解质溶液的导电性。
3、理解弱电解质在水中的电离平衡.
4、能利用电离平衡常数进行相关计算
考纲要求
理解弱电解质在水中的电离平衡
以0.1
mol/L的醋酸溶液为例,分析外界条件对电离平衡
的影响
CH3COOH
CH3COO-
+
H+
H>0
向右
减小
向右
增大
向右
减小
向右
减小
向左
增大
向右
增大
实战演练:
改变条件
平衡移动方向
c(H+)
加水
少量冰醋酸
少量NaOH(s)
镁粉
浓盐酸
升高温度
氨水中有下列平衡
NH3.H2O
NH4++OH-,
当其他条件不变时,改变下列条件,平衡向左移动,且NH4+浓度增大的是
(
)
A.加浓NaOH溶液
B.加浓HCl
C.加NH4Cl固体
D.加同浓度的氨水
基础练习
C
(上海)H2S水溶液中存在电离平衡H2S
???????
H++HS-
和HS-
???H++S2-若向H2S溶液中
巩固延伸
A.加水,平衡向右移动,溶液中c(H+)增大
B.通入过量SO2气体,平衡向左移动,溶液
pH值
增大
C.滴加新制氯水,平衡向左移动,溶液pH值
减小
D.加入少量硫酸铜固体(忽略体积变化),
溶液
中所有离子浓度都减小
1、了解强电解质和弱电解质的概念。
2、理解电解质在水中的电离,以及
电解质溶液的导电性。
3、理解弱电解质在水溶液中的电离平衡。
4、会运用电离平衡常数解决相关问题。
考纲要求
4、能运用电离平衡常数进行相关计算
电离平衡常数
判断正误:
1、同一类型的弱电解质,电离常数可以表示其
相对强弱,
K值越大,酸(或碱)性越强(
)
2、某电解质浓度越小,其电离程度越大,
电离常数就越大
(
)
3、升高温度,电离常数增大(
)
4、碳酸的电离常数表达式
:Ka1=
Ka2=
且
Ka1
>>Ka2
(
)
×
C(H+)
C(CO32-)
C(HCO3-)
常温时,将a
mol/L的氨水与0.01
mol/L
的盐酸等体积混合,反应完全时溶液
中c(NH4+)=c(Cl-),用含a的代数式表示
反应完全时NH3.
H2O的电离常数Kb
学以致用
(16-威海)将浓度为0.1mol/LCH3COOH溶液加
水不断稀释,下列各量始终保持增大的是
A.
c(H+)
B.
C.
D.
Ka(CH3COOH)
c(CH3COO-)
c(OH-)
相同温度下,根据三种酸的电离常数,下列
判断正确的是( )
??????????????????????????????????????????????????????????????????????????????????????
A、三种酸的强弱关系:HX>HY>HZ
?
B、反应
HZ
+
Y-
═
HY+
Z-能够发生
?
C、相同温度下,0.1?mol/L的NaX、NaY、NaZ溶液,
NaZ溶液?PH最大
D、相同温度下,1??mol/L?HX溶液的电离常数大于
0.1?mol/L?HX
综合练习1
酸
HX
HY
HZ
电离常数K(mol·L-1)
9×10-7
9×10-6
10-2
(16-全国卷3)下列有关电解质溶液的说法正确的是
A.向0.1mol
/L
?CH3COOH溶液中加入少量水,溶液
中
???????????????????????????????????减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中
??????????????????????????????????????????????增大
C.向盐酸中加入氨水至中性,溶液中
????????????????????????????
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中
?????????????????不变
综合练习2
1、了解电解质的概念。
了解强电解质和弱电解质的概念。
2、理解电解质在水溶液中的电离,
以及电解质溶液的导电性。
3、理解弱电解质在水溶液中的电离平衡。
4、能运用电离平衡常数进行相关计算。
考纲要求
谢谢大家!
人教版选修四高三复习
第三章第一节
弱电解质的电离
1、了解电解质的概念。了解强电解质和
弱电解质的概念。
2、理解电解质在水溶液中的电离,以及
电解质溶液的导电性。
3、理解弱电解质在水中的电离平衡,
4
、能利用电离平衡常数进行相关计算。
考纲要求
1、因为NH3的水溶液能够导电,
所以NH3属于电解质(
)
2、Cu能导电,属于电解质(
)
3、氯化钠溶液能导电,属于电解质(
)
4、能够完全电离的电解质称为强电解质(
)
5、BaSO4难溶于水,但它是强电解质(
)
6、弱电解质溶液的导电能力不一定比强电解质弱
×
×
×
思考判断
夯实基础
牛刀小试
下列物质在一定条件下能够导电,
但是不属于电解质的是(
)
A.
石墨
B.
食盐
C.
硫酸
D.
蔗糖
A
1、了解强电解质和弱电解质的概念。
2、了解电解质在水溶液中的电离,以及
电解质溶液的导电性。
3、理解弱电解质在水中的电离平衡.
4、能利用电离平衡常数进行相关计算
考纲要求
2、了解电解质在水溶液中的电离
在水溶液中,下列电离方程式正确的是
NaHCO3
Na+
+
H+
+
CO32-
NaHSO4
Na+
+
HSO4-
C.
Fe(OH)3
Fe3+
+
3OH-
D.
H2CO3
2H+
+
CO32-
=
即时突破
1、了解强电解质和弱电解质的概念。
2、了解电解质在水溶液中的电离,以及
电解质溶液的导电性。
3、理解弱电解质在水中的电离平衡.
4、能利用电离平衡常数进行相关计算
考纲要求
理解弱电解质在水中的电离平衡
以0.1
mol/L的醋酸溶液为例,分析外界条件对电离平衡
的影响
CH3COOH
CH3COO-
+
H+
H>0
向右
减小
向右
增大
向右
减小
向右
减小
向左
增大
向右
增大
实战演练:
改变条件
平衡移动方向
c(H+)
加水
少量冰醋酸
少量NaOH(s)
镁粉
浓盐酸
升高温度
氨水中有下列平衡
NH3.H2O
NH4++OH-,
当其他条件不变时,改变下列条件,平衡向左移动,且NH4+浓度增大的是
(
)
A.加浓NaOH溶液
B.加浓HCl
C.加NH4Cl固体
D.加同浓度的氨水
基础练习
C
(上海)H2S水溶液中存在电离平衡H2S
???????
H++HS-
和HS-
???H++S2-若向H2S溶液中
巩固延伸
A.加水,平衡向右移动,溶液中c(H+)增大
B.通入过量SO2气体,平衡向左移动,溶液
pH值
增大
C.滴加新制氯水,平衡向左移动,溶液pH值
减小
D.加入少量硫酸铜固体(忽略体积变化),
溶液
中所有离子浓度都减小
1、了解强电解质和弱电解质的概念。
2、理解电解质在水中的电离,以及
电解质溶液的导电性。
3、理解弱电解质在水溶液中的电离平衡。
4、会运用电离平衡常数解决相关问题。
考纲要求
4、能运用电离平衡常数进行相关计算
电离平衡常数
判断正误:
1、同一类型的弱电解质,电离常数可以表示其
相对强弱,
K值越大,酸(或碱)性越强(
)
2、某电解质浓度越小,其电离程度越大,
电离常数就越大
(
)
3、升高温度,电离常数增大(
)
4、碳酸的电离常数表达式
:Ka1=
Ka2=
且
Ka1
>>Ka2
(
)
×
C(H+)
C(CO32-)
C(HCO3-)
常温时,将a
mol/L的氨水与0.01
mol/L
的盐酸等体积混合,反应完全时溶液
中c(NH4+)=c(Cl-),用含a的代数式表示
反应完全时NH3.
H2O的电离常数Kb
学以致用
(16-威海)将浓度为0.1mol/LCH3COOH溶液加
水不断稀释,下列各量始终保持增大的是
A.
c(H+)
B.
C.
D.
Ka(CH3COOH)
c(CH3COO-)
c(OH-)
相同温度下,根据三种酸的电离常数,下列
判断正确的是( )
??????????????????????????????????????????????????????????????????????????????????????
A、三种酸的强弱关系:HX>HY>HZ
?
B、反应
HZ
+
Y-
═
HY+
Z-能够发生
?
C、相同温度下,0.1?mol/L的NaX、NaY、NaZ溶液,
NaZ溶液?PH最大
D、相同温度下,1??mol/L?HX溶液的电离常数大于
0.1?mol/L?HX
综合练习1
酸
HX
HY
HZ
电离常数K(mol·L-1)
9×10-7
9×10-6
10-2
(16-全国卷3)下列有关电解质溶液的说法正确的是
A.向0.1mol
/L
?CH3COOH溶液中加入少量水,溶液
中
???????????????????????????????????减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中
??????????????????????????????????????????????增大
C.向盐酸中加入氨水至中性,溶液中
????????????????????????????
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中
?????????????????不变
综合练习2
1、了解电解质的概念。
了解强电解质和弱电解质的概念。
2、理解电解质在水溶液中的电离,
以及电解质溶液的导电性。
3、理解弱电解质在水溶液中的电离平衡。
4、能运用电离平衡常数进行相关计算。
考纲要求
谢谢大家!
