人教版高二化学选修4第三章 第二节 水的电离和溶液的酸碱性(共17张PPT)
文档属性
| 名称 | 人教版高二化学选修4第三章 第二节 水的电离和溶液的酸碱性(共17张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 323.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-03 00:00:00 | ||
图片预览




文档简介
(共17张PPT)
第三章
水溶液中的离子平衡
第二节
水的电离和溶液的酸碱性
人教版选修4
·
化学反应原理
【学习目标】1、了解水的电离平衡及其“离子积”
2、学会根据水的离子积计算溶液中
H+
和OH-
的浓度
【学习重点】
水的离子积常数
【学习难点】在酸碱溶液中如何求H2O电离出的
c(H+)和c(OH—)
水
H2O
G
灵敏电流计
灯泡
纯水导电实验
现象:
指针摆动,但灯泡不亮。
水是一种极弱的电解质,水的电离极其微弱,
H2O+
H2O
H3O+
+OH—
H2O
H+
+OH-
一、水的电离
1、水是一种极弱电解质,能微弱电离:
K电离
=
c(H+)
·
c(OH-)
c(H2O)
c(H+)
·
c(OH-)
c(H2O)
·
K电离
=
Kw
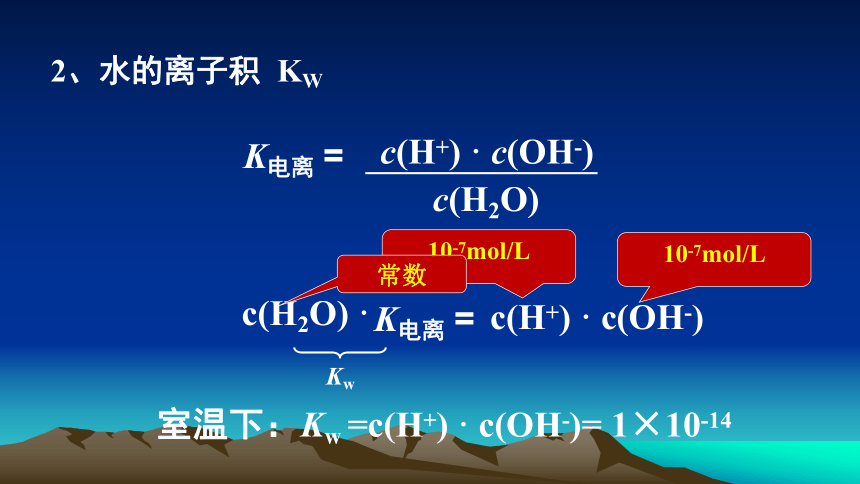
室温下:Kw
=c(H+)
·
c(OH-)=
1×10-14
2、水的离子积
KW
10-7mol/L
10-7mol/L
常数
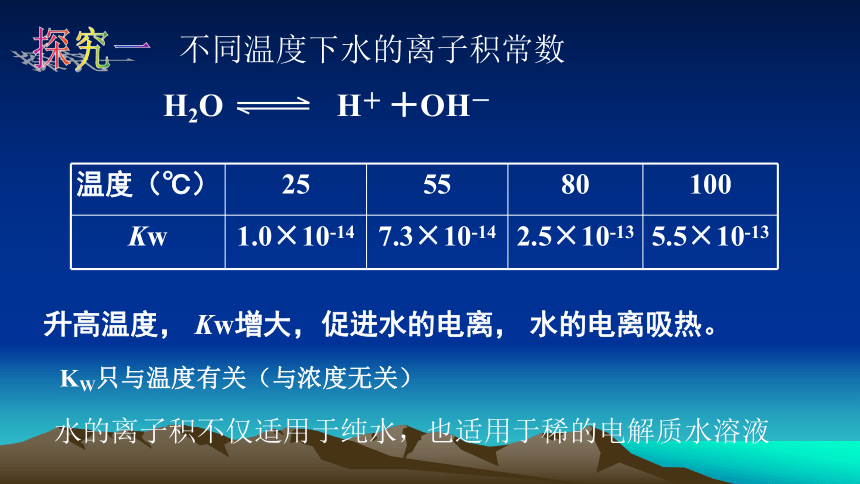
升高温度,
Kw增大,促进水的电离,
水的电离吸热。
温度(℃)
25
55
80
100
Kw
1.0×10-14
7.3×10-14
2.5×10-13
5.5×10-13
H2O
H+
+OH-
KW只与温度有关(与浓度无关)
不同温度下水的离子积常数
水的离子积不仅适用于纯水,也适用于稀的电解质水溶液
探究一
D
1、水的电离过程为H2O
H+
+
OH-,在不同温度下其离子积为KW25℃=1×10-14,
KW35℃
=2.1
×10-14。则下列叙述正确的是(
)
A、[H+]
随着温度的升高而降低
B、在35℃时,纯水中
[H+]
>[OH-]
C、水的电离常数K25
℃
>K35
℃
D、水的电离是一个吸热过程
练习
探究二
对常温下的纯水进行下列操作,完成下表:
?
酸碱性
水的电离平衡移动方向
C(H+)
C(OH-)
C(H+)
与C(OH-)
大小关系
Kw变化
加
热
?
?
?
?
?
?
加HCl
?
?
?
?
?
?
加NaOH
?
?
?
?
?
?
中性
→
↑
↑
=
↑
酸性
←
↑
↓
>
不变
碱性
←
↓
↑
<
不变
H2O
H+
+OH-
(1)升高温度,促进水的电离,电离吸热,水的离子积增大;
(2)加入酸或碱,抑制水的电离,Kw不变;
3、影响水电离的因素
(3)其它因素:如加入活泼金属,消耗H+,
促进水的电离,
Kw不变。
2、判断正误:
1)任何水溶液中都存在水的电离平衡。
2)任何水溶液中(不论酸、碱或中性)
都存在Kw=10-14
。
3)某温度下,某液体c(H+)=
10-7mol/L,则该溶液一定是纯水。
√
×
×
练习
3、在25℃
0.01mol/L盐酸溶液中:
c(H+)溶
=
,
c(OH-)溶
=
;
c(H+)水=
,
c(OH-)水=
。
4、在25℃
0.01mol/L
NaOH溶液中:
c(H+)溶=
,
c(OH-)溶=
;
c(H+)水=
,
c(OH-)水=
。
0.01mol/L
10-12mol/L
10-12mol/L
10-12mol/L
10-12mol/
L
10-12mol/L
10-12mol/L
0.01mol/L
练习
5、在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是(
)
①
K+、Cl-、NO3-、S2-
②
K+、Fe2+、I-、SO42-
③
Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3-
⑤
K+、Ba2+、Cl-、NO3-
A.①③
B.③⑤
C.③④
D.②⑤
酸性条件不能共存
碱性条件不能共存
能共存
酸、碱性条件都不能共存
能共存
B
①根据Kw=C(H+)溶×C(OH-)
溶在特定温度下为
定值,C(H+)
和C(OH-)
可以互求;
②任何水溶液中由水电离出来的
c(H+)
水与
c(OH-)
水相等
;
③纯水中溶液C(H
+)、C(OH-)浓度的计算方法:
C(H
+)=C(OH-)=
水的离子积不仅适用于纯水,也适用于稀的电解质水溶液
小结
一、水的电离
1、水的电离
2、水的离子积
Kw=
c(H+
)
?
c(OH-)
(1)无单位
(2)
Kw只与温度有关,温度升高,
Kw增大
(3)
任何溶液中都存在Kw=
c(H+
)
溶?
c(OH-)溶且25℃
Kw=1×10-14
课堂小结
H2O+
H2O
H3O+
+OH—
H2O
H+
+OH-
(1)升高温度,促进水的电离,电离吸热,
水的离子积增大,在常温时,
KW=1×10-14;
(2)加入酸或碱,抑制水的电离,Kw不变;
3、影响水电离的因素
(3)其它因素:如加入活泼金属,消耗H+,
促进水的电离,
Kw不变。
课堂小结
作业:练习册45-46
谢谢
第三章
水溶液中的离子平衡
第二节
水的电离和溶液的酸碱性
人教版选修4
·
化学反应原理
【学习目标】1、了解水的电离平衡及其“离子积”
2、学会根据水的离子积计算溶液中
H+
和OH-
的浓度
【学习重点】
水的离子积常数
【学习难点】在酸碱溶液中如何求H2O电离出的
c(H+)和c(OH—)
水
H2O
G
灵敏电流计
灯泡
纯水导电实验
现象:
指针摆动,但灯泡不亮。
水是一种极弱的电解质,水的电离极其微弱,
H2O+
H2O
H3O+
+OH—
H2O
H+
+OH-
一、水的电离
1、水是一种极弱电解质,能微弱电离:
K电离
=
c(H+)
·
c(OH-)
c(H2O)
c(H+)
·
c(OH-)
c(H2O)
·
K电离
=
Kw
室温下:Kw
=c(H+)
·
c(OH-)=
1×10-14
2、水的离子积
KW
10-7mol/L
10-7mol/L
常数
升高温度,
Kw增大,促进水的电离,
水的电离吸热。
温度(℃)
25
55
80
100
Kw
1.0×10-14
7.3×10-14
2.5×10-13
5.5×10-13
H2O
H+
+OH-
KW只与温度有关(与浓度无关)
不同温度下水的离子积常数
水的离子积不仅适用于纯水,也适用于稀的电解质水溶液
探究一
D
1、水的电离过程为H2O
H+
+
OH-,在不同温度下其离子积为KW25℃=1×10-14,
KW35℃
=2.1
×10-14。则下列叙述正确的是(
)
A、[H+]
随着温度的升高而降低
B、在35℃时,纯水中
[H+]
>[OH-]
C、水的电离常数K25
℃
>K35
℃
D、水的电离是一个吸热过程
练习
探究二
对常温下的纯水进行下列操作,完成下表:
?
酸碱性
水的电离平衡移动方向
C(H+)
C(OH-)
C(H+)
与C(OH-)
大小关系
Kw变化
加
热
?
?
?
?
?
?
加HCl
?
?
?
?
?
?
加NaOH
?
?
?
?
?
?
中性
→
↑
↑
=
↑
酸性
←
↑
↓
>
不变
碱性
←
↓
↑
<
不变
H2O
H+
+OH-
(1)升高温度,促进水的电离,电离吸热,水的离子积增大;
(2)加入酸或碱,抑制水的电离,Kw不变;
3、影响水电离的因素
(3)其它因素:如加入活泼金属,消耗H+,
促进水的电离,
Kw不变。
2、判断正误:
1)任何水溶液中都存在水的电离平衡。
2)任何水溶液中(不论酸、碱或中性)
都存在Kw=10-14
。
3)某温度下,某液体c(H+)=
10-7mol/L,则该溶液一定是纯水。
√
×
×
练习
3、在25℃
0.01mol/L盐酸溶液中:
c(H+)溶
=
,
c(OH-)溶
=
;
c(H+)水=
,
c(OH-)水=
。
4、在25℃
0.01mol/L
NaOH溶液中:
c(H+)溶=
,
c(OH-)溶=
;
c(H+)水=
,
c(OH-)水=
。
0.01mol/L
10-12mol/L
10-12mol/L
10-12mol/L
10-12mol/
L
10-12mol/L
10-12mol/L
0.01mol/L
练习
5、在由水电离产生的H+浓度为1×10-13mol·L-1的溶液中,一定能大量共存的离子组是(
)
①
K+、Cl-、NO3-、S2-
②
K+、Fe2+、I-、SO42-
③
Na+、Cl-、NO3-、SO42-
④Na+、Ca2+、Cl-、HCO3-
⑤
K+、Ba2+、Cl-、NO3-
A.①③
B.③⑤
C.③④
D.②⑤
酸性条件不能共存
碱性条件不能共存
能共存
酸、碱性条件都不能共存
能共存
B
①根据Kw=C(H+)溶×C(OH-)
溶在特定温度下为
定值,C(H+)
和C(OH-)
可以互求;
②任何水溶液中由水电离出来的
c(H+)
水与
c(OH-)
水相等
;
③纯水中溶液C(H
+)、C(OH-)浓度的计算方法:
C(H
+)=C(OH-)=
水的离子积不仅适用于纯水,也适用于稀的电解质水溶液
小结
一、水的电离
1、水的电离
2、水的离子积
Kw=
c(H+
)
?
c(OH-)
(1)无单位
(2)
Kw只与温度有关,温度升高,
Kw增大
(3)
任何溶液中都存在Kw=
c(H+
)
溶?
c(OH-)溶且25℃
Kw=1×10-14
课堂小结
H2O+
H2O
H3O+
+OH—
H2O
H+
+OH-
(1)升高温度,促进水的电离,电离吸热,
水的离子积增大,在常温时,
KW=1×10-14;
(2)加入酸或碱,抑制水的电离,Kw不变;
3、影响水电离的因素
(3)其它因素:如加入活泼金属,消耗H+,
促进水的电离,
Kw不变。
课堂小结
作业:练习册45-46
谢谢
