人教版高二化学选修4第三章第一节 弱电解质的电离(共37张PPT)
文档属性
| 名称 | 人教版高二化学选修4第三章第一节 弱电解质的电离(共37张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 737.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-03 22:13:37 | ||
图片预览







文档简介
(共37张PPT)
第三章水溶液中的离子平衡
第一节
弱电解质的电离
第一节
弱电解质的电离
(第一课时)
电离:化合物在溶于水或受热熔化时,离解成自由移动的离子的过程。
为什么物质在水溶液里或熔化状态下能够导电?
灯泡亮
导电
溶液中有自由移动的离子
回顾
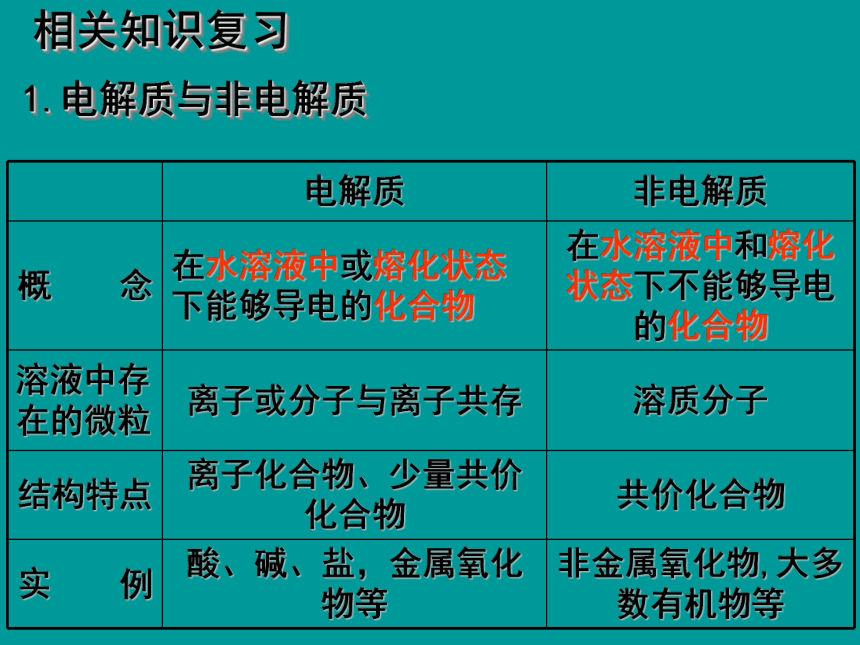
相关知识复习
1.电解质与非电解质
电解质
非电解质
概
念
在水溶液中或熔化状态下能够导电的化合物
在水溶液中和熔化状态下不能够导电的化合物
溶液中存在的微粒
离子或分子与离子共存
溶质分子
结构特点
离子化合物、少量共价化合物
共价化合物
实
例
酸、碱、盐,金属氧化物等
非金属氧化物,大多数有机物等
不同电解质电离程度不同
为什么同浓度的电解质在水溶液里导电性不同?
灯泡越亮
导电性越强
溶液中有自由移动的离子浓度越大
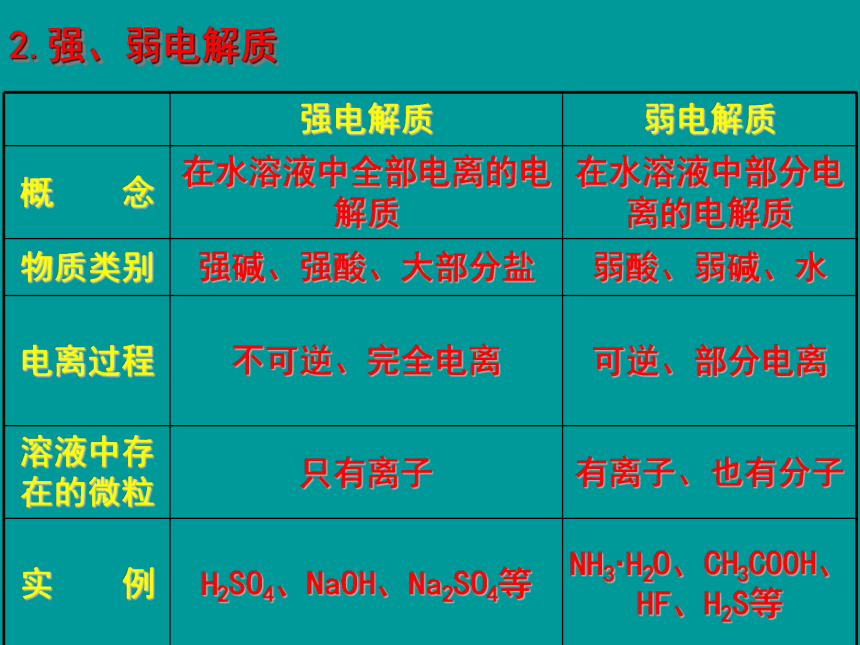
2.强、弱电解质
强电解质
弱电解质
概
念
在水溶液中全部电离的电解质
在水溶液中部分电离的电解质
物质类别
强碱、强酸、大部分盐
弱酸、弱碱、水
电离过程
不可逆、完全电离
可逆、部分电离
溶液中存在的微粒
只有离子
有离子、也有分子
实
例
H2SO4、NaOH、Na2SO4等
NH3·H2O、CH3COOH、HF、H2S等
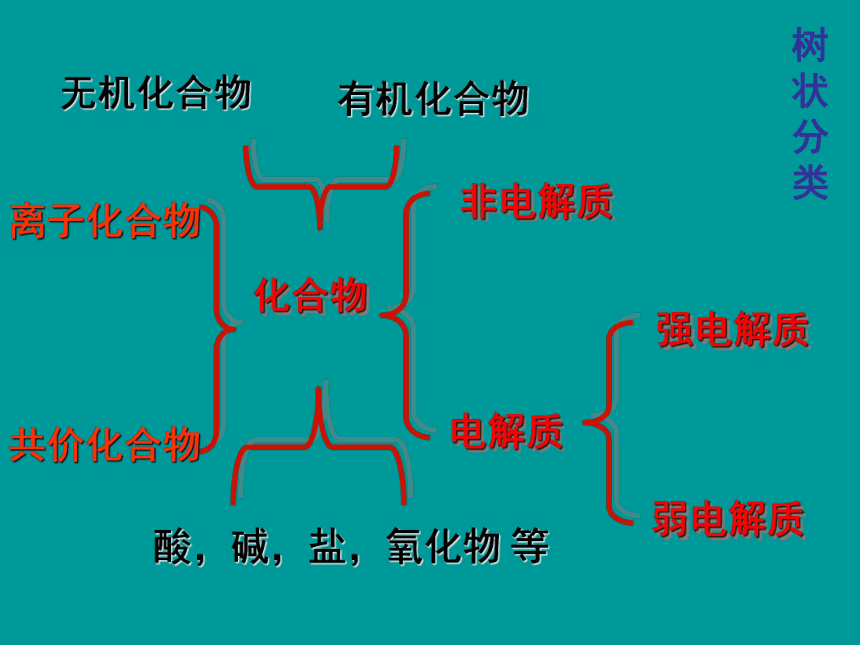
化合物
非电解质
电解质
强电解质
弱电解质
离子化合物
共价化合物
无机化合物
有机化合物
酸,碱,盐,氧化物
等
树状分类
化合物
非电解质
电解质
强电解质
弱电解质
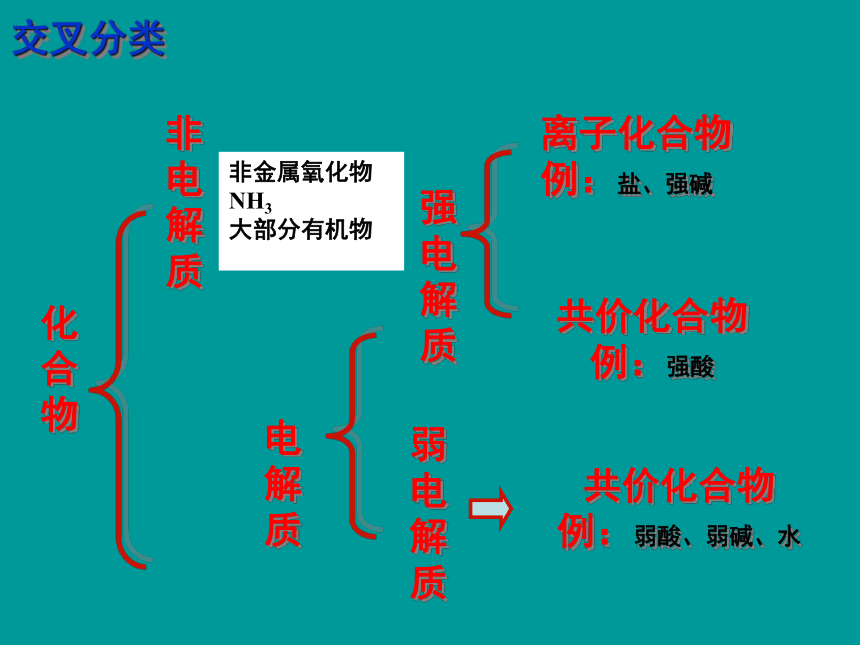
交叉分类
离子化合物
例:盐、强碱
共价化合物
例:强酸
共价化合物
例:弱酸、弱碱、水
非金属氧化物
NH3
大部分有机物
思考:
1.请将下列物质按要求分类:H2SO4、
CO2、
NaOH、BaSO4、
NH3
、SO2、
NH3·H2O
、C2H5OH
电解质:
非电解质:
H2SO4、
NaOH、BaSO4、
NH3·H2O
CO2、NH3
、SO2、C2H5OH(酒精)
强电解质:
H2SO4、
NaOH、BaSO4
弱电解质:
NH3·H2O
实验3-1:体积相同,浓度相同的盐酸和醋酸溶液的pH值及与等量镁条反应。
备注:
Mg条使用前应用砂纸打磨,除去表面的氧化膜
剧烈
缓慢
小
(0)
大
(2.4)
思考:如何用实验证明在溶液中HCl是完全电离的而CH3COOH是不完全电离的?
1mol/L
HCl
1
mol/L
CH3COOH
溶液pH
与镁反应
现象
(2)为什么相同体积、相同浓度的盐酸和醋酸溶液中,H+浓度却不同?
(1)当酸溶液的物质的量浓度相等时,溶液中的pH不同,说明什么?
说明盐酸和醋酸溶液中的H+浓度是不同的。
说明HCl和CH3COOH的电离程度不同。
实验3-1现象分析:
(3)镁无论是与盐酸还是与醋酸反应,其实质都是与溶液中的____反应
H+
(4)反应剧烈程度的不同,是由于溶液中的_____不同而引起的
H+浓度
(5)镁与盐酸反应比镁与醋酸反应剧烈,说明
___
_____________
c(
H+盐酸)>
c(
H+醋酸),盐酸和醋酸溶液的电离程度不同。
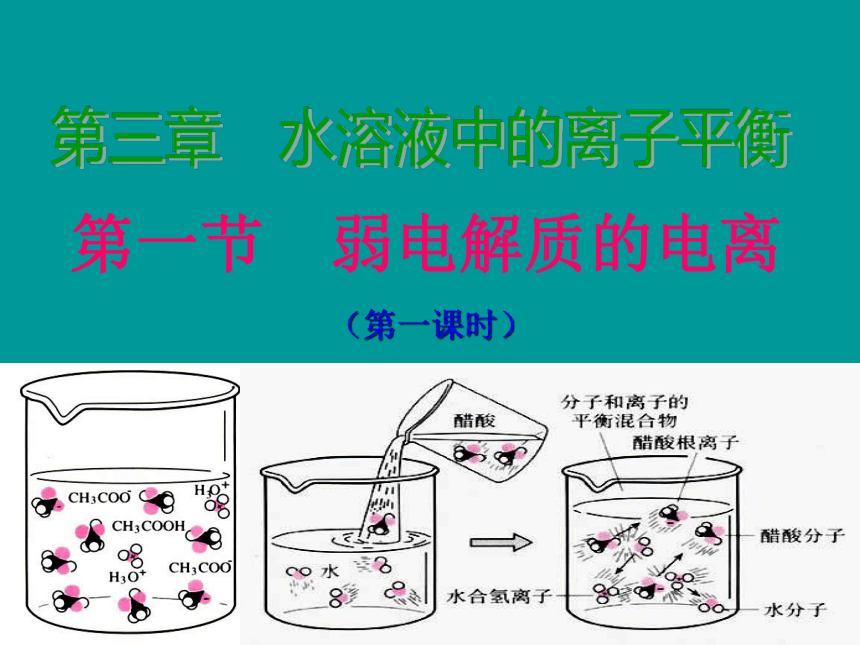
盐酸与醋酸在水中的电离示意图
观察两种溶液中溶质微粒有多少种?
盐酸在水中的电离示意图
醋酸在水中的电离示意图
说明
HCl分子在水中完全电离
醋酸分子在水中部分电离
H2O
H+
Cl-
H2O
CH3COOH
H+
CH3COO-
盐酸溶液
醋酸溶液
HCl在水中全部电离
CH3COOH在水中部分电离
醋酸在电离过程中各微粒浓度的变化
弱电解质的电离
CH3COOH
CH3COO
-
+
H+
最小
最小
最大
不变
不变
不变
思考:冰醋酸溶于水中,在此过程中微粒的变化包含哪些?
c(H+)
c(Ac-)
c(HAc)
HAc初溶于水
紧接着
最后
一、弱电解质的电离
1、弱电解质在水溶液中电离的特点
部分电离
可逆
存在电离平衡
2、弱电解质的电离平衡
在一定条件下,当弱电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡。
电离速率
分子化速率
电离平衡状态是指
在一定条件下(如温度、浓度等)的弱电解质的溶液中,
弱电解质分子电离成离子的速率和离子重新结合成分子的速率相等,
溶液中各分子、离子的浓度保持不变的状态。
前提
实质
标志
2.定义:
逆:弱电解质的电离是可逆过程
动:动态平衡
等:弱电解质的电离速率
与离子重新结合速率相等V(电离)=V(结合)
定:溶液里离子浓度、分子浓度保持不变
变:当支持电离平衡状态的条件改变,电离平
衡会发生移动。
3、电离平衡状态的特征
二、电解质的电离方程式书写
强 等 号
弱 可 逆
多元弱酸分步写
③多元弱碱分步进行,一步写
多元弱碱写一步
①先判断强、弱电解质,决定符号
练习:⑴NH3·H2O;
⑵HClO;⑶H2SO3;
⑷Fe(OH)3;
(5)Al(OH)3;
(6)NaHCO3
;(7)
NaHSO4
(8)Ba(OH)2
③多元弱碱也是分步电离,但书写电离方程式时写总式
②多元弱酸分步电离,电离能力逐渐降低
④Al(OH)3有酸式和碱式电离
⑤多元弱酸的酸式盐的电离方程式
4、影响电离平衡的因素
①温度
②浓度
③同离子效应
④化学反应
内因:电解质本身的性质。
通常电解质越弱电离程度越小。
外
因
当外界条件改变时符合
“勒夏特列原理”
电离过程是吸热过程,升高温度,
平衡向电离方向移动
4、影响电离平衡的因素
①温度
4、影响电离平衡的因素
②浓度
思考:
弱电解质稀释中电离程度如何变化?
其溶液的中离子的浓度如何变化?
当电离达到平衡时,
加水稀释向电离的方向移动,电离程度增大,
增加弱电解质浓度,向电离的方向移动,但电离程度减小.
用水稀释冰醋酸时离子浓度随加水量的变化曲线。
③同离子效应
5、影响电离平衡的因素
加入同弱电解质电离所产生的离子相同离子,电离平衡向逆方向移动
④化学反应
加入能与弱电解质电离产生的离子反应的物质时,减少离子的浓度,使电离平衡向电离方向移动
4、影响电离平衡的因素
讨论完成表格:
正向
增大
增大
减小
逆向
增大
减小
增大
正向
减小
增大
减小
逆向
减小
增大
增大
正向
增大
增大
增大
正向
减小
减小
减小
增大
不变
不变
不变
不变
不变
改变条件C
平衡移
动方向
C(H+)
C(Ac---)
C(HAc)
电离常数
加
热
通HCl
加
NaOH(s)
加NaAc(s)
加CH3COOH
加
水
例:在氨水中存在怎样的电离平衡?若向其中分别加入:
①升高温度
②加氨气
③水
④
NH4Cl溶液
⑤NaOH溶液
⑥适量的盐酸
对上述电离平衡有什么影响?
思考与讨论:
NH3·H2O
NH4
+
+
OH
-
问题一:怎样定量的比较弱电解质的相对强弱?电离程度相对大小怎么比较?
知识拓展
对于一元弱酸
HA
H++A-
对于一元弱碱
MOH
M++OH-
2)
意义:K值越大,电离程度越大,
相应酸
(或碱)的酸(或碱)性越强。
1、电离平衡常数(K)
1)
定义
3)
K
值只随温度变化。
科学视野P42:电离常数
如:H2S
H++HS-
K1=1.3×10-7
HS-
H++S2-
K2=1.3×10-15
一般K1>>K2
>>K3
,
说明多元弱酸的电离主要以第一步为主
电离常数数值的大小,可以估算弱电解质电离
的趋势。K值越大,电离程度越大,酸性越强。
如相同条件下常见弱酸的酸性强弱:
H2SO3>H3PO4>HF>CH3COOH>H2CO3>H2S>HClO
弱电解质电离程度相对大小的另一种参数-------
2、电离度α
【知识拓展】
2、电离度
例:250C时,在0.5L0.2mol/L的HA溶液中,
有0.04mol的HA电离成离子。
求该温度下HA的电离程度。
求该温度下0.1mol/L的HA的电离程度。
求该温度下1mol/L的HA的电离程度。
思考与练习
1.氢氧化铝的电离方程式可以表示为
AlO2—
+
H+
+
H2O
Al(OH)3
Al3++
3OH—,试根据平衡移动的原理解释下列问题:
(1)向氢氧化铝沉淀中加入盐酸,沉淀溶解,原因
____,有关的离子方程式___________。
(2)向氢氧化铝沉淀中加入苛性钠溶液,沉淀溶解,
原因_________,有关的离子方程式__________________________________。
练习2:有H+浓度相同、体积相等的三种酸:a、盐酸
b、硫酸
c、醋酸,
同时加入足量的锌,
则开始反应时速率
,
反应过程中的平均速率
,
反应完全后生成H2的质量
。
(用<、=、>
表示)
a=b=c
a=b<c
a=b<c
3、将10ml
0.1mol/L的HAc加水稀释,有关稀释后的醋酸溶液的说法,错误的是:
A、电离程度增大
B、溶液中离子总数增多
C、溶液导电性增加
D、溶液中醋酸分子增多
C
D
4:体积和pH都相等的盐酸和醋酸
溶液的导电能力___________,升高相
同温度后导电能力______________________。
相同
醋酸大于盐酸
第三章水溶液中的离子平衡
第一节
弱电解质的电离
第一节
弱电解质的电离
(第一课时)
电离:化合物在溶于水或受热熔化时,离解成自由移动的离子的过程。
为什么物质在水溶液里或熔化状态下能够导电?
灯泡亮
导电
溶液中有自由移动的离子
回顾
相关知识复习
1.电解质与非电解质
电解质
非电解质
概
念
在水溶液中或熔化状态下能够导电的化合物
在水溶液中和熔化状态下不能够导电的化合物
溶液中存在的微粒
离子或分子与离子共存
溶质分子
结构特点
离子化合物、少量共价化合物
共价化合物
实
例
酸、碱、盐,金属氧化物等
非金属氧化物,大多数有机物等
不同电解质电离程度不同
为什么同浓度的电解质在水溶液里导电性不同?
灯泡越亮
导电性越强
溶液中有自由移动的离子浓度越大
2.强、弱电解质
强电解质
弱电解质
概
念
在水溶液中全部电离的电解质
在水溶液中部分电离的电解质
物质类别
强碱、强酸、大部分盐
弱酸、弱碱、水
电离过程
不可逆、完全电离
可逆、部分电离
溶液中存在的微粒
只有离子
有离子、也有分子
实
例
H2SO4、NaOH、Na2SO4等
NH3·H2O、CH3COOH、HF、H2S等
化合物
非电解质
电解质
强电解质
弱电解质
离子化合物
共价化合物
无机化合物
有机化合物
酸,碱,盐,氧化物
等
树状分类
化合物
非电解质
电解质
强电解质
弱电解质
交叉分类
离子化合物
例:盐、强碱
共价化合物
例:强酸
共价化合物
例:弱酸、弱碱、水
非金属氧化物
NH3
大部分有机物
思考:
1.请将下列物质按要求分类:H2SO4、
CO2、
NaOH、BaSO4、
NH3
、SO2、
NH3·H2O
、C2H5OH
电解质:
非电解质:
H2SO4、
NaOH、BaSO4、
NH3·H2O
CO2、NH3
、SO2、C2H5OH(酒精)
强电解质:
H2SO4、
NaOH、BaSO4
弱电解质:
NH3·H2O
实验3-1:体积相同,浓度相同的盐酸和醋酸溶液的pH值及与等量镁条反应。
备注:
Mg条使用前应用砂纸打磨,除去表面的氧化膜
剧烈
缓慢
小
(0)
大
(2.4)
思考:如何用实验证明在溶液中HCl是完全电离的而CH3COOH是不完全电离的?
1mol/L
HCl
1
mol/L
CH3COOH
溶液pH
与镁反应
现象
(2)为什么相同体积、相同浓度的盐酸和醋酸溶液中,H+浓度却不同?
(1)当酸溶液的物质的量浓度相等时,溶液中的pH不同,说明什么?
说明盐酸和醋酸溶液中的H+浓度是不同的。
说明HCl和CH3COOH的电离程度不同。
实验3-1现象分析:
(3)镁无论是与盐酸还是与醋酸反应,其实质都是与溶液中的____反应
H+
(4)反应剧烈程度的不同,是由于溶液中的_____不同而引起的
H+浓度
(5)镁与盐酸反应比镁与醋酸反应剧烈,说明
___
_____________
c(
H+盐酸)>
c(
H+醋酸),盐酸和醋酸溶液的电离程度不同。
盐酸与醋酸在水中的电离示意图
观察两种溶液中溶质微粒有多少种?
盐酸在水中的电离示意图
醋酸在水中的电离示意图
说明
HCl分子在水中完全电离
醋酸分子在水中部分电离
H2O
H+
Cl-
H2O
CH3COOH
H+
CH3COO-
盐酸溶液
醋酸溶液
HCl在水中全部电离
CH3COOH在水中部分电离
醋酸在电离过程中各微粒浓度的变化
弱电解质的电离
CH3COOH
CH3COO
-
+
H+
最小
最小
最大
不变
不变
不变
思考:冰醋酸溶于水中,在此过程中微粒的变化包含哪些?
c(H+)
c(Ac-)
c(HAc)
HAc初溶于水
紧接着
最后
一、弱电解质的电离
1、弱电解质在水溶液中电离的特点
部分电离
可逆
存在电离平衡
2、弱电解质的电离平衡
在一定条件下,当弱电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡。
电离速率
分子化速率
电离平衡状态是指
在一定条件下(如温度、浓度等)的弱电解质的溶液中,
弱电解质分子电离成离子的速率和离子重新结合成分子的速率相等,
溶液中各分子、离子的浓度保持不变的状态。
前提
实质
标志
2.定义:
逆:弱电解质的电离是可逆过程
动:动态平衡
等:弱电解质的电离速率
与离子重新结合速率相等V(电离)=V(结合)
定:溶液里离子浓度、分子浓度保持不变
变:当支持电离平衡状态的条件改变,电离平
衡会发生移动。
3、电离平衡状态的特征
二、电解质的电离方程式书写
强 等 号
弱 可 逆
多元弱酸分步写
③多元弱碱分步进行,一步写
多元弱碱写一步
①先判断强、弱电解质,决定符号
练习:⑴NH3·H2O;
⑵HClO;⑶H2SO3;
⑷Fe(OH)3;
(5)Al(OH)3;
(6)NaHCO3
;(7)
NaHSO4
(8)Ba(OH)2
③多元弱碱也是分步电离,但书写电离方程式时写总式
②多元弱酸分步电离,电离能力逐渐降低
④Al(OH)3有酸式和碱式电离
⑤多元弱酸的酸式盐的电离方程式
4、影响电离平衡的因素
①温度
②浓度
③同离子效应
④化学反应
内因:电解质本身的性质。
通常电解质越弱电离程度越小。
外
因
当外界条件改变时符合
“勒夏特列原理”
电离过程是吸热过程,升高温度,
平衡向电离方向移动
4、影响电离平衡的因素
①温度
4、影响电离平衡的因素
②浓度
思考:
弱电解质稀释中电离程度如何变化?
其溶液的中离子的浓度如何变化?
当电离达到平衡时,
加水稀释向电离的方向移动,电离程度增大,
增加弱电解质浓度,向电离的方向移动,但电离程度减小.
用水稀释冰醋酸时离子浓度随加水量的变化曲线。
③同离子效应
5、影响电离平衡的因素
加入同弱电解质电离所产生的离子相同离子,电离平衡向逆方向移动
④化学反应
加入能与弱电解质电离产生的离子反应的物质时,减少离子的浓度,使电离平衡向电离方向移动
4、影响电离平衡的因素
讨论完成表格:
正向
增大
增大
减小
逆向
增大
减小
增大
正向
减小
增大
减小
逆向
减小
增大
增大
正向
增大
增大
增大
正向
减小
减小
减小
增大
不变
不变
不变
不变
不变
改变条件C
平衡移
动方向
C(H+)
C(Ac---)
C(HAc)
电离常数
加
热
通HCl
加
NaOH(s)
加NaAc(s)
加CH3COOH
加
水
例:在氨水中存在怎样的电离平衡?若向其中分别加入:
①升高温度
②加氨气
③水
④
NH4Cl溶液
⑤NaOH溶液
⑥适量的盐酸
对上述电离平衡有什么影响?
思考与讨论:
NH3·H2O
NH4
+
+
OH
-
问题一:怎样定量的比较弱电解质的相对强弱?电离程度相对大小怎么比较?
知识拓展
对于一元弱酸
HA
H++A-
对于一元弱碱
MOH
M++OH-
2)
意义:K值越大,电离程度越大,
相应酸
(或碱)的酸(或碱)性越强。
1、电离平衡常数(K)
1)
定义
3)
K
值只随温度变化。
科学视野P42:电离常数
如:H2S
H++HS-
K1=1.3×10-7
HS-
H++S2-
K2=1.3×10-15
一般K1>>K2
>>K3
,
说明多元弱酸的电离主要以第一步为主
电离常数数值的大小,可以估算弱电解质电离
的趋势。K值越大,电离程度越大,酸性越强。
如相同条件下常见弱酸的酸性强弱:
H2SO3>H3PO4>HF>CH3COOH>H2CO3>H2S>HClO
弱电解质电离程度相对大小的另一种参数-------
2、电离度α
【知识拓展】
2、电离度
例:250C时,在0.5L0.2mol/L的HA溶液中,
有0.04mol的HA电离成离子。
求该温度下HA的电离程度。
求该温度下0.1mol/L的HA的电离程度。
求该温度下1mol/L的HA的电离程度。
思考与练习
1.氢氧化铝的电离方程式可以表示为
AlO2—
+
H+
+
H2O
Al(OH)3
Al3++
3OH—,试根据平衡移动的原理解释下列问题:
(1)向氢氧化铝沉淀中加入盐酸,沉淀溶解,原因
____,有关的离子方程式___________。
(2)向氢氧化铝沉淀中加入苛性钠溶液,沉淀溶解,
原因_________,有关的离子方程式__________________________________。
练习2:有H+浓度相同、体积相等的三种酸:a、盐酸
b、硫酸
c、醋酸,
同时加入足量的锌,
则开始反应时速率
,
反应过程中的平均速率
,
反应完全后生成H2的质量
。
(用<、=、>
表示)
a=b=c
a=b<c
a=b<c
3、将10ml
0.1mol/L的HAc加水稀释,有关稀释后的醋酸溶液的说法,错误的是:
A、电离程度增大
B、溶液中离子总数增多
C、溶液导电性增加
D、溶液中醋酸分子增多
C
D
4:体积和pH都相等的盐酸和醋酸
溶液的导电能力___________,升高相
同温度后导电能力______________________。
相同
醋酸大于盐酸
