人教版高二化学选修4第三章 第三节 盐类的水解第一课时(共24张PPT)
文档属性
| 名称 | 人教版高二化学选修4第三章 第三节 盐类的水解第一课时(共24张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-04 22:06:25 | ||
图片预览






文档简介
(共24张PPT)
(第一课时)
教学目标:
知识目标:⒈理解盐类水解的概念,了解盐类水解的
实质,总结盐类水解反应的规律;
⒉学会正确书写盐类水解的化学(离子)
方程式。
能力目标:⒈培养学生逻辑思维、综合归纳能力,提
高学生思维品质;
⒉训练学生实验的基本操作技能。
德育目标:帮助学生树立应用所学知识解决实际问题
的理论联系实际的观点。
重点与难点:
盐类水解的本质,理解强酸弱碱盐与强碱弱酸盐的水解规律。
盐类水解方程式的书写与分析。
实验探究
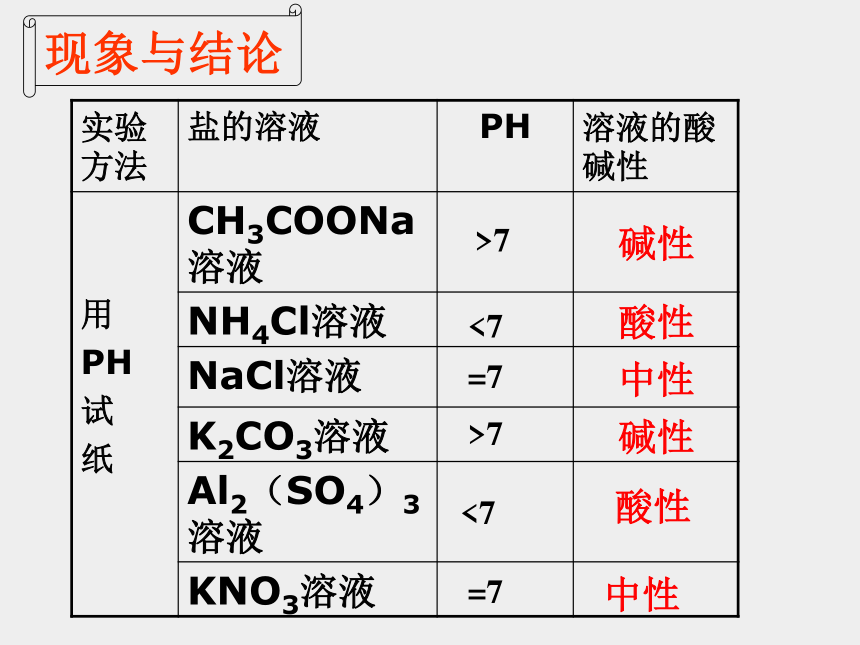
请用pH试纸测定浓度均为0.1mol·L-1的CH3COONa、Na2CO3、NaCl、NH4Cl、Al2(SO4)3、KNO3溶液的pH,记录测定结果。
(注意操作要领)
现象与结论
碱性
碱性
中性
酸性
酸性
中性
>7
>7
<7
<7
=7
=7
实验方法
盐的溶液
PH
溶液的酸碱性
用
PH
试
纸
CH3COONa溶液
NH4Cl溶液
NaCl溶液
K2CO3溶液
Al2(SO4)3溶液
KNO3溶液
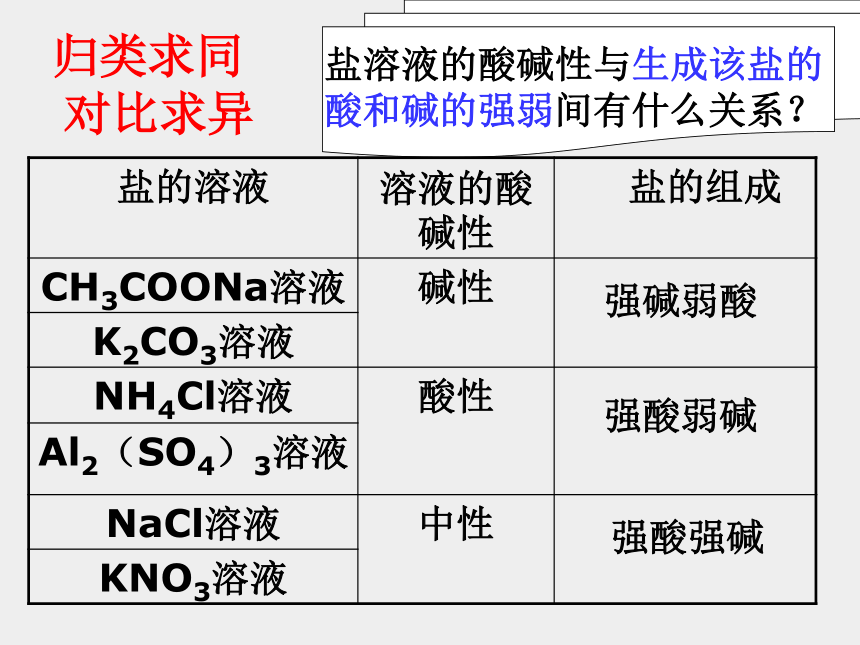
归类求同
对比求异
强碱弱酸
强酸弱碱
强酸强碱
盐溶液的酸碱性与生成该盐的
酸和碱的强弱间有什么关系?
盐的溶液
溶液的酸碱性
盐的组成
CH3COONa溶液
碱性
K2CO3溶液
NH4Cl溶液
酸性
Al2(SO4)3溶液
NaCl溶液
中性
KNO3溶液
为什么盐的组成不同,溶液的酸碱性
就不同呢?请以CH3COONa、NH4Cl、
NaCl为例展开分析讨论。
理论探究
醋酸钠在溶液中的变化:
CH3COONa
=
CH3COO_
+Na+
+
CH3COOH
强碱弱酸盐:
反馈练习:写出NaClO水解离子方程式
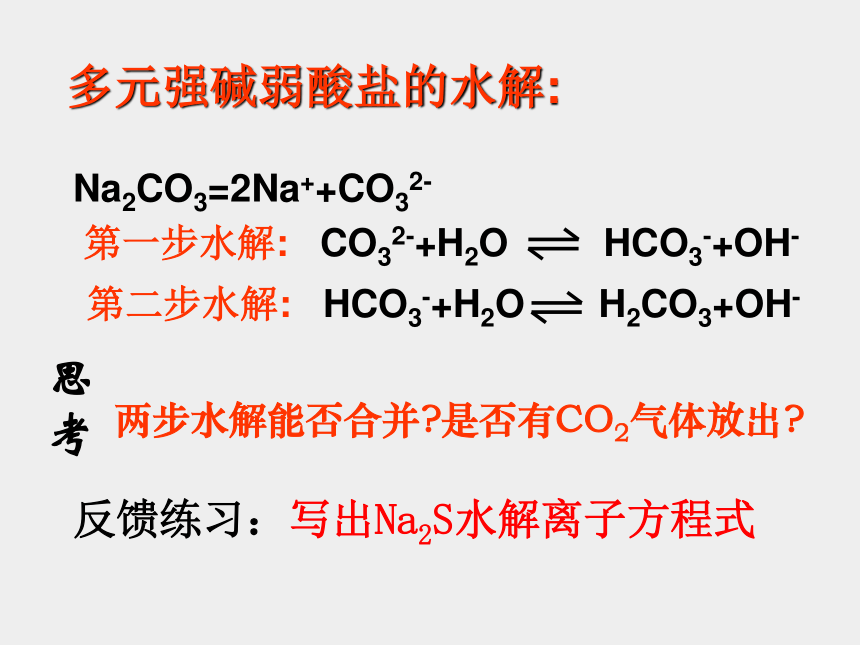
多元强碱弱酸盐的水解:
Na2CO3=2Na++CO32-
思考
两步水解能否合并?是否有CO2气体放出?
反馈练习:写出Na2S水解离子方程式
学生活动:
如何应用盐类水解的原理,分析NH4Cl
、
FeCl3溶液溶液显酸性的原因?并写出有关离子方程式。
NH4Cl
=
NH4+
+
Cl-
氯化铵在溶液中的变化:
强酸弱碱盐:
+
NH3.H2O
多元强酸弱碱盐:
例:FeCl3溶液:
思考:
反应生成的氢氧化铁是否写沉定
符号?
强酸强碱盐:
一
、盐类的水解
1、定义:在溶液中盐电离出来的离子跟
水所电离出来的H+或OH-结合生成
弱电解质的反应,叫做盐类的水
解。
2、实质:弱电解质的生成破坏了水的电
离平衡,增大了水的电离程度并
且常常使溶液呈酸性或碱性。
弱酸阴离子或
弱碱阳离子
弱酸或弱碱
4、水解反应与中和反应的关系:
3、水解的结果:
使溶液中
C(H+)
≠C(OH-)
水解反应是中和反应的逆反应。
(1)盐类水解的程度较小,用可逆号“
”
表示。
(2)盐类水解的产物很少,不会产生气体
或沉淀,不标“↓”或“↑”。
二、表示方法:
水解方程式、离子方程式
(3)多元弱酸根离子的水解分步写,一般只
写第一步。
(4)多元弱碱阳离子的水解一步到位。
各类盐水解的比较
探索规律
盐类
能否
水解
引起水解的离子
对水的电
离平衡的
影响
溶液的酸碱性
强碱弱酸盐
如(CH3COONa)
能
CH3COO-
弱酸根阴离子
促进
碱性
强酸弱碱盐
如(NH4Cl)
能
NH4+
弱碱根阳离子
促进
酸性
强酸强碱盐
如(NaCl)
否
无
无影响
中性
水解规律:
有弱才水解;
无弱不水解;
谁弱谁水解;
谁强显谁性;
都强显中性;
1.下列盐的水溶液中,哪些呈酸性(
)
哪些呈碱性(
)。
a.
FeCl3
b.
NaClO
c.
(NH4)2SO4
d.
AgNO3
e.
Na2S
f.
K2SO4
a
c
d
b
e
随堂练习
2.下列离子在水溶液中不会发生
水解的是(
)。
A、
NH4+
B、
SO42_
C、
Al3+
D、
HCO3-
B
3.
常温下,下列溶液PH小于7的是(
)。
A、KCl
B、CuSO4
C、Na2S
D、Ba(NO3)2
B
4.下列水解离子方程式正确的是
(
)
A、Fe3++3H2O
Fe(OH)3↓+3H+
B、Br-+H2O
HBr+OH-
C、CO32-+H2O
H2CO3+2OH-
D、NH4++
H2O
NH3.H2O
+H+
D
作
业:
课本P66-67
二、三
题
灭火器原理
内筒里面放入的什么是药品?
外筒放入的是什么药品?
泡沫灭火器里的药品是NaHCO3溶液和Al2(SO4)3溶液。
拓展与延伸
(第一课时)
教学目标:
知识目标:⒈理解盐类水解的概念,了解盐类水解的
实质,总结盐类水解反应的规律;
⒉学会正确书写盐类水解的化学(离子)
方程式。
能力目标:⒈培养学生逻辑思维、综合归纳能力,提
高学生思维品质;
⒉训练学生实验的基本操作技能。
德育目标:帮助学生树立应用所学知识解决实际问题
的理论联系实际的观点。
重点与难点:
盐类水解的本质,理解强酸弱碱盐与强碱弱酸盐的水解规律。
盐类水解方程式的书写与分析。
实验探究
请用pH试纸测定浓度均为0.1mol·L-1的CH3COONa、Na2CO3、NaCl、NH4Cl、Al2(SO4)3、KNO3溶液的pH,记录测定结果。
(注意操作要领)
现象与结论
碱性
碱性
中性
酸性
酸性
中性
>7
>7
<7
<7
=7
=7
实验方法
盐的溶液
PH
溶液的酸碱性
用
PH
试
纸
CH3COONa溶液
NH4Cl溶液
NaCl溶液
K2CO3溶液
Al2(SO4)3溶液
KNO3溶液
归类求同
对比求异
强碱弱酸
强酸弱碱
强酸强碱
盐溶液的酸碱性与生成该盐的
酸和碱的强弱间有什么关系?
盐的溶液
溶液的酸碱性
盐的组成
CH3COONa溶液
碱性
K2CO3溶液
NH4Cl溶液
酸性
Al2(SO4)3溶液
NaCl溶液
中性
KNO3溶液
为什么盐的组成不同,溶液的酸碱性
就不同呢?请以CH3COONa、NH4Cl、
NaCl为例展开分析讨论。
理论探究
醋酸钠在溶液中的变化:
CH3COONa
=
CH3COO_
+Na+
+
CH3COOH
强碱弱酸盐:
反馈练习:写出NaClO水解离子方程式
多元强碱弱酸盐的水解:
Na2CO3=2Na++CO32-
思考
两步水解能否合并?是否有CO2气体放出?
反馈练习:写出Na2S水解离子方程式
学生活动:
如何应用盐类水解的原理,分析NH4Cl
、
FeCl3溶液溶液显酸性的原因?并写出有关离子方程式。
NH4Cl
=
NH4+
+
Cl-
氯化铵在溶液中的变化:
强酸弱碱盐:
+
NH3.H2O
多元强酸弱碱盐:
例:FeCl3溶液:
思考:
反应生成的氢氧化铁是否写沉定
符号?
强酸强碱盐:
一
、盐类的水解
1、定义:在溶液中盐电离出来的离子跟
水所电离出来的H+或OH-结合生成
弱电解质的反应,叫做盐类的水
解。
2、实质:弱电解质的生成破坏了水的电
离平衡,增大了水的电离程度并
且常常使溶液呈酸性或碱性。
弱酸阴离子或
弱碱阳离子
弱酸或弱碱
4、水解反应与中和反应的关系:
3、水解的结果:
使溶液中
C(H+)
≠C(OH-)
水解反应是中和反应的逆反应。
(1)盐类水解的程度较小,用可逆号“
”
表示。
(2)盐类水解的产物很少,不会产生气体
或沉淀,不标“↓”或“↑”。
二、表示方法:
水解方程式、离子方程式
(3)多元弱酸根离子的水解分步写,一般只
写第一步。
(4)多元弱碱阳离子的水解一步到位。
各类盐水解的比较
探索规律
盐类
能否
水解
引起水解的离子
对水的电
离平衡的
影响
溶液的酸碱性
强碱弱酸盐
如(CH3COONa)
能
CH3COO-
弱酸根阴离子
促进
碱性
强酸弱碱盐
如(NH4Cl)
能
NH4+
弱碱根阳离子
促进
酸性
强酸强碱盐
如(NaCl)
否
无
无影响
中性
水解规律:
有弱才水解;
无弱不水解;
谁弱谁水解;
谁强显谁性;
都强显中性;
1.下列盐的水溶液中,哪些呈酸性(
)
哪些呈碱性(
)。
a.
FeCl3
b.
NaClO
c.
(NH4)2SO4
d.
AgNO3
e.
Na2S
f.
K2SO4
a
c
d
b
e
随堂练习
2.下列离子在水溶液中不会发生
水解的是(
)。
A、
NH4+
B、
SO42_
C、
Al3+
D、
HCO3-
B
3.
常温下,下列溶液PH小于7的是(
)。
A、KCl
B、CuSO4
C、Na2S
D、Ba(NO3)2
B
4.下列水解离子方程式正确的是
(
)
A、Fe3++3H2O
Fe(OH)3↓+3H+
B、Br-+H2O
HBr+OH-
C、CO32-+H2O
H2CO3+2OH-
D、NH4++
H2O
NH3.H2O
+H+
D
作
业:
课本P66-67
二、三
题
灭火器原理
内筒里面放入的什么是药品?
外筒放入的是什么药品?
泡沫灭火器里的药品是NaHCO3溶液和Al2(SO4)3溶液。
拓展与延伸
