人教版高二化学选修4第三章第一节 弱电解质的电离(共32张PPT)
文档属性
| 名称 | 人教版高二化学选修4第三章第一节 弱电解质的电离(共32张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 8.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-04 22:19:12 | ||
图片预览









文档简介
(共32张PPT)
CaCO3+H2O+CO2=Ca(HCO3)2
Ca(HCO3)2=CaCO3
+H2O+CO2
九乡溶洞奇观
地球是个“水球”,而酸、碱和盐在水溶液中的反应,以离子反应为特征。水就成了离子反应广泛存在的条件。
而离子反应发生都与“目标产物在水中的溶解度和电离程度有关。
本章的学习以化学平衡理论为基础,进一步探讨酸、碱、盐在水中的离子反应,探究化学平衡、电离程度和溶解度关系及其应用。
海南玉带滩
第三章
水溶液中的离子平衡
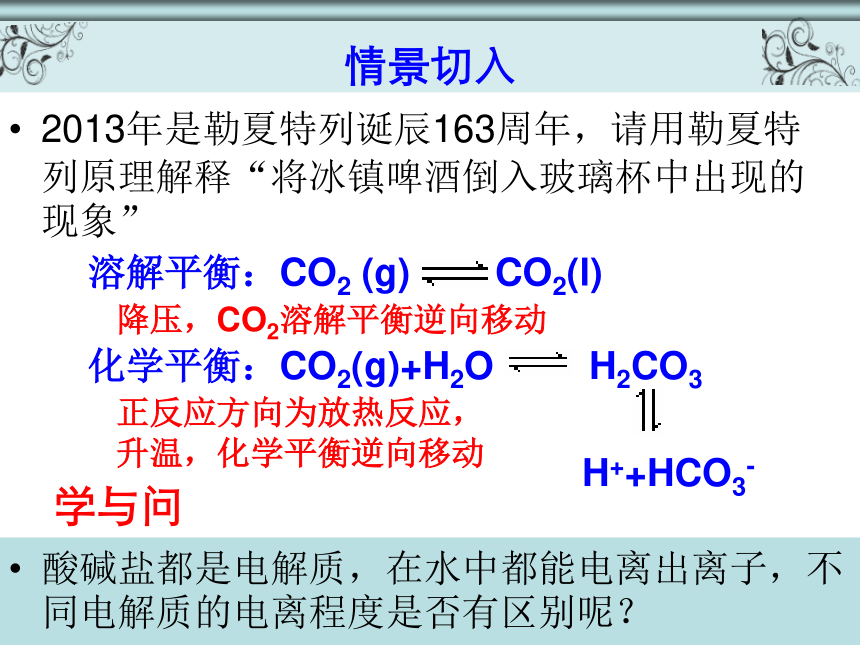
情景切入
2013年是勒夏特列诞辰163周年,请用勒夏特列原理解释“将冰镇啤酒倒入玻璃杯中出现的现象”
化学平衡:CO2(g)+H2O
H2CO3
H++HCO3-
学与问
酸碱盐都是电解质,在水中都能电离出离子,不同电解质的电离程度是否有区别呢?
降压,CO2溶解平衡逆向移动
正反应方向为放热反应,
升温,化学平衡逆向移动
第一节
弱电解质的电离
第三章
水溶液中的离子平衡
⒈了解强、弱电解质的概念。
⒉了解强、弱电解质与结构的关系,能正确书写常见物质的电离方程式。
⒊理解弱电解质的电离平衡,以及温度、浓度等条件对电离平衡的影响。
化学科课标及考试说明
高考考查的重点主要有:
3、同浓度强、弱电解质的比较,如氢离子浓度的大小、起始反应速率、中和碱的能力等。
2、弱电解质的电离平衡及其影响因素
1、强、弱电解质的概念、电离方程式
实践活动:你见过翩翩起舞的鸡蛋吗?
材料1:一个鸡蛋,一瓶冰醋酸、一个烧杯
材料2:一个鸡蛋,一瓶1mol/L
醋酸、一个烧杯
材料3:一个鸡蛋,一瓶1mol/L
盐酸,一个烧杯
请同学们认真思考、大胆猜想:冰醋酸与1mol/L
醋酸实验现象有什么不同?为什么?
1mol/L
醋酸、1mol/L
盐酸,现象有什么不同?为什么?
步骤:(1)把鸡蛋放入烧杯中
(2)将酸倒入烧杯
1组实践活动:你见过翩翩起舞的鸡蛋吗?
冰醋酸不会反应,
鸡蛋在1mol/L
盐酸比1mol/L
醋酸反应舞动要剧烈。
大胆猜想
分析原因:
冰醋酸无水不电离
盐酸是强酸,水中电离能力强,醋酸是弱酸,水中电离能力弱。因此说电解质电离有强弱之分。
合作探究
验证猜想
任务分配
内容
要求
展示
探究一
定性验证:1、实践活动,2、等体积、等浓度的盐酸、醋酸与等量镁条的反应。
认真合作
规范展示
1组
探究二
定量测定:测定相同浓度的盐酸和醋酸溶溶液的pH,进行数据分析,得出结论
2组
探究三
1、测定相同浓度的盐酸和醋酸稀释后溶液的pH,2、冰醋酸电离问题探究。
3组
探究
四
实验探究电离平衡影响因素
4组
1组实践活动:你见过翩翩起舞的鸡蛋吗?
冰醋酸不会反应,
鸡蛋在1mol/L
盐酸比1mol/L
醋酸反应舞动要剧烈。
大胆猜想
分析原因:
冰醋酸无水不电离
盐酸是强酸,水中电离能力强,醋酸是弱酸,水中电离能力弱,因此说电解质有强弱之分。
合作探究、验证猜想:
1组实验展示
Mg条
1mol/L
盐酸
1mol/L
醋酸
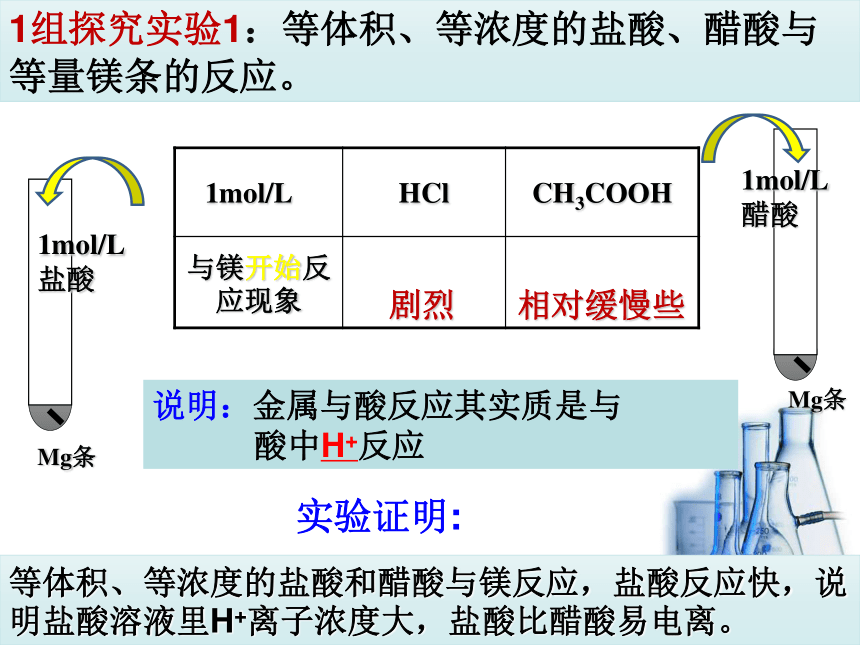
1组探究实验1:等体积、等浓度的盐酸、醋酸与等量镁条的反应。
剧烈
相对缓慢些
Mg条
等体积、等浓度的盐酸和醋酸与镁反应,盐酸反应快,说明盐酸溶液里H+离子浓度大,盐酸比醋酸易电离。
说明:金属与酸反应其实质是与
酸中H+反应
实验证明:
1mol/L
HCl
CH3COOH
与镁开始反应现象
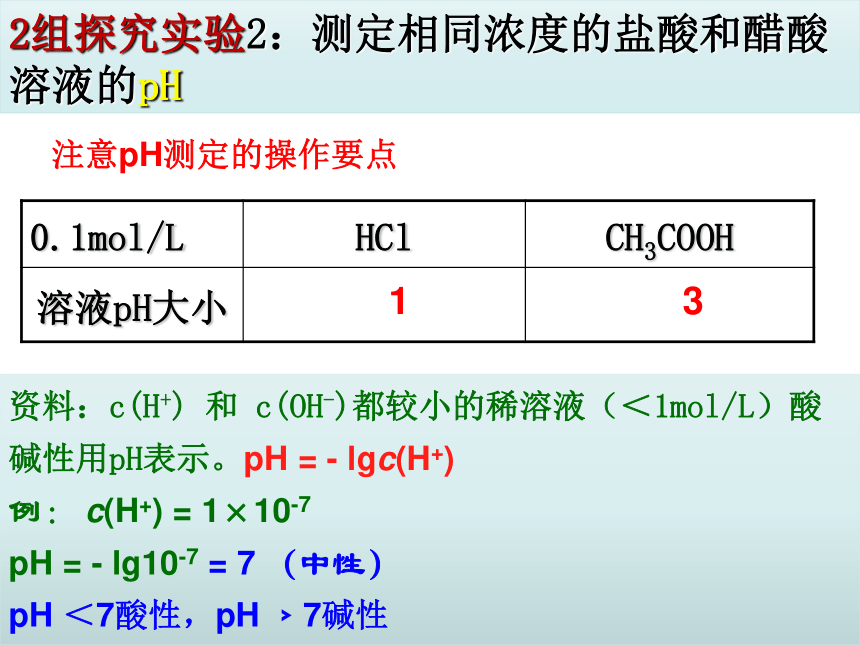
2组探究实验2:测定相同浓度的盐酸和醋酸溶液的pH
资料:c(H+)
和
c(OH-)都较小的稀溶液(<1mol/L)酸碱性用pH表示。pH
=
-
lgc(H+)
例:
c(H+)
=
1×10-7
pH
=
-
lg10-7
=
7
(中性)
pH
<7酸性,pH
﹥7碱性
1
3
注意pH测定的操作要点
0.1mol/L
HCl
CH3COOH
溶液pH大小
0.1mol/L
盐酸中的粒子浓度
0
0.1
0.1
说明:
实验数据定量分析:
0.1mol/L
醋酸中的粒子浓度
说明:
0.001
0.099
HCl电离是完全的。称为强电解质
CH3COOH分子、离子共存,
CH3COOH部分电离
!称为弱电解质
mol/L
c
(HCl)
c
(H+)
c
(Cl-)
电离后
c(CH3COOH)
c(H+)
c(CH3COO-)
电离后
0.001
实验探究结论:
用树状分类法表示物质分类关系。
混合物
非电解质
物
化合物
质
纯净物
电解质
单质
强电解质
弱电解质
1、强电解质:
常见的强电解质:
在水分子作用下,能够完全电离为离子的化合物
3
2、弱电解质:
3
一、强电解质与弱电解质
1组:自主预习,感悟教材
强酸、强碱和大多数盐、
活泼金属氧化物
弱酸、弱碱和水
在水分子作用下,只有部分分子电离为离子的化合物
常见弱电解质:
变式训练
判断下列物质哪些是混合物、单质、非电解质、强电解质、弱电解质
H2SO4
NaOH
CuSO4
NaCl
NH3
HCl
SO2
CO2
Cl2
CH4
BaSO4
CH3COOH
H2CO3
Cu
NH3·H2O
(CH3COO)2Pb
盐酸
C2H5OH
H2O
H2O
物质
混合物
纯净物
单质
化合物
电解质
非电解质
强电解质
弱电解质
强碱
大多数盐
活泼金属氧化物
强酸
弱酸
弱碱
水
某些有机物
某些非金属氧化物
离子化合物
共价化合物
从物质分类角度来看电解质
2组关注:
醋酸与盐酸电离程度的不同
在电离方程式中如何体现呢?
思考与交流:
1组关注:书写电离方程式应注意哪些问题?
⑵弱电解质部分电离,用可逆符号;
NaHSO4
=
Na+
+
H+
+
SO42-
⑹弱酸酸式盐强中有弱.
H2S
H++HS-;
HS-
H++S2-
H2SO4==2H++SO42-
Al(OH)3
Al3++3OH-
⑸强酸酸式盐完全电离;
⑷多元弱碱用一步电离来表示;
⑶多元弱酸分步电离,要分步写;
⑴
强电解质完全电离,用等号;
NaHS
=
Na+
+
HS-
HS-
H++S2-
1.取两只小烧杯,分别盛50ml蒸馏水。
0.1mol/L
HCl
2.
分别滴1滴0.1
mol/L
HCl、0.1
mol/L
CH3COOH
0.1
mol/L
CH3COOH
3.搅拌后,分别测量pH
3组实验探究3:
醋酸在水中的电离过程是动态的,其电离程度随着溶液的稀释而增强。
4
〈6
结论:
0.1mol/L
HCl
CH3COOH
稀释
1000倍后
反应速率
V(电离)
V(结合)
V(电离)
=
V(结合)
电离平衡状态
时间
二、弱电解质的电离平衡
CH3COOH
CH3COO
-
+
H+
电离
结合
CH3COOH
CH3COO
-
+
H+
CH3COO-+H+
→
CH3COOH
3组:自主预习,感悟教材
由弱电解质(
CH3COOH)电离方程式:
(2)a、b、c三点溶液C(H+)由
小到大的顺序为
;
(3)
a、b、c三点中电离程度最大的是
无自由移动的离子
(1)“O”点导电能力为0的理由是
c
<
a
<
b
c
【感悟高考】冰醋酸加水稀释过程导电性的变化如图所示:
变式训练
3组问题探究
冰醋酸电离情况探究:向2ml冰醋酸中缓慢加水绘制V/(ml)-I(mA)即电流随水量增加变化图像如下。分析原因完成变式训练
.
痛风是一种古老的疾病,早在公元前三世纪《希波克拉底全集》中论及痛风以来,距今已有2300多年。古代中医学将其归于“风痹症”,痛风是一种遍及全球的疾病,越是经济发达的国家,发病率越高,故有富贵病之称。
众所周知,高嘌呤饮食,饮酒,疲劳是痛风病发作的常见原因,气候变化也与痛风关系密切,为何痛风,好发在天冷的季节?
4组课题研究:为什么痛风好在天冷的季节发病?
课题研究
0.1mol/L
盐酸
0.1mol/L
醋酸CH3COOH
1.分别加入5mL0.1mol/L
盐酸、0.1mol/L
醋酸
2.分别加入0.5g晶体NaCl、0.5g晶CH3COONa
3.搅拌后,分别测量pH
0.5g晶体NaCl
0.5g晶体CH3COONa
4组实验探究4:
探究结论:
加入与弱电解质相同离子,可抑制弱电解质的电离
如果加入Na2CO3,对醋酸电离平衡有何影响?
思考与交流:
1
〉3
0.1mol/L
HCl
CH3COOH
溶液pH大小
三、影响电离平衡的因素
(一)内因:电解质本身的性质
(二)外因:
1、浓度:①加水稀释溶液时,电离平衡向右移动促进了弱电解质的电离,而离子浓度会减小。若增加弱电解质的量(即增大浓度,其本身的转化率减小),电离平衡向右移动。
2、温度:升温度促进电离。
②同离子效应:在某电解质溶液中,加入含有某一相同离子的另一电解质,会抑制电解质的电离。
③能反应的离子:加入能与电解质电离出来的离子发生反应的另一物质,会促进电解质的电离。
4组:自主预习,感悟教材
1组核心突破一
强、弱电解质的比较
完全电离
部分电离
不可逆过程
可逆过程
用等号
用可逆符号
水合离子
分子、水合离子
化学式和离子符号
分子式和离子符号
强酸、强碱、多数盐、活泼金属氧化物
弱酸、弱碱、水
都是电解质,在水溶液中都能电离。
强电解质
弱电解质
相同点
电离程度
电离过程
电离方程式
电解质在溶液中微粒形式
离子方程式中表示形式
物质种类
下列叙述中,正确的是(
)
A、CaCO3难溶于水,它属于弱电解质
B、溶解于水中能导电的物质一定是电解质
C、水是极弱的电解质
D、10-3mol/L的盐酸的导电性比2mol/L的醋酸的导电性差,所以醋酸为强电解质
C
易错点:区分强弱电解质的唯一标准:电解质在水溶液是否完全电离。与电解质的溶解度和导电能力无关;难溶盐如CaCO3溶解那部分全电离是强电解质,
CO2等溶于水发生反应而导电,不属于电解质。
纠错补练
3组核心突破二
体积、物质的量浓度的均相同盐酸和醋酸,对比下列各项
大
小
小
大
快
慢
相等
相等
对比项目
c(H+)
pH
与足量Mg反应
完全中和消耗NaOH的量
开始速率
生成H2总量
盐酸
(HCl)
醋酸
(CH3COOH)
有0.1
mol/L的盐酸、醋酸、硫酸各50ml,试比较:
(1)三种酸里氢离子浓度由大到小的顺序是
。
(2)三种酸与足量的锌反应,开始时产生H2的速是
。
(3)三种酸与足量的锌反应产生H2的体积是
。
硫酸>盐酸>醋酸
硫酸>盐酸>醋酸
硫酸>盐酸=
醋酸
纠错补练
易错点:忽视多元酸电离
c(CH3COOH)
c(H+)
c(CH3COO-)
电离程度
pH值
增大
减小
增大
增大
减小
减小
减小
增大
增大
增大
增大
增大
减小
减小
减小
减小
减小
减小
增大
增大
增大
减小
减小
减小
增大
一定温度下,浓度为0.1mol/L的醋酸溶液中存在如下电离平衡:CH3COOH
CH3COO-+H+
,改变下表所示的条件,对溶液中有关微粒的浓度、醋酸的电离程度、溶液的pH有何影响(用“增大”、“减小”或“不变”字样填写有关空格)?
4组核心突破三
电离平衡的影响因素
加入固体
CH3COONa
加入NaOH
通入氯化氢
加入蒸馏水
降低温度
(2006全国Ⅰ理综)在0.1mol/L的CH3COOH溶液中存在如下电离平衡:
CH3COOH
CH3COO-
+
H+
对于该平衡,下列叙述正确的是
(
)
A.加入水时,平衡向逆反应方向移动.
B.加入少量NaOH固体,平衡向正反应方向移动.
C.加入少量0.1mol/LHCl溶液,溶液中C(H+)减少.
D.加入少量CH3COONa固体,平衡向正反应方向移动.
B
纠错补练
易错点:平衡移动原理强调“削弱但不能消除”
小结
高考考查的主要内容有:
3、同浓度强、弱电解质的比较,如氢离子浓度的大小、起始反应速率、中和碱的能力等。
2、弱电解质的电离平衡及其影响因素
1、强、弱电解质的概念、电离方程式
布置作业
阅读作业:教材P42页科学视野“电离平衡常数”
习题作业:教材P44页习题4
CaCO3+H2O+CO2=Ca(HCO3)2
Ca(HCO3)2=CaCO3
+H2O+CO2
九乡溶洞奇观
地球是个“水球”,而酸、碱和盐在水溶液中的反应,以离子反应为特征。水就成了离子反应广泛存在的条件。
而离子反应发生都与“目标产物在水中的溶解度和电离程度有关。
本章的学习以化学平衡理论为基础,进一步探讨酸、碱、盐在水中的离子反应,探究化学平衡、电离程度和溶解度关系及其应用。
海南玉带滩
第三章
水溶液中的离子平衡
情景切入
2013年是勒夏特列诞辰163周年,请用勒夏特列原理解释“将冰镇啤酒倒入玻璃杯中出现的现象”
化学平衡:CO2(g)+H2O
H2CO3
H++HCO3-
学与问
酸碱盐都是电解质,在水中都能电离出离子,不同电解质的电离程度是否有区别呢?
降压,CO2溶解平衡逆向移动
正反应方向为放热反应,
升温,化学平衡逆向移动
第一节
弱电解质的电离
第三章
水溶液中的离子平衡
⒈了解强、弱电解质的概念。
⒉了解强、弱电解质与结构的关系,能正确书写常见物质的电离方程式。
⒊理解弱电解质的电离平衡,以及温度、浓度等条件对电离平衡的影响。
化学科课标及考试说明
高考考查的重点主要有:
3、同浓度强、弱电解质的比较,如氢离子浓度的大小、起始反应速率、中和碱的能力等。
2、弱电解质的电离平衡及其影响因素
1、强、弱电解质的概念、电离方程式
实践活动:你见过翩翩起舞的鸡蛋吗?
材料1:一个鸡蛋,一瓶冰醋酸、一个烧杯
材料2:一个鸡蛋,一瓶1mol/L
醋酸、一个烧杯
材料3:一个鸡蛋,一瓶1mol/L
盐酸,一个烧杯
请同学们认真思考、大胆猜想:冰醋酸与1mol/L
醋酸实验现象有什么不同?为什么?
1mol/L
醋酸、1mol/L
盐酸,现象有什么不同?为什么?
步骤:(1)把鸡蛋放入烧杯中
(2)将酸倒入烧杯
1组实践活动:你见过翩翩起舞的鸡蛋吗?
冰醋酸不会反应,
鸡蛋在1mol/L
盐酸比1mol/L
醋酸反应舞动要剧烈。
大胆猜想
分析原因:
冰醋酸无水不电离
盐酸是强酸,水中电离能力强,醋酸是弱酸,水中电离能力弱。因此说电解质电离有强弱之分。
合作探究
验证猜想
任务分配
内容
要求
展示
探究一
定性验证:1、实践活动,2、等体积、等浓度的盐酸、醋酸与等量镁条的反应。
认真合作
规范展示
1组
探究二
定量测定:测定相同浓度的盐酸和醋酸溶溶液的pH,进行数据分析,得出结论
2组
探究三
1、测定相同浓度的盐酸和醋酸稀释后溶液的pH,2、冰醋酸电离问题探究。
3组
探究
四
实验探究电离平衡影响因素
4组
1组实践活动:你见过翩翩起舞的鸡蛋吗?
冰醋酸不会反应,
鸡蛋在1mol/L
盐酸比1mol/L
醋酸反应舞动要剧烈。
大胆猜想
分析原因:
冰醋酸无水不电离
盐酸是强酸,水中电离能力强,醋酸是弱酸,水中电离能力弱,因此说电解质有强弱之分。
合作探究、验证猜想:
1组实验展示
Mg条
1mol/L
盐酸
1mol/L
醋酸
1组探究实验1:等体积、等浓度的盐酸、醋酸与等量镁条的反应。
剧烈
相对缓慢些
Mg条
等体积、等浓度的盐酸和醋酸与镁反应,盐酸反应快,说明盐酸溶液里H+离子浓度大,盐酸比醋酸易电离。
说明:金属与酸反应其实质是与
酸中H+反应
实验证明:
1mol/L
HCl
CH3COOH
与镁开始反应现象
2组探究实验2:测定相同浓度的盐酸和醋酸溶液的pH
资料:c(H+)
和
c(OH-)都较小的稀溶液(<1mol/L)酸碱性用pH表示。pH
=
-
lgc(H+)
例:
c(H+)
=
1×10-7
pH
=
-
lg10-7
=
7
(中性)
pH
<7酸性,pH
﹥7碱性
1
3
注意pH测定的操作要点
0.1mol/L
HCl
CH3COOH
溶液pH大小
0.1mol/L
盐酸中的粒子浓度
0
0.1
0.1
说明:
实验数据定量分析:
0.1mol/L
醋酸中的粒子浓度
说明:
0.001
0.099
HCl电离是完全的。称为强电解质
CH3COOH分子、离子共存,
CH3COOH部分电离
!称为弱电解质
mol/L
c
(HCl)
c
(H+)
c
(Cl-)
电离后
c(CH3COOH)
c(H+)
c(CH3COO-)
电离后
0.001
实验探究结论:
用树状分类法表示物质分类关系。
混合物
非电解质
物
化合物
质
纯净物
电解质
单质
强电解质
弱电解质
1、强电解质:
常见的强电解质:
在水分子作用下,能够完全电离为离子的化合物
3
2、弱电解质:
3
一、强电解质与弱电解质
1组:自主预习,感悟教材
强酸、强碱和大多数盐、
活泼金属氧化物
弱酸、弱碱和水
在水分子作用下,只有部分分子电离为离子的化合物
常见弱电解质:
变式训练
判断下列物质哪些是混合物、单质、非电解质、强电解质、弱电解质
H2SO4
NaOH
CuSO4
NaCl
NH3
HCl
SO2
CO2
Cl2
CH4
BaSO4
CH3COOH
H2CO3
Cu
NH3·H2O
(CH3COO)2Pb
盐酸
C2H5OH
H2O
H2O
物质
混合物
纯净物
单质
化合物
电解质
非电解质
强电解质
弱电解质
强碱
大多数盐
活泼金属氧化物
强酸
弱酸
弱碱
水
某些有机物
某些非金属氧化物
离子化合物
共价化合物
从物质分类角度来看电解质
2组关注:
醋酸与盐酸电离程度的不同
在电离方程式中如何体现呢?
思考与交流:
1组关注:书写电离方程式应注意哪些问题?
⑵弱电解质部分电离,用可逆符号;
NaHSO4
=
Na+
+
H+
+
SO42-
⑹弱酸酸式盐强中有弱.
H2S
H++HS-;
HS-
H++S2-
H2SO4==2H++SO42-
Al(OH)3
Al3++3OH-
⑸强酸酸式盐完全电离;
⑷多元弱碱用一步电离来表示;
⑶多元弱酸分步电离,要分步写;
⑴
强电解质完全电离,用等号;
NaHS
=
Na+
+
HS-
HS-
H++S2-
1.取两只小烧杯,分别盛50ml蒸馏水。
0.1mol/L
HCl
2.
分别滴1滴0.1
mol/L
HCl、0.1
mol/L
CH3COOH
0.1
mol/L
CH3COOH
3.搅拌后,分别测量pH
3组实验探究3:
醋酸在水中的电离过程是动态的,其电离程度随着溶液的稀释而增强。
4
〈6
结论:
0.1mol/L
HCl
CH3COOH
稀释
1000倍后
反应速率
V(电离)
V(结合)
V(电离)
=
V(结合)
电离平衡状态
时间
二、弱电解质的电离平衡
CH3COOH
CH3COO
-
+
H+
电离
结合
CH3COOH
CH3COO
-
+
H+
CH3COO-+H+
→
CH3COOH
3组:自主预习,感悟教材
由弱电解质(
CH3COOH)电离方程式:
(2)a、b、c三点溶液C(H+)由
小到大的顺序为
;
(3)
a、b、c三点中电离程度最大的是
无自由移动的离子
(1)“O”点导电能力为0的理由是
c
<
a
<
b
c
【感悟高考】冰醋酸加水稀释过程导电性的变化如图所示:
变式训练
3组问题探究
冰醋酸电离情况探究:向2ml冰醋酸中缓慢加水绘制V/(ml)-I(mA)即电流随水量增加变化图像如下。分析原因完成变式训练
.
痛风是一种古老的疾病,早在公元前三世纪《希波克拉底全集》中论及痛风以来,距今已有2300多年。古代中医学将其归于“风痹症”,痛风是一种遍及全球的疾病,越是经济发达的国家,发病率越高,故有富贵病之称。
众所周知,高嘌呤饮食,饮酒,疲劳是痛风病发作的常见原因,气候变化也与痛风关系密切,为何痛风,好发在天冷的季节?
4组课题研究:为什么痛风好在天冷的季节发病?
课题研究
0.1mol/L
盐酸
0.1mol/L
醋酸CH3COOH
1.分别加入5mL0.1mol/L
盐酸、0.1mol/L
醋酸
2.分别加入0.5g晶体NaCl、0.5g晶CH3COONa
3.搅拌后,分别测量pH
0.5g晶体NaCl
0.5g晶体CH3COONa
4组实验探究4:
探究结论:
加入与弱电解质相同离子,可抑制弱电解质的电离
如果加入Na2CO3,对醋酸电离平衡有何影响?
思考与交流:
1
〉3
0.1mol/L
HCl
CH3COOH
溶液pH大小
三、影响电离平衡的因素
(一)内因:电解质本身的性质
(二)外因:
1、浓度:①加水稀释溶液时,电离平衡向右移动促进了弱电解质的电离,而离子浓度会减小。若增加弱电解质的量(即增大浓度,其本身的转化率减小),电离平衡向右移动。
2、温度:升温度促进电离。
②同离子效应:在某电解质溶液中,加入含有某一相同离子的另一电解质,会抑制电解质的电离。
③能反应的离子:加入能与电解质电离出来的离子发生反应的另一物质,会促进电解质的电离。
4组:自主预习,感悟教材
1组核心突破一
强、弱电解质的比较
完全电离
部分电离
不可逆过程
可逆过程
用等号
用可逆符号
水合离子
分子、水合离子
化学式和离子符号
分子式和离子符号
强酸、强碱、多数盐、活泼金属氧化物
弱酸、弱碱、水
都是电解质,在水溶液中都能电离。
强电解质
弱电解质
相同点
电离程度
电离过程
电离方程式
电解质在溶液中微粒形式
离子方程式中表示形式
物质种类
下列叙述中,正确的是(
)
A、CaCO3难溶于水,它属于弱电解质
B、溶解于水中能导电的物质一定是电解质
C、水是极弱的电解质
D、10-3mol/L的盐酸的导电性比2mol/L的醋酸的导电性差,所以醋酸为强电解质
C
易错点:区分强弱电解质的唯一标准:电解质在水溶液是否完全电离。与电解质的溶解度和导电能力无关;难溶盐如CaCO3溶解那部分全电离是强电解质,
CO2等溶于水发生反应而导电,不属于电解质。
纠错补练
3组核心突破二
体积、物质的量浓度的均相同盐酸和醋酸,对比下列各项
大
小
小
大
快
慢
相等
相等
对比项目
c(H+)
pH
与足量Mg反应
完全中和消耗NaOH的量
开始速率
生成H2总量
盐酸
(HCl)
醋酸
(CH3COOH)
有0.1
mol/L的盐酸、醋酸、硫酸各50ml,试比较:
(1)三种酸里氢离子浓度由大到小的顺序是
。
(2)三种酸与足量的锌反应,开始时产生H2的速是
。
(3)三种酸与足量的锌反应产生H2的体积是
。
硫酸>盐酸>醋酸
硫酸>盐酸>醋酸
硫酸>盐酸=
醋酸
纠错补练
易错点:忽视多元酸电离
c(CH3COOH)
c(H+)
c(CH3COO-)
电离程度
pH值
增大
减小
增大
增大
减小
减小
减小
增大
增大
增大
增大
增大
减小
减小
减小
减小
减小
减小
增大
增大
增大
减小
减小
减小
增大
一定温度下,浓度为0.1mol/L的醋酸溶液中存在如下电离平衡:CH3COOH
CH3COO-+H+
,改变下表所示的条件,对溶液中有关微粒的浓度、醋酸的电离程度、溶液的pH有何影响(用“增大”、“减小”或“不变”字样填写有关空格)?
4组核心突破三
电离平衡的影响因素
加入固体
CH3COONa
加入NaOH
通入氯化氢
加入蒸馏水
降低温度
(2006全国Ⅰ理综)在0.1mol/L的CH3COOH溶液中存在如下电离平衡:
CH3COOH
CH3COO-
+
H+
对于该平衡,下列叙述正确的是
(
)
A.加入水时,平衡向逆反应方向移动.
B.加入少量NaOH固体,平衡向正反应方向移动.
C.加入少量0.1mol/LHCl溶液,溶液中C(H+)减少.
D.加入少量CH3COONa固体,平衡向正反应方向移动.
B
纠错补练
易错点:平衡移动原理强调“削弱但不能消除”
小结
高考考查的主要内容有:
3、同浓度强、弱电解质的比较,如氢离子浓度的大小、起始反应速率、中和碱的能力等。
2、弱电解质的电离平衡及其影响因素
1、强、弱电解质的概念、电离方程式
布置作业
阅读作业:教材P42页科学视野“电离平衡常数”
习题作业:教材P44页习题4
