苏教版高中化学必修二 2.3第三单元 化学能与电能的转化--化学能转化为电能 (共25张PPT)
文档属性
| 名称 | 苏教版高中化学必修二 2.3第三单元 化学能与电能的转化--化学能转化为电能 (共25张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 7.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-05 00:00:00 | ||
图片预览








文档简介
(共25张PPT)
§2-3-1.
化学能转化为电能
专题2
化学反应与能量转化
第三单元
化学能与电能的转化
化学
2
需用到各类电池
1780年,意大利解剖学家伽伏尼在做青蛙解剖时,两手分别拿着不同的金属器械,无意中同时碰到了青蛙的大腿上,青蛙的腿立刻抽搐了一下,仿佛受到了电流的刺激,而只用一种金属器械去触动青蛙,却并无此反应。这种现象在当时被认为是一种“生物电”。
(意大利生物学家伽伏尼)
电池研究和发明历程
意大利物理学家、化学家伏特在多次实验后认为青蛙的肌肉之所以能产生电流,是肌肉中的某种液体起作用,为了论证自己的观点,1799年伏特把一块锌块和一块银板浸在盐水里,发现连接两块金属的导线有电流通过,伏特也因此发明了世界上第一块电池——“伏打电池”。
(意大利物理学家、化学家伏特)
电池研究和发明历程
1836年,利用铜、锌、稀硫酸等,制作出了第一个能保持平稳电流的电池。
(英国电化学家丹尼尔)
(英国发明家赫勒森)
1887年,发明了最早的锌锰干电池,这是当今社会广泛使用的干电池的雏形。
电池研究和发明历程
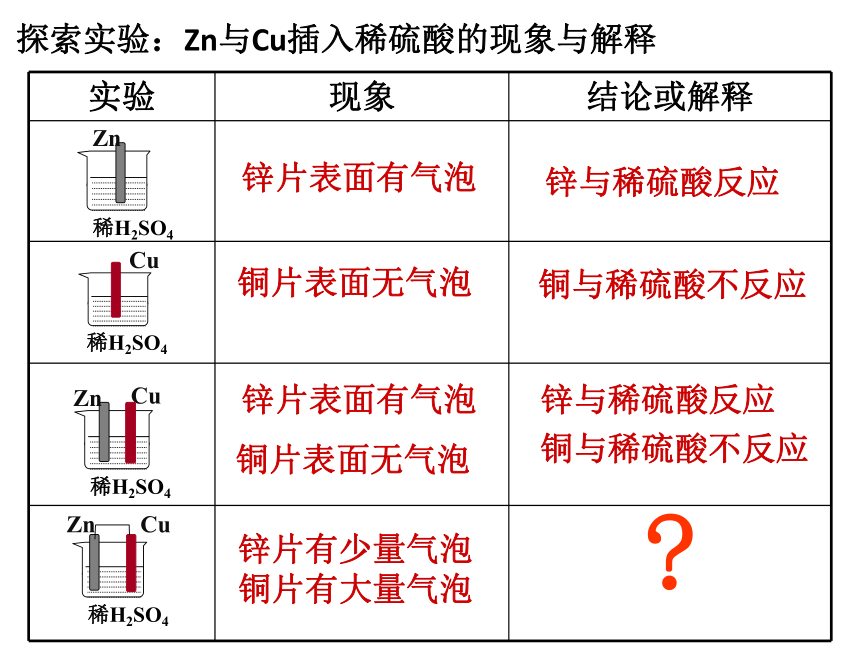
探索实验:Zn与Cu插入稀硫酸的现象与解释
实验
现象
结论或解释
锌片表面有气泡
铜片表面无气泡
铜与稀硫酸不反应
锌与稀硫酸反应
?
锌片有少量气泡铜片有大量气泡
Cu
Zn
稀H2SO4
Cu
Zn
稀H2SO4
Cu
稀H2SO4
Zn
稀H2SO4
锌片表面有气泡
铜片表面无气泡
锌与稀硫酸反应
铜与稀硫酸不反应
1.铜片上的气体是什么?
2.H2如何产生?
4.铜未失去电子,所需要的电子从哪来?
5.如何证明导线中有电子通过?
问题探究
Cu
Zn
稀H2SO4
氢气
H+得电子产生氢气;
锌失去的电子经过导线流向铜片。
3.铜片上产生了气体(H2),说明H+在铜的表面得到了电子,电子是否是铜失去的?如何检验?请设计出你的实验方案。
方案1:称量实验前后铜片或锌片的质量。
方案2:观察溶液的颜色,看有无Cu2+生成
实验步骤
现象
结论或解释
锌溶解,铜表面有气泡,电流计指针偏转;
导线中有电流通过
化学能转化为电能。
A
Zn
Cu
稀H2SO4
思考:1.电子从Zn到H+经历了哪些途径?
2.你认为这个过程能量是如何转化的?
1、原电池:将化学能转变为电能的装置
一、化学能转化为电能
2.原电池的工作原理:
使氧化还原反应中的还原剂和氧化剂之间通过外电路间接地进行电子转移
负极
正极
Zn-2e-=Zn2+
2H+
+2e-=H2
还原剂(Zn)失去电子,发生氧化反应
氧化剂(H+)在铜极上得到电子,发生还原反应
还原剂失去的电子从锌极流出
流入铜极.
经外电路
Zn2+
H+
SO42-
电流方向
2.原电池的工作原理:
思考:原电池由几部分组成,它的构成条件是什么?
3.原电池的组成及构成条件:
(1)存在自发的氧化还原反应
(确定氧化剂与还原剂)
(2)两电极(一般是活泼性不同的导电材料)
电极
定义
反应类型
电极特点
负极
正极
电子流出的一极
电子流入的一极
发生氧化反应
发生还原反应
起导电作用,也可能作还原剂参加反应,一般是较活泼的电极
起导电作用,电极不参加反应,一般是较不活泼的电极
铜-锌-稀硫酸原电池
电极
电极材料
电极反应式
反应类型
电池总反应
氧化反应
Zn-2e-=
Zn2+
2H+
+
2e-=H2↑
Zn+2H+=Zn2++H2↑
还原反应
Zn片
Cu片
负极
正极
电极反应式
A
Zn
Cu
稀H2SO4
3.原电池的组成及构成条件:
(3)存在电解质溶液
(4)形成闭合回路
外电路:电子由负极→正极,
电流由正极→负极。
内电路:阴离子移向负极,
阳离子移向正极;
注意:电子不下水,离子不上岸。
小结:原电池的组成
五要素:
氧化剂、还原剂、负极、正极、电解质溶液
掌握:
两电极
两反应
两移动
1.下列哪些装置能产生电流,形成原电池?
(1)
稀H2SO4
Zn
Fe
A
(4)
A
CuSO4
溶液
Zn
Zn
(5)
A
CuSO4
溶液
Zn
Cu
(6)
稀H2SO4
Fe
C
A
(2)
酒精
Zn
Cu
A
(3)
Zn
Cu
稀H2SO4
稀H2SO4
A
√
√
√
×
×
×
2.写出装置B
、C
的电池总反应式和电极反应式
G
Zn
Cu
硫酸铜
G
Fe
C
稀硫酸
B
C
电池总反应:Zn+Cu2+=Zn2++Cu
负极(Zn)
Zn-2e-=Zn2+
正极(Cu)
Cu2++2e-=Cu
电池总反应:Fe+2H+=Fe2++H2↑
负极(Fe)
Fe-2e-=Fe2+
正极(C)
2H++2e-=H2↑
3.根据原电池的组成条件,将氧化还原反应:
Cu+2FeCl3=CuCl2+2FeCl2设计成一个原电池,画出装置图并写出电极反应式。
Cu
C
FeCl3溶液
4、 原电池原理的应用
(1).加快氧化还原反应速率
同一个氧化还原反应设计成原电池,会加快其反应速率。
应用:a.用粗锌和硫酸反应制H2,比用纯锌反应制H2的速率快;原因是粗锌中的杂质和锌、稀H2SO4形成原电池,加快了反应,使产生H2的速率加快。
b.往锌和硫酸反应的溶液中,滴入几滴CuSO4溶液,产生气泡速率会变快;原因是锌置换出铜,锌、铜、稀H2SO4形成原电池,加快了反应,使产生H2的速率加快。
(2)比较金属的活动性强弱
原电池中,一般活动性强的金属为负极
例.某金属能跟稀盐酸作用发出氢气,该金属与锌组成原电池时,锌为负极,此金属是(
)
A.Mg
B.Fe
C.Al
D.Cu
B
强化训练:
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为(
)
A.a
>
b
>
c
>
d
B.a
>
c
>
d
>
b
C.c
>
a
>
b
.>
d
D.b
>
d
>
c
>
a
B
钢铁的电化学腐蚀
吸氧腐蚀:
负极:Fe—2e—=Fe2+
正极:2H2O+O2+4e—=4OH—
Fe2+
+2OH—
=Fe(OH)2
4Fe(OH)2+2H20+O2
=
4Fe(OH)3
2Fe(OH)3=Fe2O3+3H2O
(3)解释金属的腐蚀与防护:
原理:在潮湿空气中钢铁表面
形成无数微小的原电池。
负极(Fe):
正极(C):
Fe
-
2e?
=
Fe2+
析氢腐蚀
H2SO4
电解液酸性
钢铁的电化学腐蚀
2H+
+
2e-
=
H2↑
Fe
+2H+
=
Fe2+
+
H2↑
总反应:
轮船船体都是钢铁的,长期浸在水中,易被腐蚀,为了保护轮船船体,通常在轮船外壳镶嵌锌块,为什么?
电化学防护:
4.设计化学电源
从理论上说,所有自发的氧化还原反应都可设计成原电池。
§2-3-1.
化学能转化为电能
专题2
化学反应与能量转化
第三单元
化学能与电能的转化
化学
2
需用到各类电池
1780年,意大利解剖学家伽伏尼在做青蛙解剖时,两手分别拿着不同的金属器械,无意中同时碰到了青蛙的大腿上,青蛙的腿立刻抽搐了一下,仿佛受到了电流的刺激,而只用一种金属器械去触动青蛙,却并无此反应。这种现象在当时被认为是一种“生物电”。
(意大利生物学家伽伏尼)
电池研究和发明历程
意大利物理学家、化学家伏特在多次实验后认为青蛙的肌肉之所以能产生电流,是肌肉中的某种液体起作用,为了论证自己的观点,1799年伏特把一块锌块和一块银板浸在盐水里,发现连接两块金属的导线有电流通过,伏特也因此发明了世界上第一块电池——“伏打电池”。
(意大利物理学家、化学家伏特)
电池研究和发明历程
1836年,利用铜、锌、稀硫酸等,制作出了第一个能保持平稳电流的电池。
(英国电化学家丹尼尔)
(英国发明家赫勒森)
1887年,发明了最早的锌锰干电池,这是当今社会广泛使用的干电池的雏形。
电池研究和发明历程
探索实验:Zn与Cu插入稀硫酸的现象与解释
实验
现象
结论或解释
锌片表面有气泡
铜片表面无气泡
铜与稀硫酸不反应
锌与稀硫酸反应
?
锌片有少量气泡铜片有大量气泡
Cu
Zn
稀H2SO4
Cu
Zn
稀H2SO4
Cu
稀H2SO4
Zn
稀H2SO4
锌片表面有气泡
铜片表面无气泡
锌与稀硫酸反应
铜与稀硫酸不反应
1.铜片上的气体是什么?
2.H2如何产生?
4.铜未失去电子,所需要的电子从哪来?
5.如何证明导线中有电子通过?
问题探究
Cu
Zn
稀H2SO4
氢气
H+得电子产生氢气;
锌失去的电子经过导线流向铜片。
3.铜片上产生了气体(H2),说明H+在铜的表面得到了电子,电子是否是铜失去的?如何检验?请设计出你的实验方案。
方案1:称量实验前后铜片或锌片的质量。
方案2:观察溶液的颜色,看有无Cu2+生成
实验步骤
现象
结论或解释
锌溶解,铜表面有气泡,电流计指针偏转;
导线中有电流通过
化学能转化为电能。
A
Zn
Cu
稀H2SO4
思考:1.电子从Zn到H+经历了哪些途径?
2.你认为这个过程能量是如何转化的?
1、原电池:将化学能转变为电能的装置
一、化学能转化为电能
2.原电池的工作原理:
使氧化还原反应中的还原剂和氧化剂之间通过外电路间接地进行电子转移
负极
正极
Zn-2e-=Zn2+
2H+
+2e-=H2
还原剂(Zn)失去电子,发生氧化反应
氧化剂(H+)在铜极上得到电子,发生还原反应
还原剂失去的电子从锌极流出
流入铜极.
经外电路
Zn2+
H+
SO42-
电流方向
2.原电池的工作原理:
思考:原电池由几部分组成,它的构成条件是什么?
3.原电池的组成及构成条件:
(1)存在自发的氧化还原反应
(确定氧化剂与还原剂)
(2)两电极(一般是活泼性不同的导电材料)
电极
定义
反应类型
电极特点
负极
正极
电子流出的一极
电子流入的一极
发生氧化反应
发生还原反应
起导电作用,也可能作还原剂参加反应,一般是较活泼的电极
起导电作用,电极不参加反应,一般是较不活泼的电极
铜-锌-稀硫酸原电池
电极
电极材料
电极反应式
反应类型
电池总反应
氧化反应
Zn-2e-=
Zn2+
2H+
+
2e-=H2↑
Zn+2H+=Zn2++H2↑
还原反应
Zn片
Cu片
负极
正极
电极反应式
A
Zn
Cu
稀H2SO4
3.原电池的组成及构成条件:
(3)存在电解质溶液
(4)形成闭合回路
外电路:电子由负极→正极,
电流由正极→负极。
内电路:阴离子移向负极,
阳离子移向正极;
注意:电子不下水,离子不上岸。
小结:原电池的组成
五要素:
氧化剂、还原剂、负极、正极、电解质溶液
掌握:
两电极
两反应
两移动
1.下列哪些装置能产生电流,形成原电池?
(1)
稀H2SO4
Zn
Fe
A
(4)
A
CuSO4
溶液
Zn
Zn
(5)
A
CuSO4
溶液
Zn
Cu
(6)
稀H2SO4
Fe
C
A
(2)
酒精
Zn
Cu
A
(3)
Zn
Cu
稀H2SO4
稀H2SO4
A
√
√
√
×
×
×
2.写出装置B
、C
的电池总反应式和电极反应式
G
Zn
Cu
硫酸铜
G
Fe
C
稀硫酸
B
C
电池总反应:Zn+Cu2+=Zn2++Cu
负极(Zn)
Zn-2e-=Zn2+
正极(Cu)
Cu2++2e-=Cu
电池总反应:Fe+2H+=Fe2++H2↑
负极(Fe)
Fe-2e-=Fe2+
正极(C)
2H++2e-=H2↑
3.根据原电池的组成条件,将氧化还原反应:
Cu+2FeCl3=CuCl2+2FeCl2设计成一个原电池,画出装置图并写出电极反应式。
Cu
C
FeCl3溶液
4、 原电池原理的应用
(1).加快氧化还原反应速率
同一个氧化还原反应设计成原电池,会加快其反应速率。
应用:a.用粗锌和硫酸反应制H2,比用纯锌反应制H2的速率快;原因是粗锌中的杂质和锌、稀H2SO4形成原电池,加快了反应,使产生H2的速率加快。
b.往锌和硫酸反应的溶液中,滴入几滴CuSO4溶液,产生气泡速率会变快;原因是锌置换出铜,锌、铜、稀H2SO4形成原电池,加快了反应,使产生H2的速率加快。
(2)比较金属的活动性强弱
原电池中,一般活动性强的金属为负极
例.某金属能跟稀盐酸作用发出氢气,该金属与锌组成原电池时,锌为负极,此金属是(
)
A.Mg
B.Fe
C.Al
D.Cu
B
强化训练:
把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为(
)
A.a
>
b
>
c
>
d
B.a
>
c
>
d
>
b
C.c
>
a
>
b
.>
d
D.b
>
d
>
c
>
a
B
钢铁的电化学腐蚀
吸氧腐蚀:
负极:Fe—2e—=Fe2+
正极:2H2O+O2+4e—=4OH—
Fe2+
+2OH—
=Fe(OH)2
4Fe(OH)2+2H20+O2
=
4Fe(OH)3
2Fe(OH)3=Fe2O3+3H2O
(3)解释金属的腐蚀与防护:
原理:在潮湿空气中钢铁表面
形成无数微小的原电池。
负极(Fe):
正极(C):
Fe
-
2e?
=
Fe2+
析氢腐蚀
H2SO4
电解液酸性
钢铁的电化学腐蚀
2H+
+
2e-
=
H2↑
Fe
+2H+
=
Fe2+
+
H2↑
总反应:
轮船船体都是钢铁的,长期浸在水中,易被腐蚀,为了保护轮船船体,通常在轮船外壳镶嵌锌块,为什么?
电化学防护:
4.设计化学电源
从理论上说,所有自发的氧化还原反应都可设计成原电池。
