苏教版高中化学必修二 1.2微粒之间的相互作用力 (共36张PPT)
文档属性
| 名称 | 苏教版高中化学必修二 1.2微粒之间的相互作用力 (共36张PPT) |
|
|
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-05 00:00:00 | ||
图片预览








文档简介
(共36张PPT)
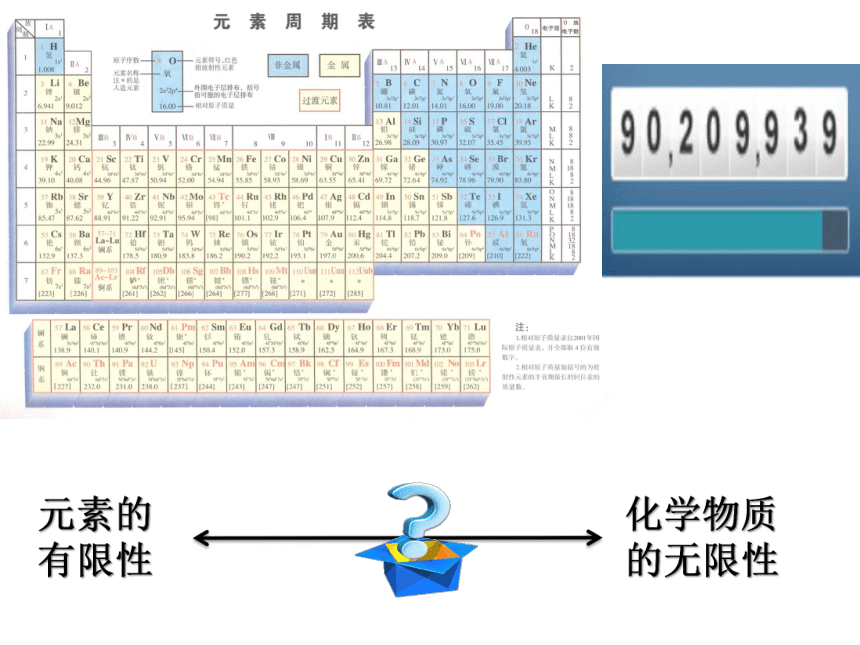
元素的有限性
化学物质
的无限性
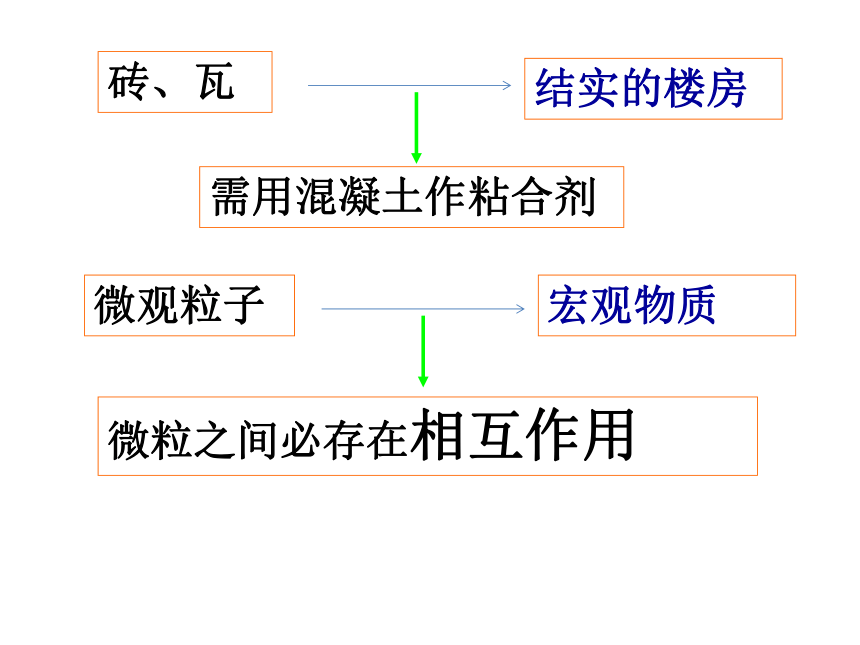
砖、瓦
需用混凝土作粘合剂
结实的楼房
微粒之间必存在相互作用
微观粒子
宏观物质
微粒之间的相互作用
1.定义
物质中直接相邻的原子或离子之间存在的强烈的相互作用叫做化学键
一、化学键
【思考】已知原子在化合成稳定物质时必须产生一种作用力将它们结合在一起,但并不是任意的元素均可化合生成稳定的物质,现有:Na、Mg、H、O、Cl,指出以上元素能形成的化合物?
Na2O、MgO、NaCl、MgCl2
H2O、HCl、Cl2O7
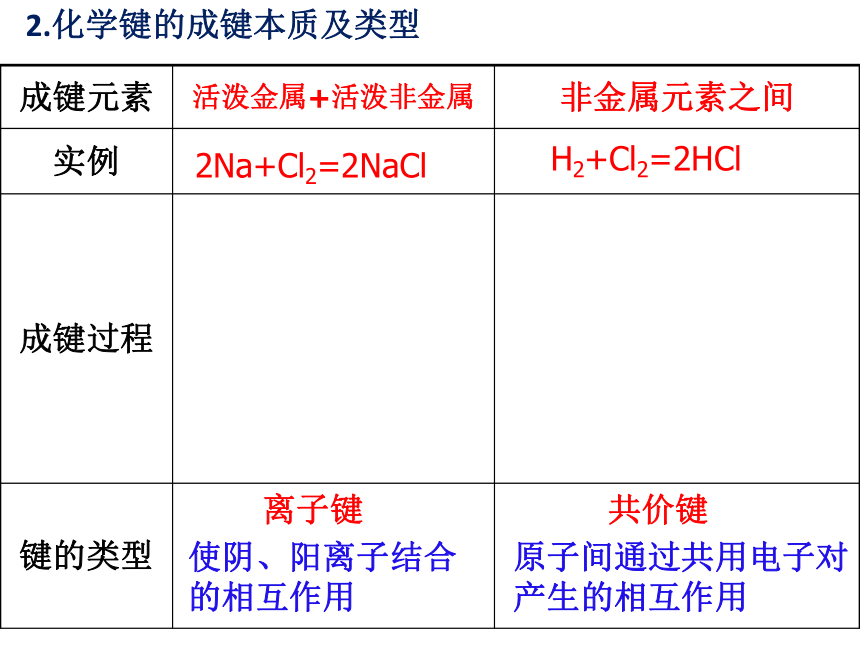
成键元素
活泼金属+活泼非金属
非金属元素之间
实例
成键过程
键的类型
2Na+Cl2=2NaCl
H2+Cl2=2HCl
2.化学键的成键本质及类型
离子键
使阴、阳离子结合的相互作用
共价键
原子间通过共用电子对产生的相互作用
离子键
共价键
成键微粒
成键本质
形成共用电子对
静电作用
阳离子
~
阴离子
原子
~原子
离子键和共价键的比较
(静电引力与斥力)
3.离子键与共价键的存在
(1)离子键
a.由ⅠA
,
ⅡA的金属与ⅥA
,
ⅦA的非金属形成的化合物
b.存在于所有的离子化合物
含有离子键的化合物
活泼金属氧化物、强碱、
绝大多数盐(注意铵盐也是)
存在离子键的化合物一般含有:
活泼金属或NH4+
3.离子键与共价键的存在
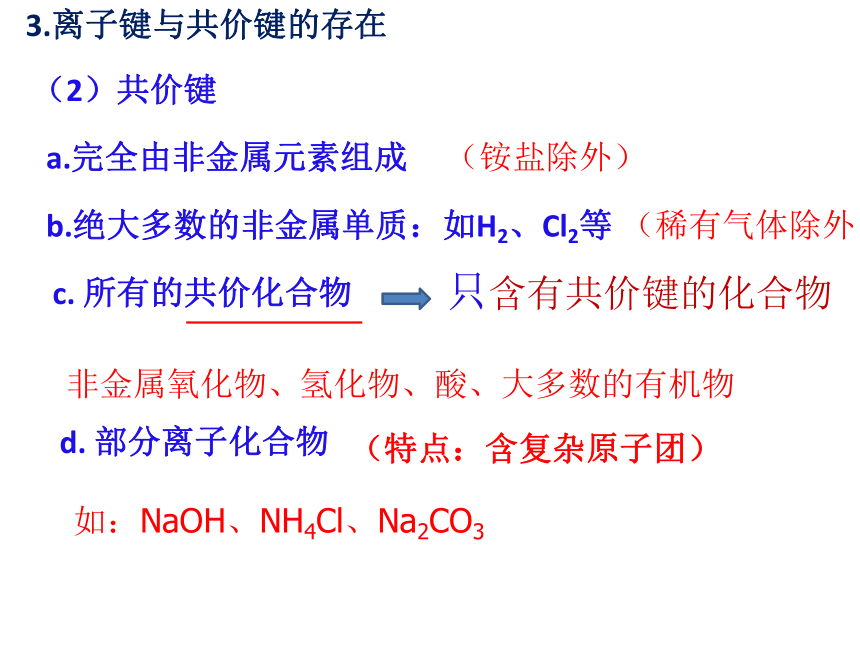
(2)共价键
a.完全由非金属元素组成
c.
所有的共价化合物
只含有共价键的化合物
非金属氧化物、氢化物、酸、大多数的有机物
(铵盐除外)
b.绝大多数的非金属单质:如H2、Cl2等
(稀有气体除外)
d.
部分离子化合物
如:NaOH、NH4Cl、Na2CO3
(特点:含复杂原子团)
(1)两个不同元素的原子间的共价键都是极性键A-B,如H-Cl。
(2)两个相同元素的原子间的共价键都是非极性键A-A,如H-H。
认识极性键和非极性键:
据共用电子对是否发生偏移,把共价键又分为极性共价键和非极性共价键。简称极性键和非极性键。
含有离子键的化合物一定是离子化合物
含有共价键的化合物一定是共价化合物
只含共价键的物质一定是共价化合物
离子化合物中一定含金属元素
错,可能是单质
错,如:NaOH
Na2SO4
错,如NH4Cl
1、判断:
练一练
对
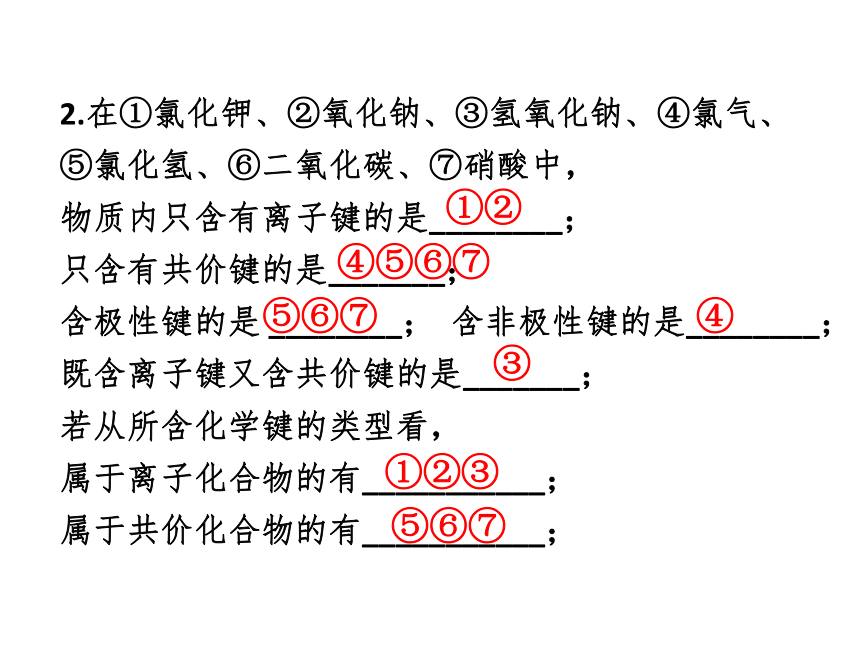
2.在①氯化钾、②氧化钠、③氢氧化钠、④氯气、
⑤氯化氢、⑥二氧化碳、⑦硝酸中,
物质内只含有离子键的是________;
只含有共价键的是_______;
含极性键的是
________;
含非极性键的是________;
既含离子键又含共价键的是_______;
若从所含化学键的类型看,
属于离子化合物的有___________;
属于共价化合物的有___________;
①②
④⑤⑥⑦
③
①②③
⑤⑥⑦
⑤⑥⑦
④
⑴、原子的电子式:
H
O
Cl
Mg
Na
概念:在元素符号周围用小黑点“.”或小叉
“×”来表示粒子的最外层电子的式子。
4.电子式
Cl
O
2-
①阳离子的电子式
⑵、离子的电子式:
②阴离子的电子式
即离子符号
要注明最外层电子数及电荷数并加中括号
S
2-
Na+、Mg2+
⑶、离子化合物的电子式:
注意:相同的离子不能合并写(每个离子都要单独写),一般对称排列.
如:
Mg
2
Cl
2
×
Na2
×
O
2-
NaCl
Na2O
MgCl2
(4)、共价分子的电子式:
H2
N2
HCl
H2O
NH3
CO2
在共价分子中,用一条短线“—”表示一对共用电子对,其余电子省略的式子叫做结构式。
共价分子除了可用电子式,还可用结构式表式。
请用电子式和结构式表示出下列共价分子:
HClO
H2O2
NaOH
NH4Cl
(5)、含共价键的离子化合物的电子式:
Na2O2
判断下列电子式的书写是否正确,若不正确请改正。
N
N
H
Cl
[
Cl
]-
[
Cl
]-
Mg2+
氮气:
N
N
氯化氢:
H+[
Cl
]-
氯化镁:
[
Cl
]-
[
Cl
]-
Mg2+
二氧化碳:
C
O
O
Cl
氯化钾:K
K+[
Cl
]-
O
C
O
×
×
×
×
×
下一页
小结:书写电子式须注意
a.先判断物质的类型:离子化合物,还是共价分子。
b.离子化合物要注意离子的书写及位置
c.共价化合物须先判断形成原子所具有的未成对电子数,将未成对电子数最多的原子置于分子中间,其余原子围绕其成键。
思考:
如何通过实验判断化合物是离子化合物还是共价化合物?
离子化合物在熔融状态下能导电;
共价化合物在熔融状态下不导电。
思考:
离子化合物、共价化合物中元素的化合价由何决定?
离子化合物:由得失电子数决定;
共价化合物:由共用电子对偏移的方向和数目决定的。
思考:
下列各分子中,所有原子都满足最外层为8电子结构的是 。
①CO2
②BF3
③PCl3
④PCl5
⑤NH3
⑥OF2
⑦SCl6
①
③
⑥
用电子式写出下列物质的形成过程
强化训练:
CaO
K2S
CaBr2
示例:NaCl
MgCl2
用电子式写出下列物质的形成过程,并标出分子的结构式。
强化训练:
SiH4
NCl3
CS2
示例:H2S
CO2
综合练习:
写出下列物质的电子式,若为共价分子,写出结构式。
NaOH
Na2O2
H2O2
KClO
HCN
COCl2
Ca(OH)2
共价分子中各原子按共价键连接,分子有一定的空间结构,可以用球棍模型、比例模型表示共价分子的空间结构。
碳原子的成键方式:碳的最外层有4个电子,在化学反应中,碳既不容易得到电子,也不容易失去电子,与其它原子以共价键结合。
碳原子间连接方式的多样性,是有机化合物的种类繁多的原因之一。
思考:
相邻的原子或离子之间强烈的相互作用--化学键。
将NaCl晶体加热到801
℃,才能产生自由移动的Na+和Cl-。
要使水分解成氢气和氧气,需加热至2000℃.
吸收能量用来克服离子键
吸收能量用来克服共价键
将水加热至100℃时会气化,这一过程是否破
坏了化学键?
水分子之间存在分子间的作用力
二、分子间作用力
(1)存在:由分子形成的固体、液体
1.定义:分子间存在的将分子聚集在一起的作用力称为分子间作用力,又称为范德华力。
(2)不是化学键,比化学键弱
(3)主要影响物质的物理性质(熔沸点)
2.特点:
范德华力越大,对应物质的熔沸点越高,硬度
越大。
作用微粒
作用力强弱
大小范围
化学键
范德华力
原子、离子之间
分子之间
微弱作用
分子间作用力与化学键的比较
强烈作用
125--836KJ/mol
2--20KJ/mol
F2
Cl2
Br2
I2
F2
Cl2
Br2
I2
沸点
熔点
相对分子质量
0
-50
-100
-150
-200
-250
50
100
150
200
250
50
100
150
200
250
温度/℃
卤素单质的熔、沸点与
相对分子质量的关系
0
-50
-100
-150
-200
-250
50
100
150
200
250
100
300
200
400
温度/℃
相对分子质量
×
×
×
500
×
×
×
×
CF4
CCl4
CBr4
CF4
CCl4
CBr4
CI4
沸点
熔点
四卤化碳的熔沸点与
相对分子质量的关系
分子间的作用力强弱(范德华力)
结论:组成和结构相似的物质,相对分子质量越大,分子间作用力越大、熔沸点越高。
2、下列物质变化时,需克服的作用力类型。
A.离子键 B.共价键 C.分子间的作用力
(1)
烧碱熔化
(2)
NaCl溶于水
(3)
HCl溶于水
(4)液氨气化
(5)氨气分解为氮气与氢气
练习
1、比较下列物质的沸点高低
HCl
HBr
HI
-150
-125
-100
-75
-50
-25
0
25
50
75
100
2
3
4
5
×
×
×
×
CH4
SiH4
GeH4
SnH4
NH3
PH3
AsH3
SbH3
HF
HCl
HBr
HI
H2O
H2S
H2Se
H2Te
沸点/℃
周期
一些氢化物的沸点
CH4
SiH4
GeH4
SnH4
NH3
PH3
AsH3
SbH3
H2O
H2S
H2Se
H2Te
HF
HCl
HBr
HI
沸点如何变化?
反常:H2O、HF、NH3的沸点在同族元素的氢化物中最高,这是为什么?
(1)定义:由与N、O、F相连的氢与N、O、F中的孤电子对形成的一种特殊的分子间的作用力。
(2)存在于分子之间,不是化学键
(3)氢键的表示方法:X—H…Y
X、Y为N、O、F中的一种,可以相同,也可以不同
3.氢键:
氢键对物质性质的影响
⑴氢键的存在使物质的熔沸点相对较高(如HF、H2O)。
(3)解释一些反常现象:如水结成冰时,为什么体积会膨胀。
(2)氢键的形成使某些物质在水中的溶解度增大(如NH3溶于水)
元素的有限性
化学物质
的无限性
砖、瓦
需用混凝土作粘合剂
结实的楼房
微粒之间必存在相互作用
微观粒子
宏观物质
微粒之间的相互作用
1.定义
物质中直接相邻的原子或离子之间存在的强烈的相互作用叫做化学键
一、化学键
【思考】已知原子在化合成稳定物质时必须产生一种作用力将它们结合在一起,但并不是任意的元素均可化合生成稳定的物质,现有:Na、Mg、H、O、Cl,指出以上元素能形成的化合物?
Na2O、MgO、NaCl、MgCl2
H2O、HCl、Cl2O7
成键元素
活泼金属+活泼非金属
非金属元素之间
实例
成键过程
键的类型
2Na+Cl2=2NaCl
H2+Cl2=2HCl
2.化学键的成键本质及类型
离子键
使阴、阳离子结合的相互作用
共价键
原子间通过共用电子对产生的相互作用
离子键
共价键
成键微粒
成键本质
形成共用电子对
静电作用
阳离子
~
阴离子
原子
~原子
离子键和共价键的比较
(静电引力与斥力)
3.离子键与共价键的存在
(1)离子键
a.由ⅠA
,
ⅡA的金属与ⅥA
,
ⅦA的非金属形成的化合物
b.存在于所有的离子化合物
含有离子键的化合物
活泼金属氧化物、强碱、
绝大多数盐(注意铵盐也是)
存在离子键的化合物一般含有:
活泼金属或NH4+
3.离子键与共价键的存在
(2)共价键
a.完全由非金属元素组成
c.
所有的共价化合物
只含有共价键的化合物
非金属氧化物、氢化物、酸、大多数的有机物
(铵盐除外)
b.绝大多数的非金属单质:如H2、Cl2等
(稀有气体除外)
d.
部分离子化合物
如:NaOH、NH4Cl、Na2CO3
(特点:含复杂原子团)
(1)两个不同元素的原子间的共价键都是极性键A-B,如H-Cl。
(2)两个相同元素的原子间的共价键都是非极性键A-A,如H-H。
认识极性键和非极性键:
据共用电子对是否发生偏移,把共价键又分为极性共价键和非极性共价键。简称极性键和非极性键。
含有离子键的化合物一定是离子化合物
含有共价键的化合物一定是共价化合物
只含共价键的物质一定是共价化合物
离子化合物中一定含金属元素
错,可能是单质
错,如:NaOH
Na2SO4
错,如NH4Cl
1、判断:
练一练
对
2.在①氯化钾、②氧化钠、③氢氧化钠、④氯气、
⑤氯化氢、⑥二氧化碳、⑦硝酸中,
物质内只含有离子键的是________;
只含有共价键的是_______;
含极性键的是
________;
含非极性键的是________;
既含离子键又含共价键的是_______;
若从所含化学键的类型看,
属于离子化合物的有___________;
属于共价化合物的有___________;
①②
④⑤⑥⑦
③
①②③
⑤⑥⑦
⑤⑥⑦
④
⑴、原子的电子式:
H
O
Cl
Mg
Na
概念:在元素符号周围用小黑点“.”或小叉
“×”来表示粒子的最外层电子的式子。
4.电子式
Cl
O
2-
①阳离子的电子式
⑵、离子的电子式:
②阴离子的电子式
即离子符号
要注明最外层电子数及电荷数并加中括号
S
2-
Na+、Mg2+
⑶、离子化合物的电子式:
注意:相同的离子不能合并写(每个离子都要单独写),一般对称排列.
如:
Mg
2
Cl
2
×
Na2
×
O
2-
NaCl
Na2O
MgCl2
(4)、共价分子的电子式:
H2
N2
HCl
H2O
NH3
CO2
在共价分子中,用一条短线“—”表示一对共用电子对,其余电子省略的式子叫做结构式。
共价分子除了可用电子式,还可用结构式表式。
请用电子式和结构式表示出下列共价分子:
HClO
H2O2
NaOH
NH4Cl
(5)、含共价键的离子化合物的电子式:
Na2O2
判断下列电子式的书写是否正确,若不正确请改正。
N
N
H
Cl
[
Cl
]-
[
Cl
]-
Mg2+
氮气:
N
N
氯化氢:
H+[
Cl
]-
氯化镁:
[
Cl
]-
[
Cl
]-
Mg2+
二氧化碳:
C
O
O
Cl
氯化钾:K
K+[
Cl
]-
O
C
O
×
×
×
×
×
下一页
小结:书写电子式须注意
a.先判断物质的类型:离子化合物,还是共价分子。
b.离子化合物要注意离子的书写及位置
c.共价化合物须先判断形成原子所具有的未成对电子数,将未成对电子数最多的原子置于分子中间,其余原子围绕其成键。
思考:
如何通过实验判断化合物是离子化合物还是共价化合物?
离子化合物在熔融状态下能导电;
共价化合物在熔融状态下不导电。
思考:
离子化合物、共价化合物中元素的化合价由何决定?
离子化合物:由得失电子数决定;
共价化合物:由共用电子对偏移的方向和数目决定的。
思考:
下列各分子中,所有原子都满足最外层为8电子结构的是 。
①CO2
②BF3
③PCl3
④PCl5
⑤NH3
⑥OF2
⑦SCl6
①
③
⑥
用电子式写出下列物质的形成过程
强化训练:
CaO
K2S
CaBr2
示例:NaCl
MgCl2
用电子式写出下列物质的形成过程,并标出分子的结构式。
强化训练:
SiH4
NCl3
CS2
示例:H2S
CO2
综合练习:
写出下列物质的电子式,若为共价分子,写出结构式。
NaOH
Na2O2
H2O2
KClO
HCN
COCl2
Ca(OH)2
共价分子中各原子按共价键连接,分子有一定的空间结构,可以用球棍模型、比例模型表示共价分子的空间结构。
碳原子的成键方式:碳的最外层有4个电子,在化学反应中,碳既不容易得到电子,也不容易失去电子,与其它原子以共价键结合。
碳原子间连接方式的多样性,是有机化合物的种类繁多的原因之一。
思考:
相邻的原子或离子之间强烈的相互作用--化学键。
将NaCl晶体加热到801
℃,才能产生自由移动的Na+和Cl-。
要使水分解成氢气和氧气,需加热至2000℃.
吸收能量用来克服离子键
吸收能量用来克服共价键
将水加热至100℃时会气化,这一过程是否破
坏了化学键?
水分子之间存在分子间的作用力
二、分子间作用力
(1)存在:由分子形成的固体、液体
1.定义:分子间存在的将分子聚集在一起的作用力称为分子间作用力,又称为范德华力。
(2)不是化学键,比化学键弱
(3)主要影响物质的物理性质(熔沸点)
2.特点:
范德华力越大,对应物质的熔沸点越高,硬度
越大。
作用微粒
作用力强弱
大小范围
化学键
范德华力
原子、离子之间
分子之间
微弱作用
分子间作用力与化学键的比较
强烈作用
125--836KJ/mol
2--20KJ/mol
F2
Cl2
Br2
I2
F2
Cl2
Br2
I2
沸点
熔点
相对分子质量
0
-50
-100
-150
-200
-250
50
100
150
200
250
50
100
150
200
250
温度/℃
卤素单质的熔、沸点与
相对分子质量的关系
0
-50
-100
-150
-200
-250
50
100
150
200
250
100
300
200
400
温度/℃
相对分子质量
×
×
×
500
×
×
×
×
CF4
CCl4
CBr4
CF4
CCl4
CBr4
CI4
沸点
熔点
四卤化碳的熔沸点与
相对分子质量的关系
分子间的作用力强弱(范德华力)
结论:组成和结构相似的物质,相对分子质量越大,分子间作用力越大、熔沸点越高。
2、下列物质变化时,需克服的作用力类型。
A.离子键 B.共价键 C.分子间的作用力
(1)
烧碱熔化
(2)
NaCl溶于水
(3)
HCl溶于水
(4)液氨气化
(5)氨气分解为氮气与氢气
练习
1、比较下列物质的沸点高低
HCl
HBr
HI
-150
-125
-100
-75
-50
-25
0
25
50
75
100
2
3
4
5
×
×
×
×
CH4
SiH4
GeH4
SnH4
NH3
PH3
AsH3
SbH3
HF
HCl
HBr
HI
H2O
H2S
H2Se
H2Te
沸点/℃
周期
一些氢化物的沸点
CH4
SiH4
GeH4
SnH4
NH3
PH3
AsH3
SbH3
H2O
H2S
H2Se
H2Te
HF
HCl
HBr
HI
沸点如何变化?
反常:H2O、HF、NH3的沸点在同族元素的氢化物中最高,这是为什么?
(1)定义:由与N、O、F相连的氢与N、O、F中的孤电子对形成的一种特殊的分子间的作用力。
(2)存在于分子之间,不是化学键
(3)氢键的表示方法:X—H…Y
X、Y为N、O、F中的一种,可以相同,也可以不同
3.氢键:
氢键对物质性质的影响
⑴氢键的存在使物质的熔沸点相对较高(如HF、H2O)。
(3)解释一些反常现象:如水结成冰时,为什么体积会膨胀。
(2)氢键的形成使某些物质在水中的溶解度增大(如NH3溶于水)
