人教版高中化学必修二2.1化学能与热能(37张PPT)
文档属性
| 名称 | 人教版高中化学必修二2.1化学能与热能(37张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-05 10:48:44 | ||
图片预览











文档简介
(共37张PPT)
燧人氏钻木取火
一飞冲天:“神舟”五号发射实况回放
反应中的能量变化
白磷的燃烧
氨的燃烧
科学探测表明:全世界的石油大概在2060年左右耗尽,天然气2060年用光,煤炭虽是最“丰富”的能源,但最多还能维持200年……新安晚报3月30日报道:截止2006年底,我国石油剩余经济可开采储量为20.43亿吨.天然气剩余经济可开采储量为24490亿立方米.目前,石油储量可采11年.
随堂练习
1,下列变化中,一定不存在化学能与热能的相互转化的是()
A木柴燃烧
B白磷燃烧
C燃放爆竹
D干冰升华
思考与讨论
化学反应伴随着能量变化,有的反应放出热量,有的反应却需要不断的加热,吸收热量反应才能进行。
这些能量又是如何变化的呢?能量从哪来又到哪里去了呢?
①反应物的总能量大于生成物的总能量,反应
一.宏观:化学反应中能量变化的原因
——反应物和生成物的总能量相对大小
瀑布
讨论:水往低处流的过程中,能量发生了什么变化
放出能量.
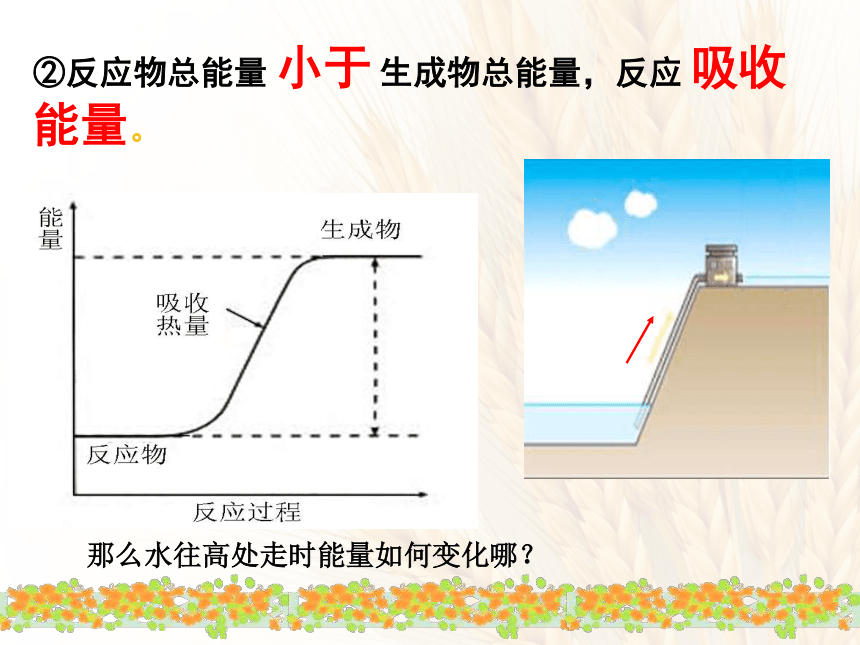
②反应物总能量
小于
生成物总能量,反应
吸收能量。
那么水往高处走时能量如何变化哪?
小结1
①反应物的总能量
大于
生成物的总能量,反应放出能量。
②反应物的总能量
小于
生成物的总能量,反应吸收能量。
化学反应中的能量变化遵循能量守恒定律。
一、宏观:化学反应中能量变化的原因
——反应物和生成物的总能量相对大小
1.化学反应的实质是什么?
讨论
2.微观:化学反应中能量变化的原因
2.化学键的形成与断裂与能量有什么关系?
H2
+
Cl2
=
2HCl
H—H
Cl
—Cl
H—Cl
断开
断开
点燃
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
形成
二、微观:化学键与化学反应中能量变化的关系
1、化学反应本质
化学键的形成与断裂与能量有什么关系?
H2
+
Cl2
=
2HCl
H—H
Cl
—Cl
H—Cl
断开
断开
点燃
形成
二、化学键与化学反应中能量变化的关系
2、化学反应中能量变化的主要原因
吸收能量
吸收能量
放出能量
2.
从化学键的观点来分析能量的变化
所以:一个化学反应是否为放热还是吸热取决于什么呢?
取决于所有断键吸收的总能量与所有
形成新键放出的总能量的相对大小
1moL
H-H
键断裂所需能量
436kJ
1moL
Cl-Cl
键断裂所需能量
243kJ
1mol
H-Cl
键形成放出能量
431kJ
反应物吸收总能量
436kJ
+
243kJ
=
679kJ
生成物释放总能量
431kJ
×
2
=
862kJ
吸收能量
<
放出能量
反应放热
吸收能量
>
放出能量
反应吸热
是放热反应
是吸收热量还是放出热量哪?
?H1
?H2
?H1键断裂吸收的能量
t
?H2键生成释放的能量
若?H2
-
?H1﹥0反应放热
能
量
H2
+
Cl2
==
2HCl
3、反应中能量变化示意图
H-H
CL-CL
2H
2CL
2HCL
t
若?H2
-
?H1﹤0反应吸热
?H2
?H1键断裂吸收的能量
?H2键生成释放的能量
?H1
能
量
t
3、反应中能量变化示意图
练习(资料26页过关题组1.2)
则反应:N2+3H2===2NH3的能量变化
即该过程放出
热量。
96
kJ
化学键变化
能量变化
拆开1
mol
N≡N
吸收942
kJ
拆开1
mol
H—H
吸收436
kJ
形成1
mol
N—H
放出391
kJ
H-H=
H+H
吸收
436kJ/mol
H-F=
H+
F
吸收
565kJ/mol
在25℃和101kPa的条件
H+H
=
H-H
放出
436kJ/mol
H+F
=
H-F
放出
565kJ/mol
说明:化学键断裂吸收的能量等于化学键形成放出的能量
2.微观:化学反应中能量变化的原因
——化学键的断裂和形成
①断开化学键吸收的总能量小于形成化学键释放出的总能量,反应放出能量。
②断开化学键吸收的总能量大于形成化学键释放出的总能量,反应吸收能量。
小结2
常见放热反应和吸热反应
?1)物质的燃烧:C
+
O2
=
CO2
?2)常见金属(Al、Fe、Zn等)与酸或水(HCl、H2SO4等)的反应
?3)酸碱中和反应:
HCl
+
NaOH
=
NaCl
+
H2O
?
4)大多数化合反应
:2H2+O2=2H2O
点燃
1、放热反应:——有热量放出的化学反应
?
1)大多数分解反应:CaCO3
=
CaO
+CO2↑
?
2)铵盐与强碱的反应:
Ba(OH)2·8H2O+2NH4Cl
=BaCl2+2NH3↑+10H2O
?
3)碳与CO2气体的反应:
C
+
CO2
=
2CO
?
4)氢气还原氧化铜
H2
+
CuO
=
H2O
+
Cu
吸热反应:
——有热量吸收的化学反应
强调:
1、吸热反应还是放热反应与是否有加热条件无关
需要持续加热才进行的反应为吸热反应,
不需加热或加热停止后仍能进行的反应为放热反应。
2、中和热:酸和碱发生中和反应生成1molH2O所放出的热量叫中和热。
H-
+
OH+
=
H2O
如何区分吸热反应和放热反应?
1.根据反应物和生成物的总能量大小判断:
Q反>Q生,放热反应
2.根据化学键断裂和形成时能量大小关系判断:
Q吸>Q放,吸热反应
3.根据常见反应类型判断:
4.根据生成物和反应物的相对稳定性判断:稳定物生成不稳定物是吸热反应
5.根据反应条件(加热)判断:
二、化学能与热能的相互转化
1、两条基本的自然定律
(1)质量守恒定律:
(2)能量守恒定律:一种能量可以转化为另一种能量,
总能量保持不变。
2、吸热反应和放热反应
——化学上把有热量放出的化学反应
——化学上把吸收热量的化学反应
(1)放热反应
(2)吸热反应
——化学能转化成了热能
——热能转化成化学能
实验2-1
向一支试管中加入
2~3mL
6mol/L
的盐酸,
插入用砂纸打磨光的铝条,观察现象,
并用温度计测量溶液温度的变化
管壁较凉
铝片表面
出现气泡
管壁稍许发热
铝与盐酸反应放出热量,使环境温度升高
1.
大多数置换反应是放热反应?????
;
2.?化学能能转化为热能释放出来。
温度计的液柱??
,由??
℃到????
结论:
实验2-2
在
50mL烧杯中加入
20mL
2mol/L
的盐酸,测其温度,
另用量筒量取
20mL
2mol/L
的NaOH溶液,测其温度。
并缓缓倾入烧杯中,边加边用玻璃棒搅拌,
观察反应中溶液温度的变化过程,并做好记录。
中和反应放出热量,使环境温度升高
20oC
28oC
20oC
20oC
20oC
20oC
20oC
29oC
24oC
结论:
盐酸温度
NaOH温度
反应后温度
第一组实验
第二组实验
第三组实验
【实验2-2】改为下列两组对比实验。
反应物
及用量
HNO3
2
mL
1
mol/L
NaOH
2
mL
1
mol/L
HCl
2
mL
1
mol/L
NaOH
2
mL
1
mol/L
混合前温度
室温20。c
室温20。c
混合后温度
t1=280C
t2
=280C
结?
论
HNO3与NaOH发生
中和反应时放热
HCl与NaOH发生
中和反应时放热
对实验进行
归纳和概括
强酸与强碱发生中和反应时放出热量
酸
碱
实验2-3
将约
20g
Ba(OH)2?8H2O
晶体研细后与10g
NH4Cl
晶体
在烧杯中混合,并将烧杯放在滴有几滴水的塑料片上,
立即用玻璃棒快速搅拌混合物,闻气味,
用手触摸杯壁下部,试着用手拿起烧杯,观察现象
有刺激性气味气体逸出
可使湿润紫色石蕊试纸变蓝
杯壁冰凉
塑料片不掉落
有NH3放出
反应吸收热量,
使环境温度降低
水能变成冰
思考:得到结论是什么?反应方程式如何写?
实验步骤
实验现象
得出结论
将晶体迅速混合后搅拌
用手触摸
烧杯壁下部
提起烧杯及
底部塑料片
巩固练习:
1.
下列物质加入水中显著放热的是:
A.浓H2SO4
B.酒精
C.固体NaCl
D.固体NaOH
2.
下列反应中既属于氧化还原反应同时又是吸热反应的是:
A.Ba(OH)2
·
8H2O与NH4Cl反应
B.镁与稀盐酸
C.灼热的炭与CO2
D.甲烷与O2反应
3.已知反应A+B=C+D为放热反应,对该反应
的下列说法中正确的是(
)
A.
A的能量一定高于C
B.
B的能量一定高于D
C.
A和B的总能量一定高于C和D的总能量
D.
该反应为放热反应,故不必加热就一定
能发生
C
巩固练习:
4.
下列反应属于放热反应的是:
A.
NaOH与HCl反应
B.
C和CO2共热
C.
碳酸钙的分解
D.
制备水煤气的反应
5、下列说法中正确的是
(
)
A、物质发生化学反应都伴随着能量的变化
B、伴有能量变化的物质变化都是化学变化
C、在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同
D、在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量
AC
谢谢大家!
燧人氏钻木取火
一飞冲天:“神舟”五号发射实况回放
反应中的能量变化
白磷的燃烧
氨的燃烧
科学探测表明:全世界的石油大概在2060年左右耗尽,天然气2060年用光,煤炭虽是最“丰富”的能源,但最多还能维持200年……新安晚报3月30日报道:截止2006年底,我国石油剩余经济可开采储量为20.43亿吨.天然气剩余经济可开采储量为24490亿立方米.目前,石油储量可采11年.
随堂练习
1,下列变化中,一定不存在化学能与热能的相互转化的是()
A木柴燃烧
B白磷燃烧
C燃放爆竹
D干冰升华
思考与讨论
化学反应伴随着能量变化,有的反应放出热量,有的反应却需要不断的加热,吸收热量反应才能进行。
这些能量又是如何变化的呢?能量从哪来又到哪里去了呢?
①反应物的总能量大于生成物的总能量,反应
一.宏观:化学反应中能量变化的原因
——反应物和生成物的总能量相对大小
瀑布
讨论:水往低处流的过程中,能量发生了什么变化
放出能量.
②反应物总能量
小于
生成物总能量,反应
吸收能量。
那么水往高处走时能量如何变化哪?
小结1
①反应物的总能量
大于
生成物的总能量,反应放出能量。
②反应物的总能量
小于
生成物的总能量,反应吸收能量。
化学反应中的能量变化遵循能量守恒定律。
一、宏观:化学反应中能量变化的原因
——反应物和生成物的总能量相对大小
1.化学反应的实质是什么?
讨论
2.微观:化学反应中能量变化的原因
2.化学键的形成与断裂与能量有什么关系?
H2
+
Cl2
=
2HCl
H—H
Cl
—Cl
H—Cl
断开
断开
点燃
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
形成
二、微观:化学键与化学反应中能量变化的关系
1、化学反应本质
化学键的形成与断裂与能量有什么关系?
H2
+
Cl2
=
2HCl
H—H
Cl
—Cl
H—Cl
断开
断开
点燃
形成
二、化学键与化学反应中能量变化的关系
2、化学反应中能量变化的主要原因
吸收能量
吸收能量
放出能量
2.
从化学键的观点来分析能量的变化
所以:一个化学反应是否为放热还是吸热取决于什么呢?
取决于所有断键吸收的总能量与所有
形成新键放出的总能量的相对大小
1moL
H-H
键断裂所需能量
436kJ
1moL
Cl-Cl
键断裂所需能量
243kJ
1mol
H-Cl
键形成放出能量
431kJ
反应物吸收总能量
436kJ
+
243kJ
=
679kJ
生成物释放总能量
431kJ
×
2
=
862kJ
吸收能量
<
放出能量
反应放热
吸收能量
>
放出能量
反应吸热
是放热反应
是吸收热量还是放出热量哪?
?H1
?H2
?H1键断裂吸收的能量
t
?H2键生成释放的能量
若?H2
-
?H1﹥0反应放热
能
量
H2
+
Cl2
==
2HCl
3、反应中能量变化示意图
H-H
CL-CL
2H
2CL
2HCL
t
若?H2
-
?H1﹤0反应吸热
?H2
?H1键断裂吸收的能量
?H2键生成释放的能量
?H1
能
量
t
3、反应中能量变化示意图
练习(资料26页过关题组1.2)
则反应:N2+3H2===2NH3的能量变化
即该过程放出
热量。
96
kJ
化学键变化
能量变化
拆开1
mol
N≡N
吸收942
kJ
拆开1
mol
H—H
吸收436
kJ
形成1
mol
N—H
放出391
kJ
H-H=
H+H
吸收
436kJ/mol
H-F=
H+
F
吸收
565kJ/mol
在25℃和101kPa的条件
H+H
=
H-H
放出
436kJ/mol
H+F
=
H-F
放出
565kJ/mol
说明:化学键断裂吸收的能量等于化学键形成放出的能量
2.微观:化学反应中能量变化的原因
——化学键的断裂和形成
①断开化学键吸收的总能量小于形成化学键释放出的总能量,反应放出能量。
②断开化学键吸收的总能量大于形成化学键释放出的总能量,反应吸收能量。
小结2
常见放热反应和吸热反应
?1)物质的燃烧:C
+
O2
=
CO2
?2)常见金属(Al、Fe、Zn等)与酸或水(HCl、H2SO4等)的反应
?3)酸碱中和反应:
HCl
+
NaOH
=
NaCl
+
H2O
?
4)大多数化合反应
:2H2+O2=2H2O
点燃
1、放热反应:——有热量放出的化学反应
?
1)大多数分解反应:CaCO3
=
CaO
+CO2↑
?
2)铵盐与强碱的反应:
Ba(OH)2·8H2O+2NH4Cl
=BaCl2+2NH3↑+10H2O
?
3)碳与CO2气体的反应:
C
+
CO2
=
2CO
?
4)氢气还原氧化铜
H2
+
CuO
=
H2O
+
Cu
吸热反应:
——有热量吸收的化学反应
强调:
1、吸热反应还是放热反应与是否有加热条件无关
需要持续加热才进行的反应为吸热反应,
不需加热或加热停止后仍能进行的反应为放热反应。
2、中和热:酸和碱发生中和反应生成1molH2O所放出的热量叫中和热。
H-
+
OH+
=
H2O
如何区分吸热反应和放热反应?
1.根据反应物和生成物的总能量大小判断:
Q反>Q生,放热反应
2.根据化学键断裂和形成时能量大小关系判断:
Q吸>Q放,吸热反应
3.根据常见反应类型判断:
4.根据生成物和反应物的相对稳定性判断:稳定物生成不稳定物是吸热反应
5.根据反应条件(加热)判断:
二、化学能与热能的相互转化
1、两条基本的自然定律
(1)质量守恒定律:
(2)能量守恒定律:一种能量可以转化为另一种能量,
总能量保持不变。
2、吸热反应和放热反应
——化学上把有热量放出的化学反应
——化学上把吸收热量的化学反应
(1)放热反应
(2)吸热反应
——化学能转化成了热能
——热能转化成化学能
实验2-1
向一支试管中加入
2~3mL
6mol/L
的盐酸,
插入用砂纸打磨光的铝条,观察现象,
并用温度计测量溶液温度的变化
管壁较凉
铝片表面
出现气泡
管壁稍许发热
铝与盐酸反应放出热量,使环境温度升高
1.
大多数置换反应是放热反应?????
;
2.?化学能能转化为热能释放出来。
温度计的液柱??
,由??
℃到????
结论:
实验2-2
在
50mL烧杯中加入
20mL
2mol/L
的盐酸,测其温度,
另用量筒量取
20mL
2mol/L
的NaOH溶液,测其温度。
并缓缓倾入烧杯中,边加边用玻璃棒搅拌,
观察反应中溶液温度的变化过程,并做好记录。
中和反应放出热量,使环境温度升高
20oC
28oC
20oC
20oC
20oC
20oC
20oC
29oC
24oC
结论:
盐酸温度
NaOH温度
反应后温度
第一组实验
第二组实验
第三组实验
【实验2-2】改为下列两组对比实验。
反应物
及用量
HNO3
2
mL
1
mol/L
NaOH
2
mL
1
mol/L
HCl
2
mL
1
mol/L
NaOH
2
mL
1
mol/L
混合前温度
室温20。c
室温20。c
混合后温度
t1=280C
t2
=280C
结?
论
HNO3与NaOH发生
中和反应时放热
HCl与NaOH发生
中和反应时放热
对实验进行
归纳和概括
强酸与强碱发生中和反应时放出热量
酸
碱
实验2-3
将约
20g
Ba(OH)2?8H2O
晶体研细后与10g
NH4Cl
晶体
在烧杯中混合,并将烧杯放在滴有几滴水的塑料片上,
立即用玻璃棒快速搅拌混合物,闻气味,
用手触摸杯壁下部,试着用手拿起烧杯,观察现象
有刺激性气味气体逸出
可使湿润紫色石蕊试纸变蓝
杯壁冰凉
塑料片不掉落
有NH3放出
反应吸收热量,
使环境温度降低
水能变成冰
思考:得到结论是什么?反应方程式如何写?
实验步骤
实验现象
得出结论
将晶体迅速混合后搅拌
用手触摸
烧杯壁下部
提起烧杯及
底部塑料片
巩固练习:
1.
下列物质加入水中显著放热的是:
A.浓H2SO4
B.酒精
C.固体NaCl
D.固体NaOH
2.
下列反应中既属于氧化还原反应同时又是吸热反应的是:
A.Ba(OH)2
·
8H2O与NH4Cl反应
B.镁与稀盐酸
C.灼热的炭与CO2
D.甲烷与O2反应
3.已知反应A+B=C+D为放热反应,对该反应
的下列说法中正确的是(
)
A.
A的能量一定高于C
B.
B的能量一定高于D
C.
A和B的总能量一定高于C和D的总能量
D.
该反应为放热反应,故不必加热就一定
能发生
C
巩固练习:
4.
下列反应属于放热反应的是:
A.
NaOH与HCl反应
B.
C和CO2共热
C.
碳酸钙的分解
D.
制备水煤气的反应
5、下列说法中正确的是
(
)
A、物质发生化学反应都伴随着能量的变化
B、伴有能量变化的物质变化都是化学变化
C、在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同
D、在一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量
AC
谢谢大家!
