山东省东平县实验中学2019-2020学年第二学期八年级化学3.1.1原子的构成(26张ppt)
文档属性
| 名称 | 山东省东平县实验中学2019-2020学年第二学期八年级化学3.1.1原子的构成(26张ppt) |
|
|
| 格式 | zip | ||
| 文件大小 | 833.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-05 00:00:00 | ||
图片预览





文档简介
(共26张PPT)
知识回顾
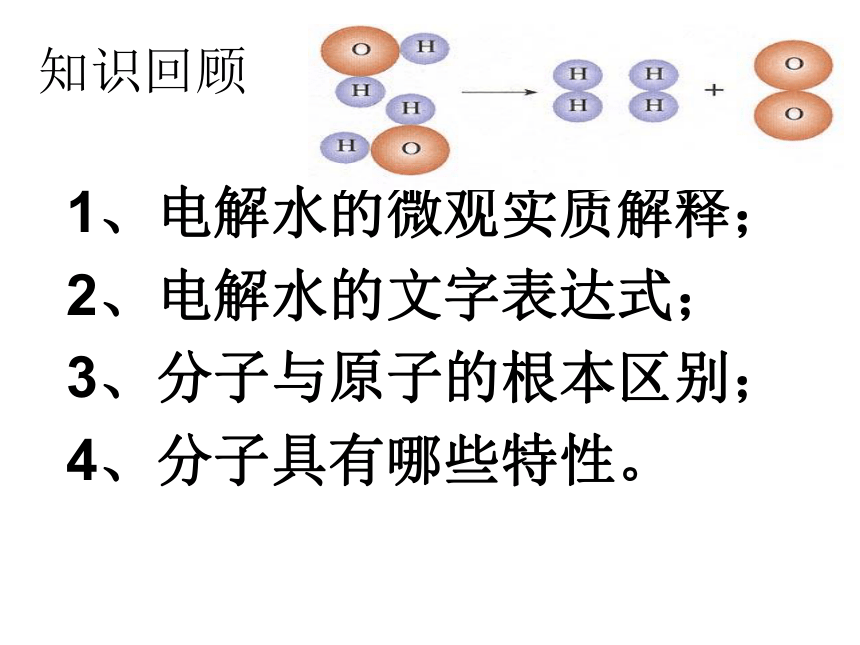
1、电解水的微观实质解释;
2、电解水的文字表达式;
3、分子与原子的根本区别;
4、分子具有哪些特性。
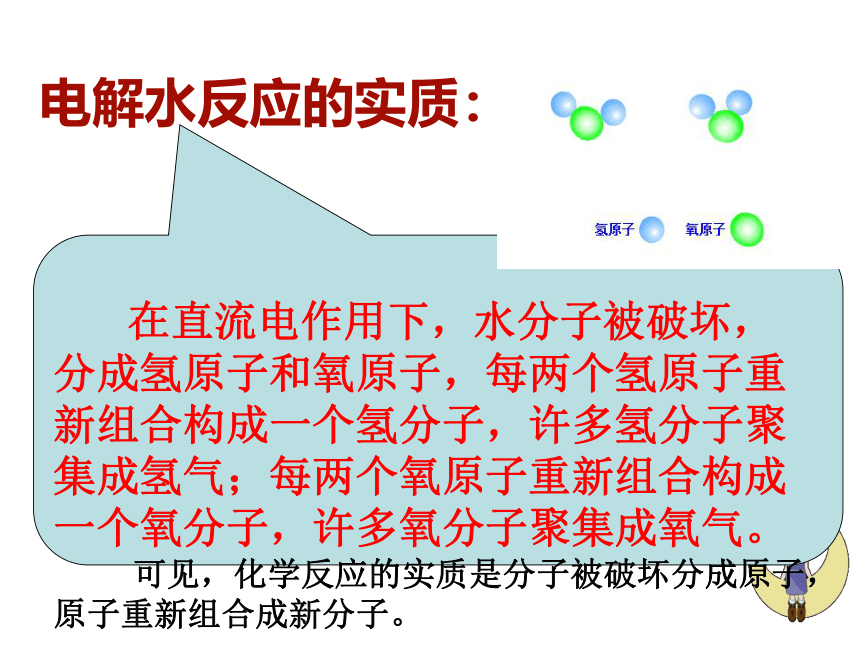
电解水反应的实质:
在直流电作用下,水分子被破坏,分成氢原子和氧原子,每两个氢原子重新组合构成一个氢分子,许多氢分子聚集成氢气;每两个氧原子重新组合构成一个氧分子,许多氧分子聚集成氧气。
可见,化学反应的实质是分子被破坏分成原子,原子重新组合成新分子。
第三单元
第一节
原子的构成
第
1
课
时
学习目标
1、掌握原子的构成;
2、理解并熟记在原子中“核电荷数、质子数、
核外电子数”的关系。
3、掌握相对原子质量的概念,并能进行简单
的计算。
近代科学原子论
1.一切物质都是由最小的不能再分的粒子——原子构成。
2.原子模型:原子是坚实的、不可再分的实心球。
英国化学家道尔顿
一、原子的构成
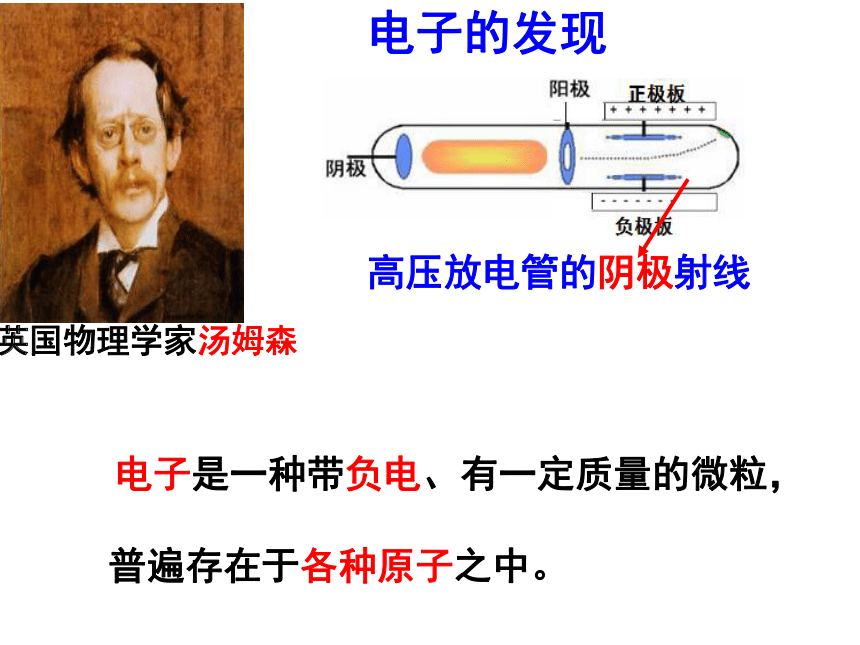
电子的发现
电子是一种带负电、有一定质量的微粒,
普遍存在于各种原子之中。
英国物理学家汤姆森
高压放电管的阴极射线
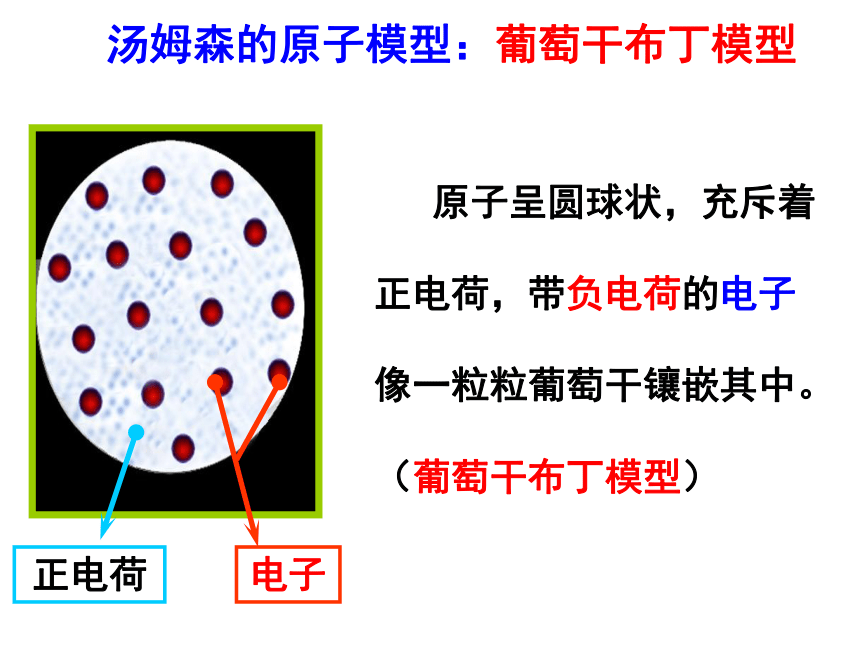
汤姆森的原子模型:葡萄干布丁模型
原子呈圆球状,充斥着正电荷,带负电荷的电子像一粒粒葡萄干镶嵌其中。(葡萄干布丁模型)
电子
正电荷
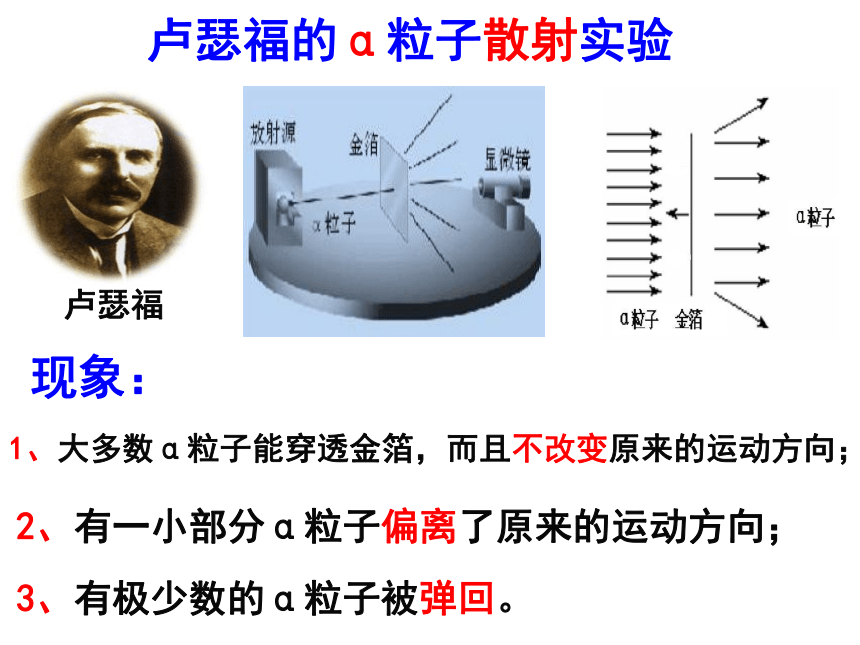
卢瑟福
卢瑟福的α粒子散射实验
2、有一小部分α粒子偏离了原来的运动方向;
3、有极少数的α粒子被弹回。
1、大多数α粒子能穿透金箔,而且不改变原来的运动方向;
现象:
1、大多数的α粒子能够顺利穿过金箔是因为:
原子核体积很小,原子核周围有相对较大的空间,大多数
α粒子在这个相对较大的空间内通过,几乎不受阻力作用。
2、少数α粒子的运动方向发生偏转是因为:
原子核体积很小而且带正电荷,少数α粒子在原子核附
近通过,因受到斥力的作用而偏离了原来的运动方向。
3、极少数α粒子被反弹回来是因为:
极少数α粒子碰到体积很小,质量很大的带正电的
原子核被弹回。
交流讨论
原子
原子核
核外电子
核电荷数(原子核所带正电荷的总数)
原子核是由什么构成的
?
原子的构成
(+)
(-)
原子核的构成
实验证明:原子核是由带正电的质子和不带电的中子构成。
原子弹爆炸
原子
原子核(+)
核外电子(-)
质子(+)
中子(不带电)
(每个质子带1个单位正电荷)
(每个电子带1个单位负电荷)
(一个原子只有一个原子核)
核外电子占据了原子的绝大部分体积.
核外电子决定原子的体积
原子的构成
因为质子和中子的质量差不多,都比电子大得多,都约是电子质量的1836倍,因此原子的质量主要集中在原子核上。
原子的质量为什么主要集中原子核上?
思考
卢瑟福原子模型(又称行星原子模型):原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。原子核的体积很小而质量很大,几乎集中了原子的全部质量,电子在原子核周围相对较大的空间内围绕原子核做高速运动,就像行星环绕太阳运转一样。
卢瑟福的原子模型
原子种类
核电荷数
质子数
中子数
电子数
氢
1
1
0
1
氧
8
8
8
8
钠
11
11
12
11
碳12
6
6
6
6
碳13
6
6
7
6
碳14
6
6
8
6
氯
18
18
17
18
1.原子中,
核电荷数=质子数=电子数;
2.质子数不一定等于中子数;
3.不是所有的原子都有中子;(如氢原子)
4.不同种类的原子,质子数不同,相同种类原子,
质子数相同。所以决定原子种类的粒子是质子。
请同学们认真分析表格,比一比谁获得的信息最多?
探究原子构成的规律
原子
原子核(+)
核外电子(-)
质子(+)
中子(不带电)
分析原子是否显电性?
不显电性
在原子中:核电荷数=质子数=核外电子数
核电荷数
原子不显电性的原因:原子核所带的正电荷和电子所带的负电荷,电量相等,电性相反。
全面认识原子
1、原子是构成物质的一种基本粒子
2、原子的体积和质量很小
3、原子之间存在间隔和相互作用
4、原子是不断运动的
5、原子在化学变化中不可再分
6、原子由原子核和核外电子构成
不同原子的质量各不相同,可以用现代科学仪器精确地测量出来。如:
一个氢原子的质量是:1.67×10-27㎏,
一个氧原子的质量是:2.657×10-26㎏,
一个铁原子的质量是:9.288×10-26㎏。
这样小的数字,书写、记忆和使用起来都很不方便,就像用吨做单位来表示一粒稻谷或小麦的质量一样,能不能用一种好写、好记、好用的方法来表示原子的质量呢?
二、原子质量的计量
相对原子质量
以一个碳12原子的实际质量(1.993×10-26kg)的1/12为基准,计算出其它原子的相对质量,就是这种原子的相对原子质量。
相对原子质量=
一个原子的实际质量
一个碳12原子质量的1/12
氢原子的相对原子质量是1
氧原子的相对原子质量是16
9.288×10-26
Kg
铁原子的相
对原子质量
=56
已知:碳原子的质量:
1.993×10-26
Kg
铁原子的质量:
9.288×10-26
Kg
求铁原子的相对原子质量
?
1.993×10-26Kg×1/12
=
答:铁原子的相对原子质量为56
1.相对原子质量是一个比值不是实际质量
2.相对原子质量与原子的实际质量成正比,相对
原子
3.质量之比等于原子的实际质量之比。
注意:
原子种类
质子数
中子数
核外电子数
相对原子质量
氢
1
0
1
1
碳
6
6
6
12
氧
8
8
8
16
钠
11
12
11
23
铁
26
30
26
56
相对原子质量与原子结构中的哪些微粒有关?有什么关系?
相对原子质量=质子数+中子数
原因:原子的质量主要集中在原子核上,一个质子和一个中子的质量都约是电子质量的1836倍,原子的质量约等于原子核的质量,即质子和中子的质量之和
原子
质子数
中子数
相对原子质量
H
1
0
H
1
2
H
2
3
碳12
6
12
碳13
7
13
碳14
6
8
O
8
8
16
填写空格
1
1
1
6
6
14
1、分子、原子、质子、中子、电子中,找出符合下列条件的粒子名称填在相应的横线上。
(1)能直接构成纯净物的是
。
(2)能保持物质化学性质的是
。
(3)化学变化中的最小粒子是
。
(4)带正电荷的粒子是
。
(5)带负电荷的粒子是
。
(6)不显电性的粒子是
。
(8)决定原子质量大小的粒子是
。(9)在同一原子中数目相等的粒子是
。
课堂检测
分子、原子
原子
分子、原子
质子
分子、原子、中子
电子
质子、中子
质子、电子
2、原子里质子数等于(
)
(A)中子数
(B)电子数
(C)中子数和电子数之和
(D)相对原子质量
3、化学变化中的最小微粒是(
),在化学变化中可分的微粒是
(
)
(A)原子
(B)分子
(C)电子
(D)原子核
B
A
B
4、卢瑟福实验:现象有
①
,
原因
,
②
,
原因
,
③
,
原因
,
这个实验证明了
。
知识回顾
1、电解水的微观实质解释;
2、电解水的文字表达式;
3、分子与原子的根本区别;
4、分子具有哪些特性。
电解水反应的实质:
在直流电作用下,水分子被破坏,分成氢原子和氧原子,每两个氢原子重新组合构成一个氢分子,许多氢分子聚集成氢气;每两个氧原子重新组合构成一个氧分子,许多氧分子聚集成氧气。
可见,化学反应的实质是分子被破坏分成原子,原子重新组合成新分子。
第三单元
第一节
原子的构成
第
1
课
时
学习目标
1、掌握原子的构成;
2、理解并熟记在原子中“核电荷数、质子数、
核外电子数”的关系。
3、掌握相对原子质量的概念,并能进行简单
的计算。
近代科学原子论
1.一切物质都是由最小的不能再分的粒子——原子构成。
2.原子模型:原子是坚实的、不可再分的实心球。
英国化学家道尔顿
一、原子的构成
电子的发现
电子是一种带负电、有一定质量的微粒,
普遍存在于各种原子之中。
英国物理学家汤姆森
高压放电管的阴极射线
汤姆森的原子模型:葡萄干布丁模型
原子呈圆球状,充斥着正电荷,带负电荷的电子像一粒粒葡萄干镶嵌其中。(葡萄干布丁模型)
电子
正电荷
卢瑟福
卢瑟福的α粒子散射实验
2、有一小部分α粒子偏离了原来的运动方向;
3、有极少数的α粒子被弹回。
1、大多数α粒子能穿透金箔,而且不改变原来的运动方向;
现象:
1、大多数的α粒子能够顺利穿过金箔是因为:
原子核体积很小,原子核周围有相对较大的空间,大多数
α粒子在这个相对较大的空间内通过,几乎不受阻力作用。
2、少数α粒子的运动方向发生偏转是因为:
原子核体积很小而且带正电荷,少数α粒子在原子核附
近通过,因受到斥力的作用而偏离了原来的运动方向。
3、极少数α粒子被反弹回来是因为:
极少数α粒子碰到体积很小,质量很大的带正电的
原子核被弹回。
交流讨论
原子
原子核
核外电子
核电荷数(原子核所带正电荷的总数)
原子核是由什么构成的
?
原子的构成
(+)
(-)
原子核的构成
实验证明:原子核是由带正电的质子和不带电的中子构成。
原子弹爆炸
原子
原子核(+)
核外电子(-)
质子(+)
中子(不带电)
(每个质子带1个单位正电荷)
(每个电子带1个单位负电荷)
(一个原子只有一个原子核)
核外电子占据了原子的绝大部分体积.
核外电子决定原子的体积
原子的构成
因为质子和中子的质量差不多,都比电子大得多,都约是电子质量的1836倍,因此原子的质量主要集中在原子核上。
原子的质量为什么主要集中原子核上?
思考
卢瑟福原子模型(又称行星原子模型):原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。原子核的体积很小而质量很大,几乎集中了原子的全部质量,电子在原子核周围相对较大的空间内围绕原子核做高速运动,就像行星环绕太阳运转一样。
卢瑟福的原子模型
原子种类
核电荷数
质子数
中子数
电子数
氢
1
1
0
1
氧
8
8
8
8
钠
11
11
12
11
碳12
6
6
6
6
碳13
6
6
7
6
碳14
6
6
8
6
氯
18
18
17
18
1.原子中,
核电荷数=质子数=电子数;
2.质子数不一定等于中子数;
3.不是所有的原子都有中子;(如氢原子)
4.不同种类的原子,质子数不同,相同种类原子,
质子数相同。所以决定原子种类的粒子是质子。
请同学们认真分析表格,比一比谁获得的信息最多?
探究原子构成的规律
原子
原子核(+)
核外电子(-)
质子(+)
中子(不带电)
分析原子是否显电性?
不显电性
在原子中:核电荷数=质子数=核外电子数
核电荷数
原子不显电性的原因:原子核所带的正电荷和电子所带的负电荷,电量相等,电性相反。
全面认识原子
1、原子是构成物质的一种基本粒子
2、原子的体积和质量很小
3、原子之间存在间隔和相互作用
4、原子是不断运动的
5、原子在化学变化中不可再分
6、原子由原子核和核外电子构成
不同原子的质量各不相同,可以用现代科学仪器精确地测量出来。如:
一个氢原子的质量是:1.67×10-27㎏,
一个氧原子的质量是:2.657×10-26㎏,
一个铁原子的质量是:9.288×10-26㎏。
这样小的数字,书写、记忆和使用起来都很不方便,就像用吨做单位来表示一粒稻谷或小麦的质量一样,能不能用一种好写、好记、好用的方法来表示原子的质量呢?
二、原子质量的计量
相对原子质量
以一个碳12原子的实际质量(1.993×10-26kg)的1/12为基准,计算出其它原子的相对质量,就是这种原子的相对原子质量。
相对原子质量=
一个原子的实际质量
一个碳12原子质量的1/12
氢原子的相对原子质量是1
氧原子的相对原子质量是16
9.288×10-26
Kg
铁原子的相
对原子质量
=56
已知:碳原子的质量:
1.993×10-26
Kg
铁原子的质量:
9.288×10-26
Kg
求铁原子的相对原子质量
?
1.993×10-26Kg×1/12
=
答:铁原子的相对原子质量为56
1.相对原子质量是一个比值不是实际质量
2.相对原子质量与原子的实际质量成正比,相对
原子
3.质量之比等于原子的实际质量之比。
注意:
原子种类
质子数
中子数
核外电子数
相对原子质量
氢
1
0
1
1
碳
6
6
6
12
氧
8
8
8
16
钠
11
12
11
23
铁
26
30
26
56
相对原子质量与原子结构中的哪些微粒有关?有什么关系?
相对原子质量=质子数+中子数
原因:原子的质量主要集中在原子核上,一个质子和一个中子的质量都约是电子质量的1836倍,原子的质量约等于原子核的质量,即质子和中子的质量之和
原子
质子数
中子数
相对原子质量
H
1
0
H
1
2
H
2
3
碳12
6
12
碳13
7
13
碳14
6
8
O
8
8
16
填写空格
1
1
1
6
6
14
1、分子、原子、质子、中子、电子中,找出符合下列条件的粒子名称填在相应的横线上。
(1)能直接构成纯净物的是
。
(2)能保持物质化学性质的是
。
(3)化学变化中的最小粒子是
。
(4)带正电荷的粒子是
。
(5)带负电荷的粒子是
。
(6)不显电性的粒子是
。
(8)决定原子质量大小的粒子是
。(9)在同一原子中数目相等的粒子是
。
课堂检测
分子、原子
原子
分子、原子
质子
分子、原子、中子
电子
质子、中子
质子、电子
2、原子里质子数等于(
)
(A)中子数
(B)电子数
(C)中子数和电子数之和
(D)相对原子质量
3、化学变化中的最小微粒是(
),在化学变化中可分的微粒是
(
)
(A)原子
(B)分子
(C)电子
(D)原子核
B
A
B
4、卢瑟福实验:现象有
①
,
原因
,
②
,
原因
,
③
,
原因
,
这个实验证明了
。
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
