山东省东平县实验中学2019-2020学年第二学期八年级化学-第一节 原子的构成第二课时 原子质量的计算(22张ppt)
文档属性
| 名称 | 山东省东平县实验中学2019-2020学年第二学期八年级化学-第一节 原子的构成第二课时 原子质量的计算(22张ppt) |
|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-05 22:06:02 | ||
图片预览






文档简介
(共22张PPT)
原子
_____
______
___
___
(每个
带一个单位
电荷)
(不带电)
(每个
带一个单位的
电荷)
(
)=(
)=核外电子数
原子
_____
______
___
___
(每个
带一个单位
电荷)
(不带电)
(每个
带一个单位的
电荷)
质子
中子
原子核
核外电子
质子
电子
正
负
核电荷数=质子数=核外电子数
第三单元第一节
原子的构成
第二课时
原子质量的计算
原子中的电子
1.
学会根据公式计算的原子相对原子质量,能说出原子的实际质量与相对原子质量的关系。
2.
说出核外电子分层排布的规律,记住原子结构示意图各部分表示的意义。
3.
认识最外层电子在化学变化中的作用,以NaCl为例知道离子的形成以及原子、离子的相互转化,知道构成物质的基本微粒。
学习目标
以一个碳12原子实际质量的1/12作为基准,
其他原子的质量跟它的比值,
就是这种原子的相对原子质量。
根据定义能不能写出相对原子质量的数学计算式?
相对原子质量
=
某种原子的质量
碳12原子质量×1/12
相对原子质量的概念:
已知碳原子质量为1.993×10-26kg、氧原子质量为2.657×10-26kg,
试计算氧原子的相对原子质量?
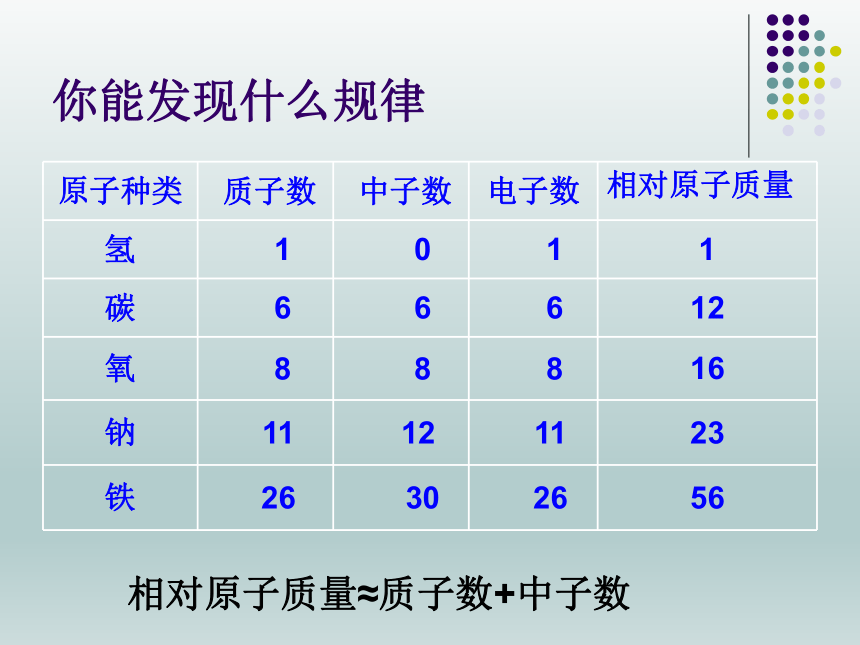
你能发现什么规律
原子种类
质子数
中子数
电子数
相对原子质量
氢
1
0
1
1
碳
6
6
6
12
氧
8
8
8
16
钠
11
12
11
23
铁
26
30
26
56
相对原子质量≈质子数+中子数
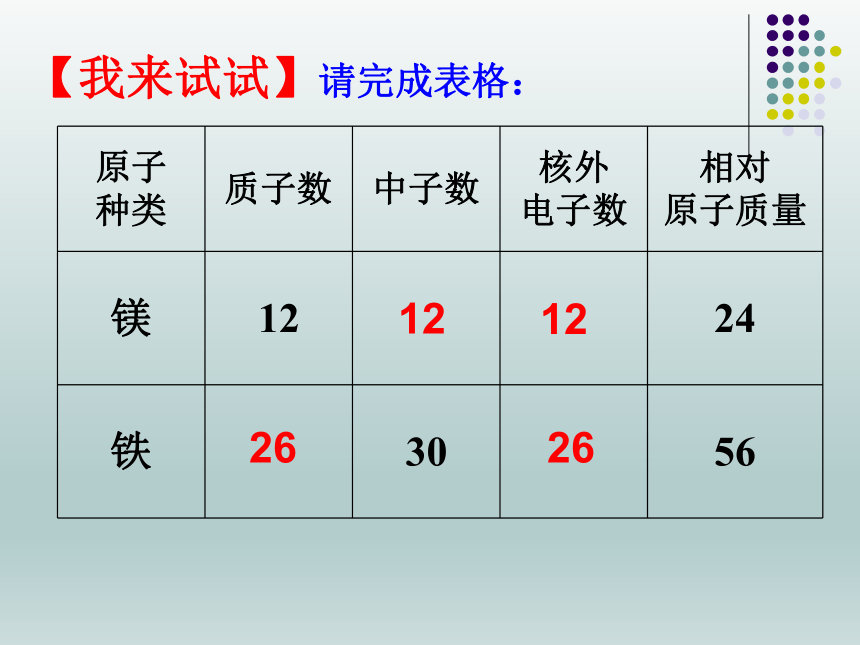
【我来试试】请完成表格:
原子
种类
质子数
中子数
核外
电子数
相对
原子质量
镁
12
24
铁
30
56
12
12
26
26
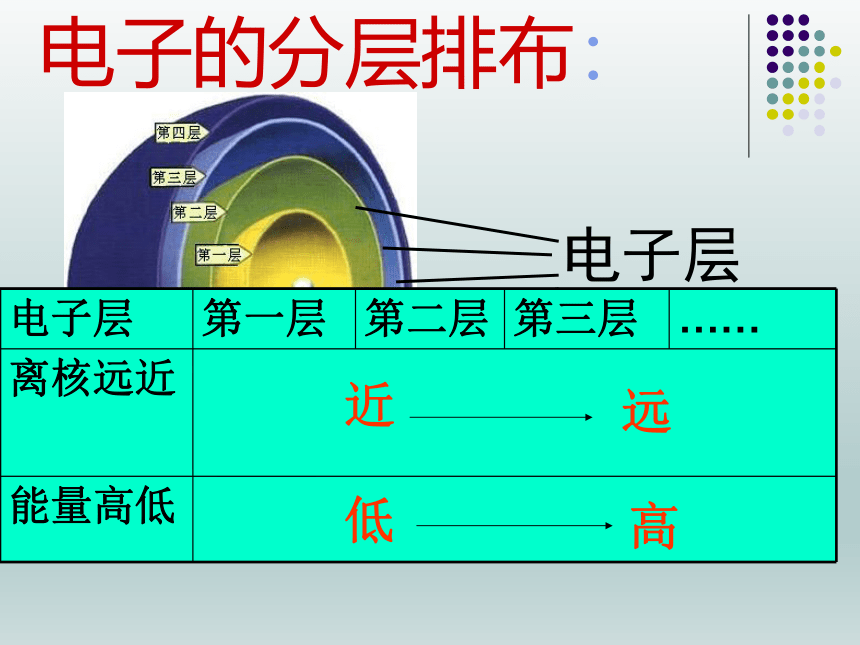
电子的分层排布:
电子层
电子层
第一层
第二层
第三层
……
离核远近
能量高低
近
低
远
高
一个氧原子的原子核内有8个质子和8个中子。核外有8个电子,其中有2个电子能量相近都较低,另外6个电子能量相近且能量稍高。这些电子都同时绕原子核高速运动。
根据刚才的理解,请你把氧原子的结构以
最简洁的方式画出来。
资料介绍:
2
+8
6
原子核
质子数
该层电子数
原子结构示意图表示的意义
氧原
子
结
构
示
意
图:
第一层
第二层(最外层)
学以致用:
资料介绍:一个镁原子核内有12个质子,它的原子核外有12个电子,其中有2个电子能量相近都较低且离核最近,8个电子能量略高且离核稍远,还有2个电子能量最高且离核最远。这些电子都同时绕镁的原子核运动。
2
2
8
+12
Mg
镁
原子结构示意图
原子结构示意图
金属原子
非金属原子
请将以下原子进行分类,并说出分类的依据。
分析各类原子的最外层电子数,分析它们的特点
稀有气体
元
素
最外
层
电
子
数
原子
结
构
变
化
趋
势
化学性
质
稀
有
气
体
金
属
非
金属
8个(氦
为2个
)
稳
定
结
构
稳
定
稳
定
一般
﹤
4
个
?不稳
定
结
构
易
失
去
电
子
活
泼
一
般≥4
个
?不
稳
定
结
构
易
获
得
电
子
活
泼
原子最外电子数与结构、性质的关系:
最外层电子数
决定
原子的化学性质
提示:原子的最外层电子数等于
8
的时候,最稳定。
故事分析:
有一天,你和你的好朋友一起去买书,当时你有11元钱,而她有9元钱,你们俩都选中了一样的书,如果那本书是10元钱,你会怎么办呢?
氯化钠的形成:
在化学世界里,原子之间也会发扬互帮互助的精神的。
2
1
8
+11
钠原子(Na)
2
7
8
+17
氯原子(Cl
)
2
7
8
+17
2
1
8
+11
+11
2
8
2
8
8
+17
钠原子(Na)
氯原子(Cl
)
钠离子(
)
氯离子(
)
失去一
个电子
得到一
个电子
Na+
Cl-
食盐氯化钠的形成过程
NaCl
通过以上学习,你对原子中的电子有哪些新的认识?
1、电子是有能量的。
2、电子是分层排布的
3、电子决定原子的体积大小。
4、最外层电子数决定得失电子的数值。
5、电子决定原子在化学变化中的表现。
……
清点收获:
构成物质的一种新微粒:离子
(1)离子:
(2)分类:
阳离子
阴离子
(3)表示:
(4)离子是构成物质的一种粒子。
离子符号
Na+
Cl-
离子结构示意图
+17
2
8
8
氯化钠(NaCl)是由
和
构成的。
带电的原子
(带正电荷的离子)如:Na+
(带负电荷的离子)如:Cl-
钠离子(Na+)
氯离子(
Cl-
)
离子符号的含义
Mg
2+
每个镁离子带两个单位正电荷
3
3个镁离子
带两个单位正电荷的镁离子
反思总结:
这节课都学到了什么……..
课下完成课本57页“挑战自我”
原子
_____
______
___
___
(每个
带一个单位
电荷)
(不带电)
(每个
带一个单位的
电荷)
(
)=(
)=核外电子数
原子
_____
______
___
___
(每个
带一个单位
电荷)
(不带电)
(每个
带一个单位的
电荷)
质子
中子
原子核
核外电子
质子
电子
正
负
核电荷数=质子数=核外电子数
第三单元第一节
原子的构成
第二课时
原子质量的计算
原子中的电子
1.
学会根据公式计算的原子相对原子质量,能说出原子的实际质量与相对原子质量的关系。
2.
说出核外电子分层排布的规律,记住原子结构示意图各部分表示的意义。
3.
认识最外层电子在化学变化中的作用,以NaCl为例知道离子的形成以及原子、离子的相互转化,知道构成物质的基本微粒。
学习目标
以一个碳12原子实际质量的1/12作为基准,
其他原子的质量跟它的比值,
就是这种原子的相对原子质量。
根据定义能不能写出相对原子质量的数学计算式?
相对原子质量
=
某种原子的质量
碳12原子质量×1/12
相对原子质量的概念:
已知碳原子质量为1.993×10-26kg、氧原子质量为2.657×10-26kg,
试计算氧原子的相对原子质量?
你能发现什么规律
原子种类
质子数
中子数
电子数
相对原子质量
氢
1
0
1
1
碳
6
6
6
12
氧
8
8
8
16
钠
11
12
11
23
铁
26
30
26
56
相对原子质量≈质子数+中子数
【我来试试】请完成表格:
原子
种类
质子数
中子数
核外
电子数
相对
原子质量
镁
12
24
铁
30
56
12
12
26
26
电子的分层排布:
电子层
电子层
第一层
第二层
第三层
……
离核远近
能量高低
近
低
远
高
一个氧原子的原子核内有8个质子和8个中子。核外有8个电子,其中有2个电子能量相近都较低,另外6个电子能量相近且能量稍高。这些电子都同时绕原子核高速运动。
根据刚才的理解,请你把氧原子的结构以
最简洁的方式画出来。
资料介绍:
2
+8
6
原子核
质子数
该层电子数
原子结构示意图表示的意义
氧原
子
结
构
示
意
图:
第一层
第二层(最外层)
学以致用:
资料介绍:一个镁原子核内有12个质子,它的原子核外有12个电子,其中有2个电子能量相近都较低且离核最近,8个电子能量略高且离核稍远,还有2个电子能量最高且离核最远。这些电子都同时绕镁的原子核运动。
2
2
8
+12
Mg
镁
原子结构示意图
原子结构示意图
金属原子
非金属原子
请将以下原子进行分类,并说出分类的依据。
分析各类原子的最外层电子数,分析它们的特点
稀有气体
元
素
最外
层
电
子
数
原子
结
构
变
化
趋
势
化学性
质
稀
有
气
体
金
属
非
金属
8个(氦
为2个
)
稳
定
结
构
稳
定
稳
定
一般
﹤
4
个
?不稳
定
结
构
易
失
去
电
子
活
泼
一
般≥4
个
?不
稳
定
结
构
易
获
得
电
子
活
泼
原子最外电子数与结构、性质的关系:
最外层电子数
决定
原子的化学性质
提示:原子的最外层电子数等于
8
的时候,最稳定。
故事分析:
有一天,你和你的好朋友一起去买书,当时你有11元钱,而她有9元钱,你们俩都选中了一样的书,如果那本书是10元钱,你会怎么办呢?
氯化钠的形成:
在化学世界里,原子之间也会发扬互帮互助的精神的。
2
1
8
+11
钠原子(Na)
2
7
8
+17
氯原子(Cl
)
2
7
8
+17
2
1
8
+11
+11
2
8
2
8
8
+17
钠原子(Na)
氯原子(Cl
)
钠离子(
)
氯离子(
)
失去一
个电子
得到一
个电子
Na+
Cl-
食盐氯化钠的形成过程
NaCl
通过以上学习,你对原子中的电子有哪些新的认识?
1、电子是有能量的。
2、电子是分层排布的
3、电子决定原子的体积大小。
4、最外层电子数决定得失电子的数值。
5、电子决定原子在化学变化中的表现。
……
清点收获:
构成物质的一种新微粒:离子
(1)离子:
(2)分类:
阳离子
阴离子
(3)表示:
(4)离子是构成物质的一种粒子。
离子符号
Na+
Cl-
离子结构示意图
+17
2
8
8
氯化钠(NaCl)是由
和
构成的。
带电的原子
(带正电荷的离子)如:Na+
(带负电荷的离子)如:Cl-
钠离子(Na+)
氯离子(
Cl-
)
离子符号的含义
Mg
2+
每个镁离子带两个单位正电荷
3
3个镁离子
带两个单位正电荷的镁离子
反思总结:
这节课都学到了什么……..
课下完成课本57页“挑战自我”
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
