山东省东平县实验中学2019-2020学年第二学期八年级化学3.1第三单元第一节(25张ppt)
文档属性
| 名称 | 山东省东平县实验中学2019-2020学年第二学期八年级化学3.1第三单元第一节(25张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-05 22:07:54 | ||
图片预览



文档简介
(共25张PPT)
2.保持氧气化学性质的粒子是(
),保持二氧化碳化学性质的粒子是(
),所以,_____分子性质相同,_____分子性质不同。
1.构成物质的微粒有分子、原子
原子的构成
原子的结构
内容提要
1
2
3
原子中的电子
原子质量的计量
1.了解原子的构成,知道原子中各粒子间的关系;
2.了解原子核外电子的分布情况,知道离子的概念;
3.学会用相对原子质量比较原子质量的大小,并会查阅相对原子质量。
学习目标
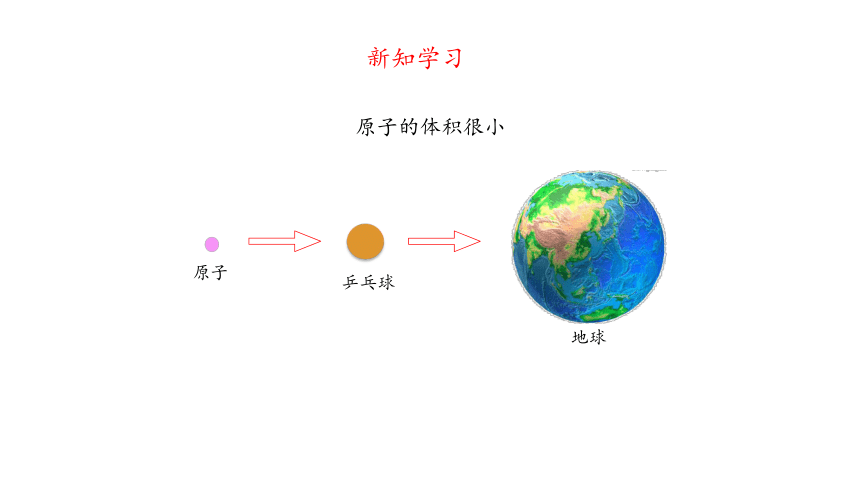
新知学习
原子
地球
乒乓球
原子的体积很小
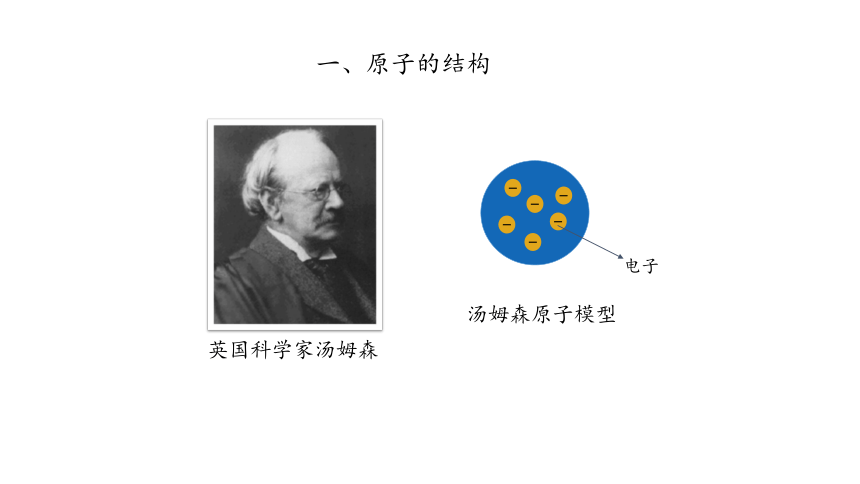
一、原子的结构
-
-
-
-
-
-
英国科学家汤姆森
汤姆森原子模型
电子
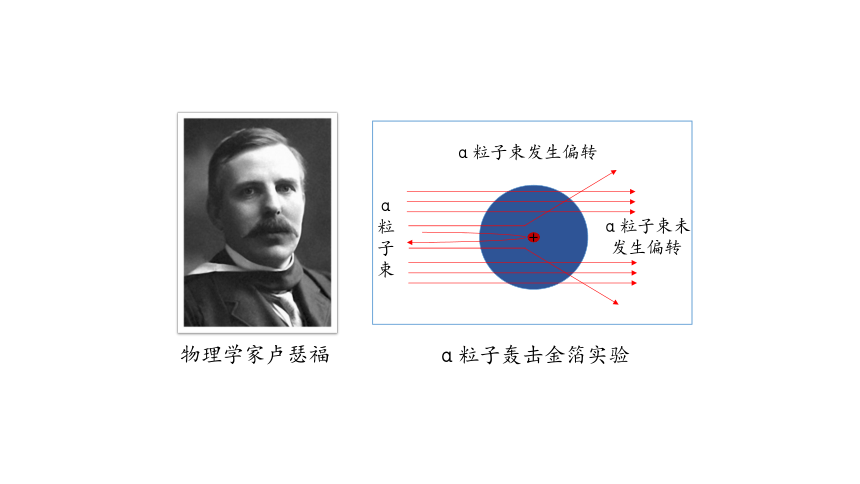
物理学家卢瑟福
α粒子轰击金箔实验
+
α粒子束
α粒子束发生偏转
α粒子束未发生偏转
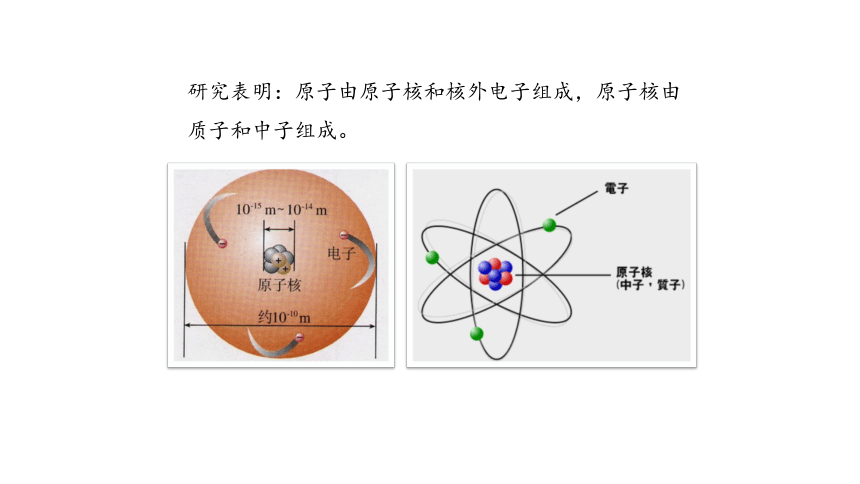
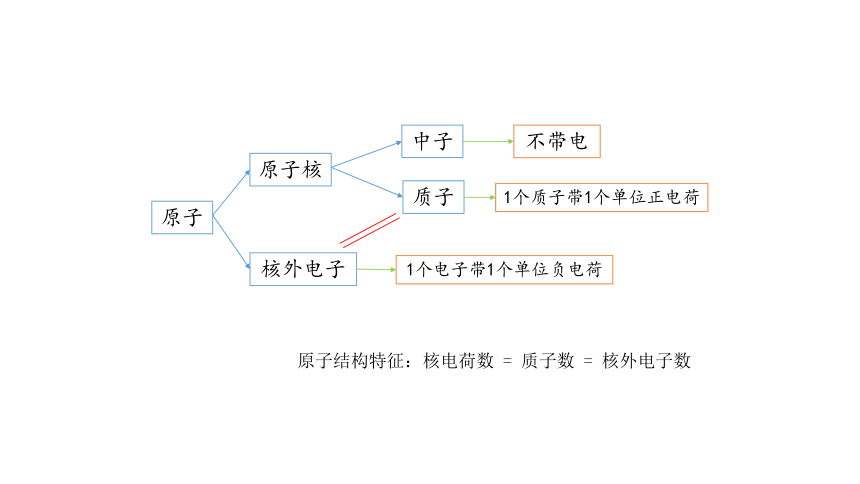
研究表明:原子由原子核和核外电子组成,原子核由质子和中子组成。
原子
原子核
核外电子
中子
质子
1个电子带1个单位负电荷
不带电
1个质子带1个单位正电荷
原子结构特征:核电荷数
=
质子数
=
核外电子数
原子是构成物质的一种基本粒子,且具有微观粒子的一般性质。
二、原子质量的计量
1个铁原子的质量约为9.288×10-26kg。
1个氧原子的质量约为2.657×10-26kg。
原子的质量很小
相对原子质量(Ar)
=
原子的实际质量
碳12原子质量的1/12
1个碳12原子的质量的1/12约为1.67×10-27kg。
1个碳12原子的质量
12个氢原子的质量
氢原子的相对原子质量为1
原子种类
质子数
中子数
核外电子数
近似相对原子质量
氢
1
0
1
1
碳
6
6
6
12
氧
8
8
8
16
钠
11
12
11
23
氯
17
18
17
35
铁
26
30
26
56
规律:近似相对原子质量=质子数+中子数
三、原子中的电子
核外电子分层排布规律
近
远
低
高
离原子核:
电子能量:
电子层:
1
2
3
4
5
6
7
氧原子的结构示意图
+8
2
6
表示原子核
以及核内的
质子数
表示电子层
以及电子层
上的电子数
原子的核外电子最少的只有一层,最多的有七层,最外层电子数不超过8个(只有一层的,电子不超过2个)。
1-18号原子的结构示意图
思考:通过这些原子结构示意图,你能总结出哪些规律?
原子分类
最外层电子数
原子结构
(稳定或不稳定)
变化趋势
(得失电子)
化学性质
(稳定或活泼)
稀有气
体原子
金属原子
非金属原子
8个(氦为2个)
相对稳定结构
不得不失
稳定
一般小于4个
不稳定结构
易失电子
活泼
一般大于4个
不稳定结构
易得电子
活泼
原子与最外层电子数的关系
钠原子的结构示意图
氯原子的结构示意图
离子
阳离子
阴离子
带正电的原子,Na+
带负电的原子,Cl-
带电的原子
离子符号
表示每个镁离子带2个单位的正电荷
2Mg2+
表示2个镁离子
氯化钠:由Na+、Cl-构成,
Na+、Cl-数目比为1:1
离子也是构成物质的一种基本粒子。
构成物质的微粒
原子
物质
直接构成
阴阳离子
得失电子
构成
分子
结合
构成
原子的构成
原子的结构
电子
相对原子质量
原子核
核外电子
质子
中子
电子层排布
离子
碳12
单位为1
课堂练习
1.下列叙述正确的是(
)
A.原子核都由质子和中子构成
B.在原子中,核内的质子数与核外的电子数不一定相等
C.原子里有相对很大的空间,电子在这个空间里作高速运动
D.一切物质都是由原子直接构成
C
2.某粒子的结构示意图如图,
则下列说法正确的(
)
A.该元素是稀有气体元素
B.该原子的最外层电子数是8
C.该原子共有三个电子层
D.该原子在反应中容易获得电子
C
+12
3.在原子结构中,不一定含有的粒子是(
)
A.质子
B.电子
C.中子
D.原子核
C
2.保持氧气化学性质的粒子是(
),保持二氧化碳化学性质的粒子是(
),所以,_____分子性质相同,_____分子性质不同。
1.构成物质的微粒有分子、原子
原子的构成
原子的结构
内容提要
1
2
3
原子中的电子
原子质量的计量
1.了解原子的构成,知道原子中各粒子间的关系;
2.了解原子核外电子的分布情况,知道离子的概念;
3.学会用相对原子质量比较原子质量的大小,并会查阅相对原子质量。
学习目标
新知学习
原子
地球
乒乓球
原子的体积很小
一、原子的结构
-
-
-
-
-
-
英国科学家汤姆森
汤姆森原子模型
电子
物理学家卢瑟福
α粒子轰击金箔实验
+
α粒子束
α粒子束发生偏转
α粒子束未发生偏转
研究表明:原子由原子核和核外电子组成,原子核由质子和中子组成。
原子
原子核
核外电子
中子
质子
1个电子带1个单位负电荷
不带电
1个质子带1个单位正电荷
原子结构特征:核电荷数
=
质子数
=
核外电子数
原子是构成物质的一种基本粒子,且具有微观粒子的一般性质。
二、原子质量的计量
1个铁原子的质量约为9.288×10-26kg。
1个氧原子的质量约为2.657×10-26kg。
原子的质量很小
相对原子质量(Ar)
=
原子的实际质量
碳12原子质量的1/12
1个碳12原子的质量的1/12约为1.67×10-27kg。
1个碳12原子的质量
12个氢原子的质量
氢原子的相对原子质量为1
原子种类
质子数
中子数
核外电子数
近似相对原子质量
氢
1
0
1
1
碳
6
6
6
12
氧
8
8
8
16
钠
11
12
11
23
氯
17
18
17
35
铁
26
30
26
56
规律:近似相对原子质量=质子数+中子数
三、原子中的电子
核外电子分层排布规律
近
远
低
高
离原子核:
电子能量:
电子层:
1
2
3
4
5
6
7
氧原子的结构示意图
+8
2
6
表示原子核
以及核内的
质子数
表示电子层
以及电子层
上的电子数
原子的核外电子最少的只有一层,最多的有七层,最外层电子数不超过8个(只有一层的,电子不超过2个)。
1-18号原子的结构示意图
思考:通过这些原子结构示意图,你能总结出哪些规律?
原子分类
最外层电子数
原子结构
(稳定或不稳定)
变化趋势
(得失电子)
化学性质
(稳定或活泼)
稀有气
体原子
金属原子
非金属原子
8个(氦为2个)
相对稳定结构
不得不失
稳定
一般小于4个
不稳定结构
易失电子
活泼
一般大于4个
不稳定结构
易得电子
活泼
原子与最外层电子数的关系
钠原子的结构示意图
氯原子的结构示意图
离子
阳离子
阴离子
带正电的原子,Na+
带负电的原子,Cl-
带电的原子
离子符号
表示每个镁离子带2个单位的正电荷
2Mg2+
表示2个镁离子
氯化钠:由Na+、Cl-构成,
Na+、Cl-数目比为1:1
离子也是构成物质的一种基本粒子。
构成物质的微粒
原子
物质
直接构成
阴阳离子
得失电子
构成
分子
结合
构成
原子的构成
原子的结构
电子
相对原子质量
原子核
核外电子
质子
中子
电子层排布
离子
碳12
单位为1
课堂练习
1.下列叙述正确的是(
)
A.原子核都由质子和中子构成
B.在原子中,核内的质子数与核外的电子数不一定相等
C.原子里有相对很大的空间,电子在这个空间里作高速运动
D.一切物质都是由原子直接构成
C
2.某粒子的结构示意图如图,
则下列说法正确的(
)
A.该元素是稀有气体元素
B.该原子的最外层电子数是8
C.该原子共有三个电子层
D.该原子在反应中容易获得电子
C
+12
3.在原子结构中,不一定含有的粒子是(
)
A.质子
B.电子
C.中子
D.原子核
C
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
