山东省东平县实验中学2019-2020学年第二学期八年级化学3.3.3物质组成的定量表示(22张ppt)
文档属性
| 名称 | 山东省东平县实验中学2019-2020学年第二学期八年级化学3.3.3物质组成的定量表示(22张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 941.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-06 09:25:29 | ||
图片预览








文档简介
(共22张PPT)
标出下列化学式中各元素的化合价
(1)MgO
(2)K2O
(3)H2O
(4)Ca(O
H)2
+2
-2
+1
-2
+1
-2
+2
-2
+1
相对原子质量=
一个原子的实际质量
一个碳12原子质量的1/12
相对原子质量有哪些应用呢?
温顾知新
相对分子质量?
第三节
物质组成的表示
第三课时
物质组成的定量表示
1、记住化学式量的概念,知道相对分子质量的含义。
2、学会根据化学式进行化学式量(相对分子质量)、各元素质量比、某元素质量分数的计算。
学习目标
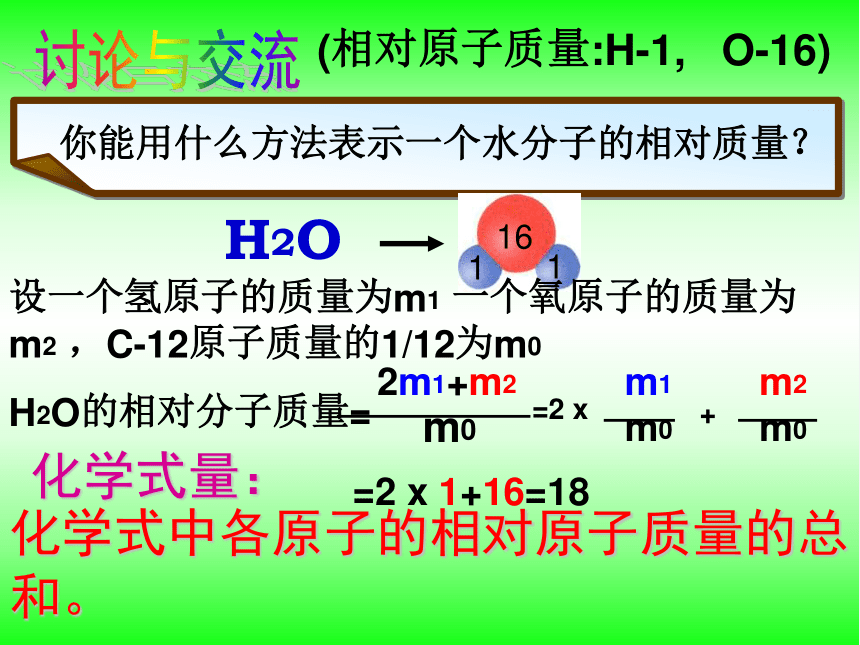
你能用什么方法表示一个水分子的相对质量?
H2O
讨论与交流
化学式中各原子的相对原子质量的总和。
化学式量:
(相对原子质量:H-1,
O-16)
H2O的相对分子质量=
设一个氢原子的质量为m1
一个氧原子的质量为m2
,C-12原子质量的1/12为m0
2m1+m2
m0
m1
m0
m2
m0
=2
x
+
=2
x
1+16=18
16
1
1
根据化学式计算
(或相对分子质量)
相对原子质量的应用
化学式量:某物质化学式中各原子的相对原子质量的总和,就是该物质的化学式量。对于由分子构成的物质,其化学式量也叫相对分子质量。
H2O
16
1
1
H2O的相对分子质量=
1
×2
+
×1
=18
16
化学式量
求下列物质的化学式量
(1)Cl2
(2)CO2
(3)
Ca(OH)2
(4)
NH4NO3
(相对原子质量:Cl-35.5
C-12
O-16
Ca-40)
小试牛刀
求下列物质的化学式量
35.5
×2
=
71
14×2+1×4+16×3=80
40
×1+(16+1)×2=74
(1)
Cl2
的化学式量=
(2)
CO2的化学式量=
(3)
Ca(OH)2
的化学式量=
练习
1
(相对原子质量:Cl-35.5
C-12
O-16
Ca-40)
(4)
NH4NO3的化学式量=
14×2+1×4+16×3=80
H2O
你认为在一个水分子中还存在哪些数量关系
?
交流与讨论
16
1
1
氢原子与氧原子的个数比
氢元素与氧元素的质量比
氢元素(或氧元素)在水中的质量分数
2:1
水中
氢元素的质量
氧元素的质量
:
=氢的相对原子质量×个数:氧的相对原子质量×个数
H2O
(1×2)
(16×1)
:
=1
:
8
1个H2O分子中
2个H2O分子中
H原子的质量
O原子的质量
n个H2O分子中
活动与探究一
:
=(1×2):(16×1)=1:8
(1×2)x
2
:
(16×1)x
2
=1
:
8
(1×2)x
n
(16×1)x
n
:
=1
:
8
解:
H2O中氢元素与氧元素的质量比为:(1×2):(16×1)=2:16=1:8
答:
H2O中氢元素与氧元素的质量比为1:8
化合物中各元素的质量比=
化学式中各原子的相对原子质量×原子个数之比
尿素是一种常用的化肥,化学式是CO(NH2)2
请计算:尿素中各元素的质量比。
=
12:16:28:4
=
3:4:7:1
解:CO(NH2)2中C、O、N、H四种元素的质量比为:
跟踪练习
(12x1):(16x1):(14x2):(1x4)
答:CO(NH2)2中C、O、N、H、四种元素的质量比是3:4:7:1
水中氢元素的质量分数(
%)为:
活动与探究二
1×2
1×2
+16×1
×100%
≈11.1
%
=
氢元素的相对原子质量×氢原子个数
水相对分子质量
×100%
该元素的相对原子质量×该原子的个数
物质的化学式量
×100%
物质中某元素的质量分数(
%)为:
H2O
尿素CO(NH2)2中氮元素的质量分数(P71)
14×2
×100%
≈
46.7%
12
×1+16×1+14×2+1×4
跟踪练习
新盖中盖高钙片
【成份】
碳酸钙、甘露醇、乳糖、淀粉、维生素D、甜橙香精、柠檬酸、阿斯马甜(含苯丙氨酸)、苋菜红
【用法与用量】
每日1次,每次1片,新盖中盖高钙片含食或嚼食
【功效成分及含量】
每片中含:钙500mg、维生素D100IU
【适宜人群】
需要补钙者
【注意事项】新盖中盖高钙片不宜超过推荐量或与同类营养素补充剂同时食用
化学式:
CaCO3
试计算碳酸钙中钙元素的质量分数。
(相对原子质量:C-12
Ca-40
O-16)
化学与生活
36g水(H2O)中含氢元素的质量是多少?
解:氢元素的质量为:
×100%
答:36g
水中含4g碳元素。
=4g
36g×
18
2
=36g×
1×2
+16
×1
1×2
练习:88g二氧化碳(CO2)中含有多少克碳元素?
元素的质量=物质质量×该元素的质量分数
×100%
活动三、一定质量的物质中含某元素的质量
计算多少克水中含氢元素4g?
答:36g水中含硫元素4g。
活动四、已知某元素的质量求物质的质量
解:设水的质量为
X
X
·
1×2
×100%
=4g
X
·
2
18
×100%
X
=
36g
=4g
方法1:
1×2
+16
×1
答:36g水中含氢元素4g。
练习:多少克水中含有32克氧元素?
方法2:
解:水的质量为:
=36g
4g÷
×100%
物质质量=元素质量÷元素的质量分数
1×2
1×2
+16
×1
化学式:NH4HCO3
揭露骗局
=17.7%
解:
NH4HCO3的相对分
子质量为:14+1x5+12+16x3=79
NH4HCO3中氮元素的质
量分数为:
此广告为虚假广告!
一、元素质量比的计算
二、元素质量分数的计算
三、一定质量的物质中含某元素的质量
四、已知某元素的质量求物质的质量
课堂小结
(相对原子质量:Fe-56
O-16)
根据氧化铁的化学式Fe2O3计算:
(1)
Fe2O3的化学式量;
(2)氧化铁中氧元素和铁元素的质量比?
(3)氧化铁中铁元素的质量分数?
(4)80克氧化铁含铁元素多少克?
(5)多少克氧化铁中含有7克氧元素?
当堂检测
思考
某碳酸氢铵(NH4HCO3)产品的含氮量为15%,判断它是纯净物还是混合物。
17.7
%
混合物
1、先求出化学式中该元素的质量分数(B)
2、与题目中的数字(A)相比较,若A
=
B
,是纯净物;若A
<B,是混合物;若A
>
B,是虚假广告。
标出下列化学式中各元素的化合价
(1)MgO
(2)K2O
(3)H2O
(4)Ca(O
H)2
+2
-2
+1
-2
+1
-2
+2
-2
+1
相对原子质量=
一个原子的实际质量
一个碳12原子质量的1/12
相对原子质量有哪些应用呢?
温顾知新
相对分子质量?
第三节
物质组成的表示
第三课时
物质组成的定量表示
1、记住化学式量的概念,知道相对分子质量的含义。
2、学会根据化学式进行化学式量(相对分子质量)、各元素质量比、某元素质量分数的计算。
学习目标
你能用什么方法表示一个水分子的相对质量?
H2O
讨论与交流
化学式中各原子的相对原子质量的总和。
化学式量:
(相对原子质量:H-1,
O-16)
H2O的相对分子质量=
设一个氢原子的质量为m1
一个氧原子的质量为m2
,C-12原子质量的1/12为m0
2m1+m2
m0
m1
m0
m2
m0
=2
x
+
=2
x
1+16=18
16
1
1
根据化学式计算
(或相对分子质量)
相对原子质量的应用
化学式量:某物质化学式中各原子的相对原子质量的总和,就是该物质的化学式量。对于由分子构成的物质,其化学式量也叫相对分子质量。
H2O
16
1
1
H2O的相对分子质量=
1
×2
+
×1
=18
16
化学式量
求下列物质的化学式量
(1)Cl2
(2)CO2
(3)
Ca(OH)2
(4)
NH4NO3
(相对原子质量:Cl-35.5
C-12
O-16
Ca-40)
小试牛刀
求下列物质的化学式量
35.5
×2
=
71
14×2+1×4+16×3=80
40
×1+(16+1)×2=74
(1)
Cl2
的化学式量=
(2)
CO2的化学式量=
(3)
Ca(OH)2
的化学式量=
练习
1
(相对原子质量:Cl-35.5
C-12
O-16
Ca-40)
(4)
NH4NO3的化学式量=
14×2+1×4+16×3=80
H2O
你认为在一个水分子中还存在哪些数量关系
?
交流与讨论
16
1
1
氢原子与氧原子的个数比
氢元素与氧元素的质量比
氢元素(或氧元素)在水中的质量分数
2:1
水中
氢元素的质量
氧元素的质量
:
=氢的相对原子质量×个数:氧的相对原子质量×个数
H2O
(1×2)
(16×1)
:
=1
:
8
1个H2O分子中
2个H2O分子中
H原子的质量
O原子的质量
n个H2O分子中
活动与探究一
:
=(1×2):(16×1)=1:8
(1×2)x
2
:
(16×1)x
2
=1
:
8
(1×2)x
n
(16×1)x
n
:
=1
:
8
解:
H2O中氢元素与氧元素的质量比为:(1×2):(16×1)=2:16=1:8
答:
H2O中氢元素与氧元素的质量比为1:8
化合物中各元素的质量比=
化学式中各原子的相对原子质量×原子个数之比
尿素是一种常用的化肥,化学式是CO(NH2)2
请计算:尿素中各元素的质量比。
=
12:16:28:4
=
3:4:7:1
解:CO(NH2)2中C、O、N、H四种元素的质量比为:
跟踪练习
(12x1):(16x1):(14x2):(1x4)
答:CO(NH2)2中C、O、N、H、四种元素的质量比是3:4:7:1
水中氢元素的质量分数(
%)为:
活动与探究二
1×2
1×2
+16×1
×100%
≈11.1
%
=
氢元素的相对原子质量×氢原子个数
水相对分子质量
×100%
该元素的相对原子质量×该原子的个数
物质的化学式量
×100%
物质中某元素的质量分数(
%)为:
H2O
尿素CO(NH2)2中氮元素的质量分数(P71)
14×2
×100%
≈
46.7%
12
×1+16×1+14×2+1×4
跟踪练习
新盖中盖高钙片
【成份】
碳酸钙、甘露醇、乳糖、淀粉、维生素D、甜橙香精、柠檬酸、阿斯马甜(含苯丙氨酸)、苋菜红
【用法与用量】
每日1次,每次1片,新盖中盖高钙片含食或嚼食
【功效成分及含量】
每片中含:钙500mg、维生素D100IU
【适宜人群】
需要补钙者
【注意事项】新盖中盖高钙片不宜超过推荐量或与同类营养素补充剂同时食用
化学式:
CaCO3
试计算碳酸钙中钙元素的质量分数。
(相对原子质量:C-12
Ca-40
O-16)
化学与生活
36g水(H2O)中含氢元素的质量是多少?
解:氢元素的质量为:
×100%
答:36g
水中含4g碳元素。
=4g
36g×
18
2
=36g×
1×2
+16
×1
1×2
练习:88g二氧化碳(CO2)中含有多少克碳元素?
元素的质量=物质质量×该元素的质量分数
×100%
活动三、一定质量的物质中含某元素的质量
计算多少克水中含氢元素4g?
答:36g水中含硫元素4g。
活动四、已知某元素的质量求物质的质量
解:设水的质量为
X
X
·
1×2
×100%
=4g
X
·
2
18
×100%
X
=
36g
=4g
方法1:
1×2
+16
×1
答:36g水中含氢元素4g。
练习:多少克水中含有32克氧元素?
方法2:
解:水的质量为:
=36g
4g÷
×100%
物质质量=元素质量÷元素的质量分数
1×2
1×2
+16
×1
化学式:NH4HCO3
揭露骗局
=17.7%
解:
NH4HCO3的相对分
子质量为:14+1x5+12+16x3=79
NH4HCO3中氮元素的质
量分数为:
此广告为虚假广告!
一、元素质量比的计算
二、元素质量分数的计算
三、一定质量的物质中含某元素的质量
四、已知某元素的质量求物质的质量
课堂小结
(相对原子质量:Fe-56
O-16)
根据氧化铁的化学式Fe2O3计算:
(1)
Fe2O3的化学式量;
(2)氧化铁中氧元素和铁元素的质量比?
(3)氧化铁中铁元素的质量分数?
(4)80克氧化铁含铁元素多少克?
(5)多少克氧化铁中含有7克氧元素?
当堂检测
思考
某碳酸氢铵(NH4HCO3)产品的含氮量为15%,判断它是纯净物还是混合物。
17.7
%
混合物
1、先求出化学式中该元素的质量分数(B)
2、与题目中的数字(A)相比较,若A
=
B
,是纯净物;若A
<B,是混合物;若A
>
B,是虚假广告。
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
