人教化学选修4第三章 第三节 盐类的水解第2课时 课件 (共21张PPT)
文档属性
| 名称 | 人教化学选修4第三章 第三节 盐类的水解第2课时 课件 (共21张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-06 00:00:00 | ||
图片预览







文档简介
(共21张PPT)
影响盐类水解的因素
(第二课时)
炸油条或油饼时为什么要放明矾与小苏打?
明矾:KAl(SO4)2
小苏打:NaHCO3
【活动与探究】
一:测定浓度均为0.1mol
/
L的盐溶液NaCl、CH3COONa
Na2CO3的pH。
影响盐类水解的因素
二:探究NaHCO3在不同温度下的水解情况
1)向0.1mol/L
NaHCO3溶液中滴加2-3滴酚酞,观察现象;
2)微热后再观察现象,比较有什么不同?
3)冷却后,又有什么现象?
三:探究FeCl3溶液在不同环境溶液中的水解情况
1)将FeCl3溶液微热并观察颜色,再向其中滴入盐酸观察;
2)向FeCl3溶液中加入NaOH溶液,观察现象;
3)向FeCl3溶液中加入Na2CO3
溶液,观察现象。
【活动与探究】
测定下列浓度为0.1mol
/
L的溶液的pH
————
影响盐类水解的因素
[实验分析]:碳酸、醋酸都是
___
酸,相应钠
盐水解呈碱性;:碱性:Na2CO3
___CH3COONa
水解程度:
Na2CO3
___CH3COONa
弱
>
酸性:碳酸_____醋酸
弱于
酸越弱,生成的强碱盐水解程度越大
>
盐溶液
(0.1mol/L)
水解的离子方程式
pH
①
NaCl
②
CH3COONa
③
Na2CO3
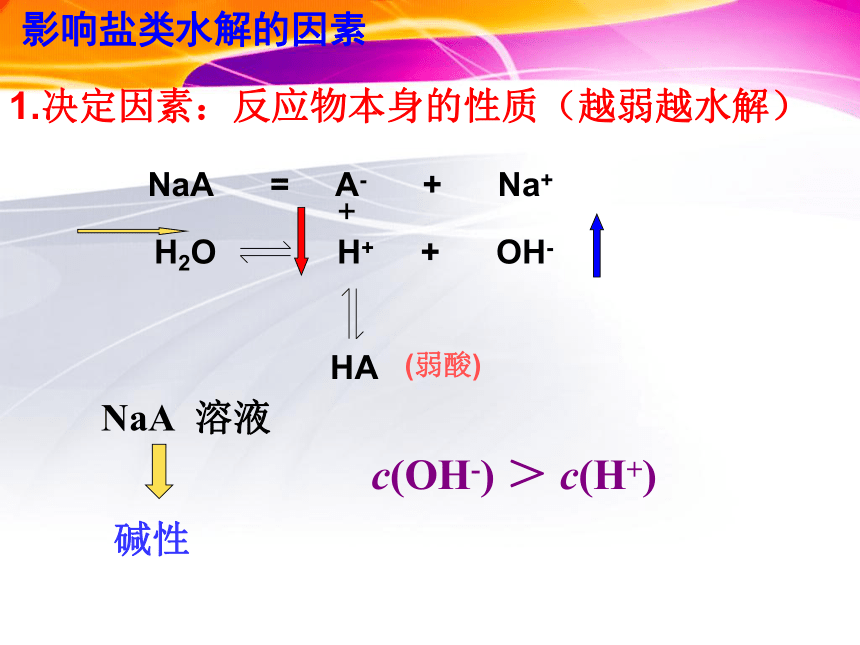
1.决定因素:反应物本身的性质(越弱越水解)
NaA
=
A-
+
Na+
H2O
H+
+
OH-
+
HA
(弱酸)
c(OH-)
>
c(H+)
影响盐类水解的因素
一、影响盐类水解的因素——内因
(盐类水解的本质)
弱
难
强
易
大
强
大
等浓度的强碱弱酸盐溶液
有弱才水解
越弱越水解
常见的弱酸的酸根离子:
CO32-、HCO3-、CH3COO-、S2-、HS-、AlO2-、SiO32-等
常见的弱碱的阳离子:
Mg2+、Al3+、Fe3+、Fe2+、Cu2+、NH4+等
NaClO>CH3COONa>NaNO2
活动与探究
对应强碱盐的碱性
NaClO
CH3COONa
NaNO2
即:pH值大小
HClO
Ka
3.0×10-8
CH3COOH
Ka
1.8×10-5
HNO2
Ka
4.6×10-4
酸性:HClO
CH3COOH
HNO2
>
>
<
<
MgCl2
AlCl3
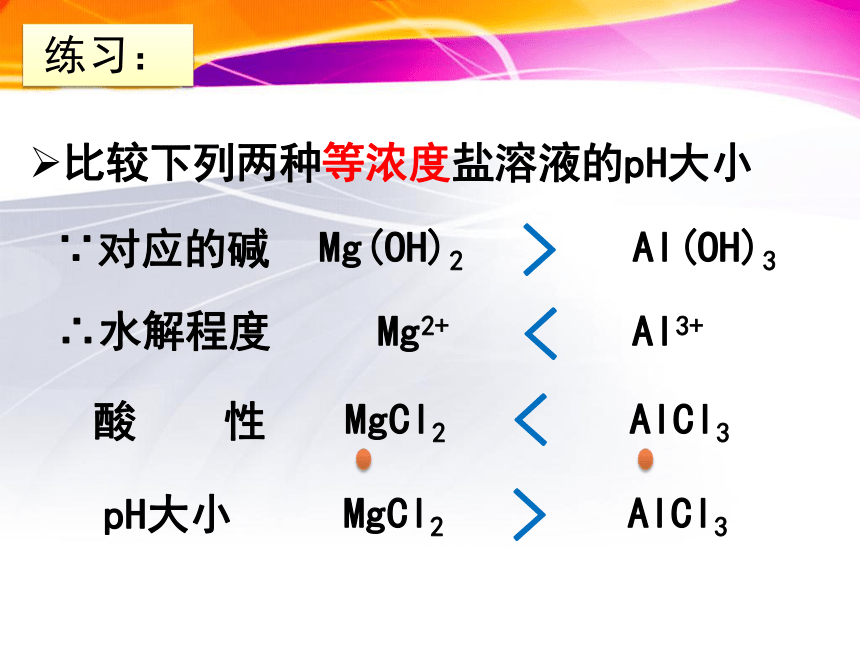
比较下列两种等浓度盐溶液的pH大小
酸
性
<
MgCl2
AlCl3
pH大小
>
∵对应的碱
>
Mg(OH)2
Al(OH)3
练习:
∴水解程度
Mg2+
Al3+
<
二、影响盐类水解的因素——外因
【活动与探究】
Ⅰ.向0.1mol/L
NaHCO3溶液中滴加2-3滴酚酞,观察现象。
Ⅱ.微热后再观察现象,比较有什么不同。
Ⅲ.冷却后,又有什么现象?
加入酚酞,溶液淡红色
加热,溶液变为深红色
冷却后,溶液恢复淡红色
升温促进水解
降温抑制水解
越“热”越水解
在稀FeCl3溶液中
已知存在如下水解平衡,填写下列表格
Fe3++3H2O
?
Fe(OH)3+3H+
(微热后)加稀盐酸
减小
左移
增大
减小
水解呈酸性的盐,加酸抑制水解,加碱促进水解
现象:溶液颜色变浅
二、影响盐类水解的因素——外因
【活动与探究】
[思考]
加入碱会怎样呢?加入盐溶液Na2CO3呢?
水解呈碱性的盐,加碱抑制水解,加酸促进水解
水解呈酸性
条件
平衡移动方向
C(H+)
pH值
Fe3+的水解
程度
现象:都产生红褐色沉淀,且加入碳酸钠溶液后有气泡产生
H++
OH-
﹦
H2O
总:Fe3++
3
OH-
﹦
Fe(OH)3↓
总:2Fe3++
3
CO32-
+3H2O
﹦
2Fe(OH)3↓+3CO2↑
Al3+
+
3HCO3-
=
Al(OH)3
↓+3CO2↑
为了使Na2S溶液中C(Na+)/C(S2-)的比值变小,可加入的物质是
A
适量KOH溶液
B
适量NaOH溶液
C
适量盐酸
D
适量KHS溶液
练习:
0.1
(0.1)
0.1
=0.1K
稀释促进水解
二、影响盐类水解的因素——外因
Qc=
<
K
向右
向右
增大
减小
减小
增大
<
K
、增大浓度抑制水解
K
=
【问题探究】
h----水解度
操作
平衡移动方向
NH4+水解程度
C(H+)
加水稀释为10倍
加NH4Cl固体
小结:影响盐类水解的因素
内因:有弱才水解,越弱越水解
外因:
1、温度:升温促进水解、降温抑制水解
2、酸碱性:水解呈酸性的盐溶液:
加酸抑制水解,加碱促进水解
水解呈碱性的盐溶液:
加碱抑制水解,加酸促进水解
3、浓度:稀释促进水解、增大浓度抑制水解
向右
增大
增大
减小
向右
减小
增大
增大
向右
减小
减小
增大
向右
减小
减小
增大
练习:
向左
增大
增大
减小
改变条件
平衡移动
C(CH3COO-)
C(OH-)
水解程度
加NaOH(s)
升温
加水
加NH4Cl(s)
加CH3COONa(s)
对于水解平衡
棕黄色变深
棕黄色变浅
棕黄色变浅
棕黄色变深,冒气泡,可能产生红褐色沉淀。
棕黄色变深,冒气泡,产生红褐色沉淀。
棕黄色变深
产生红褐色沉淀
改变条件
移动方向
n(H+)
pH
水解程度
现象
升温
通HCl(g)
加H2O
加Mg粉
加NaHCO3
加NaClO
加NaOH
盐类水解
的应用
泡沫灭火器的原理
塑料内筒装有Al2(SO4)3溶液
外筒装有NaHCO3溶液
Al
3+
+
3HCO3–
Al(OH)3
+
3CO2
混合前
混合后
农村俗语:“灰混粪,粪混灰,灰粪相混损肥分。”你知道肥分损失的原因吗?
草木灰的成分:K2CO3
铵态氮肥——铵盐
水解呈碱性
水解呈酸性
影响盐类水解的因素
(第二课时)
炸油条或油饼时为什么要放明矾与小苏打?
明矾:KAl(SO4)2
小苏打:NaHCO3
【活动与探究】
一:测定浓度均为0.1mol
/
L的盐溶液NaCl、CH3COONa
Na2CO3的pH。
影响盐类水解的因素
二:探究NaHCO3在不同温度下的水解情况
1)向0.1mol/L
NaHCO3溶液中滴加2-3滴酚酞,观察现象;
2)微热后再观察现象,比较有什么不同?
3)冷却后,又有什么现象?
三:探究FeCl3溶液在不同环境溶液中的水解情况
1)将FeCl3溶液微热并观察颜色,再向其中滴入盐酸观察;
2)向FeCl3溶液中加入NaOH溶液,观察现象;
3)向FeCl3溶液中加入Na2CO3
溶液,观察现象。
【活动与探究】
测定下列浓度为0.1mol
/
L的溶液的pH
————
影响盐类水解的因素
[实验分析]:碳酸、醋酸都是
___
酸,相应钠
盐水解呈碱性;:碱性:Na2CO3
___CH3COONa
水解程度:
Na2CO3
___CH3COONa
弱
>
酸性:碳酸_____醋酸
弱于
酸越弱,生成的强碱盐水解程度越大
>
盐溶液
(0.1mol/L)
水解的离子方程式
pH
①
NaCl
②
CH3COONa
③
Na2CO3
1.决定因素:反应物本身的性质(越弱越水解)
NaA
=
A-
+
Na+
H2O
H+
+
OH-
+
HA
(弱酸)
c(OH-)
>
c(H+)
影响盐类水解的因素
一、影响盐类水解的因素——内因
(盐类水解的本质)
弱
难
强
易
大
强
大
等浓度的强碱弱酸盐溶液
有弱才水解
越弱越水解
常见的弱酸的酸根离子:
CO32-、HCO3-、CH3COO-、S2-、HS-、AlO2-、SiO32-等
常见的弱碱的阳离子:
Mg2+、Al3+、Fe3+、Fe2+、Cu2+、NH4+等
NaClO>CH3COONa>NaNO2
活动与探究
对应强碱盐的碱性
NaClO
CH3COONa
NaNO2
即:pH值大小
HClO
Ka
3.0×10-8
CH3COOH
Ka
1.8×10-5
HNO2
Ka
4.6×10-4
酸性:HClO
CH3COOH
HNO2
>
>
<
<
MgCl2
AlCl3
比较下列两种等浓度盐溶液的pH大小
酸
性
<
MgCl2
AlCl3
pH大小
>
∵对应的碱
>
Mg(OH)2
Al(OH)3
练习:
∴水解程度
Mg2+
Al3+
<
二、影响盐类水解的因素——外因
【活动与探究】
Ⅰ.向0.1mol/L
NaHCO3溶液中滴加2-3滴酚酞,观察现象。
Ⅱ.微热后再观察现象,比较有什么不同。
Ⅲ.冷却后,又有什么现象?
加入酚酞,溶液淡红色
加热,溶液变为深红色
冷却后,溶液恢复淡红色
升温促进水解
降温抑制水解
越“热”越水解
在稀FeCl3溶液中
已知存在如下水解平衡,填写下列表格
Fe3++3H2O
?
Fe(OH)3+3H+
(微热后)加稀盐酸
减小
左移
增大
减小
水解呈酸性的盐,加酸抑制水解,加碱促进水解
现象:溶液颜色变浅
二、影响盐类水解的因素——外因
【活动与探究】
[思考]
加入碱会怎样呢?加入盐溶液Na2CO3呢?
水解呈碱性的盐,加碱抑制水解,加酸促进水解
水解呈酸性
条件
平衡移动方向
C(H+)
pH值
Fe3+的水解
程度
现象:都产生红褐色沉淀,且加入碳酸钠溶液后有气泡产生
H++
OH-
﹦
H2O
总:Fe3++
3
OH-
﹦
Fe(OH)3↓
总:2Fe3++
3
CO32-
+3H2O
﹦
2Fe(OH)3↓+3CO2↑
Al3+
+
3HCO3-
=
Al(OH)3
↓+3CO2↑
为了使Na2S溶液中C(Na+)/C(S2-)的比值变小,可加入的物质是
A
适量KOH溶液
B
适量NaOH溶液
C
适量盐酸
D
适量KHS溶液
练习:
0.1
(0.1)
0.1
=0.1K
稀释促进水解
二、影响盐类水解的因素——外因
Qc=
<
K
向右
向右
增大
减小
减小
增大
<
K
、增大浓度抑制水解
K
=
【问题探究】
h----水解度
操作
平衡移动方向
NH4+水解程度
C(H+)
加水稀释为10倍
加NH4Cl固体
小结:影响盐类水解的因素
内因:有弱才水解,越弱越水解
外因:
1、温度:升温促进水解、降温抑制水解
2、酸碱性:水解呈酸性的盐溶液:
加酸抑制水解,加碱促进水解
水解呈碱性的盐溶液:
加碱抑制水解,加酸促进水解
3、浓度:稀释促进水解、增大浓度抑制水解
向右
增大
增大
减小
向右
减小
增大
增大
向右
减小
减小
增大
向右
减小
减小
增大
练习:
向左
增大
增大
减小
改变条件
平衡移动
C(CH3COO-)
C(OH-)
水解程度
加NaOH(s)
升温
加水
加NH4Cl(s)
加CH3COONa(s)
对于水解平衡
棕黄色变深
棕黄色变浅
棕黄色变浅
棕黄色变深,冒气泡,可能产生红褐色沉淀。
棕黄色变深,冒气泡,产生红褐色沉淀。
棕黄色变深
产生红褐色沉淀
改变条件
移动方向
n(H+)
pH
水解程度
现象
升温
通HCl(g)
加H2O
加Mg粉
加NaHCO3
加NaClO
加NaOH
盐类水解
的应用
泡沫灭火器的原理
塑料内筒装有Al2(SO4)3溶液
外筒装有NaHCO3溶液
Al
3+
+
3HCO3–
Al(OH)3
+
3CO2
混合前
混合后
农村俗语:“灰混粪,粪混灰,灰粪相混损肥分。”你知道肥分损失的原因吗?
草木灰的成分:K2CO3
铵态氮肥——铵盐
水解呈碱性
水解呈酸性
