人教化学选修4第三章第一节 弱电解质的电离 课件 (共18张PPT)
文档属性
| 名称 | 人教化学选修4第三章第一节 弱电解质的电离 课件 (共18张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-06 09:08:31 | ||
图片预览






文档简介
(共18张PPT)
第三章
第一节
弱电解质的电离
高二化学
学习目标
了解弱电解质平衡的建立过程;
会分析电离平衡的移动。
1.弱电解质的电离过程
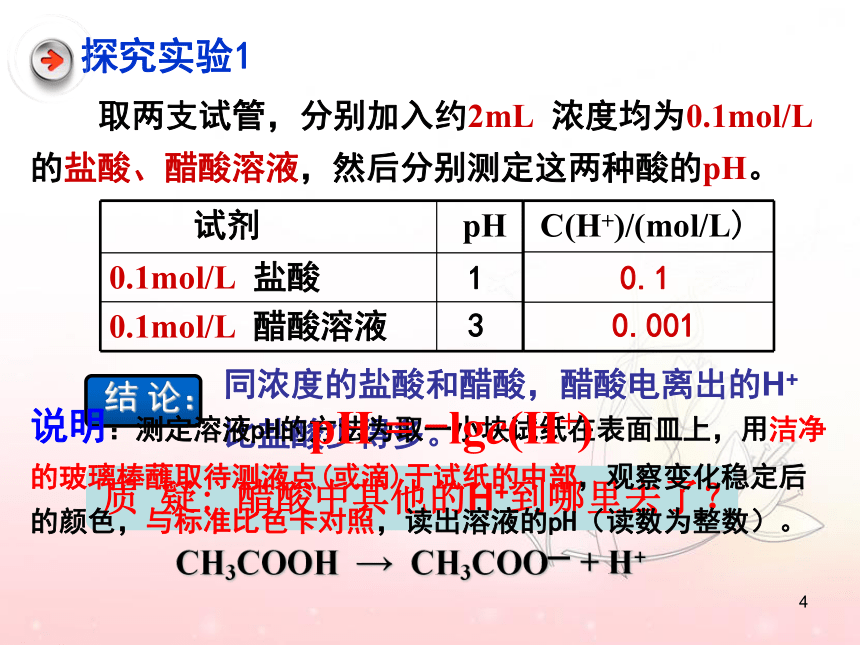
取两支试管,分别加入约2mL
浓度均为0.1mol/L
的盐酸、醋酸溶液,然后分别测定这两种酸的pH。
1
3
0.1
0.001
探究实验1
说明:测定溶液pH的方法为取一小块试纸在表面皿上,用洁净
的玻璃棒蘸取待测液点(或滴)于试纸的中部,观察变化稳定后
的颜色,与标准比色卡对照,读出溶液的pH(读数为整数)。
pH
=
-lgc(H+)
试剂
pH
0.1mol/L
盐酸
0.1mol/L
醋酸溶液
C(H+)/(mol/L)
那么,溶液中是否存在H+
和
CH3COO-离
子结合成CH3COOH的过程呢?
CH3COOH
→
H+
+
CH3COO-
醋酸溶于水时,醋酸分子在水溶液中发生了部分电离:
深入探讨
探究实验2
取两支试管,先分别加入约2mL
0.1mol/L的盐酸,
再往其中一支试管中加入少量CH3COONa晶体,然后
往两支试管中分别加入镁条,观察反应的快慢程度。
反应速度快
反应速度慢
中加入醋酸钠
(H+
Cl—)
(CH3COO—
Na+
)
H+
CH3COO—
分析:
盐酸
讨论:
为什么这两个反应的反应速度不同?根本原因是什么?
试剂
与镁条反应速度的比较
0.1mol/L盐酸
0.1mol/L盐酸加入CH3COONa后
1.弱电解质的电离过程(以醋酸在水溶液中的电离为例)
CH3COO—
+
H+
→
CH3COOH
CH3COOH
→
CH3COO—
+
H+
分
析:
时间t
反应速率
弱电解质分子
电离成离子的速率
离子结合成弱
电解质分子的速率
t0
t1
电离
结合
最大
最大
最小
最小
逐渐减小
逐渐增大
减小
增大
不变
不变
t0~t1
t0
>t1
时间
c(CH3COOH)
c(CH3COO—)和c(H+)
(电离)
(结合)
2.电离平衡
1.弱电解质的电离过程
弱电解质在水溶液中的电离是一个可逆过程。
(2)特征:
①逆:
②等:
③动:
④定:
⑤变:
弱电解质的电离是可逆的
电离平衡是一种动态平衡
溶液中各分子、离子的浓度不变
条件改变时,电离平衡发生移动
1、在醋酸溶液中,CH3COOH的电离达到平衡状态的标志是(
)
溶液呈电中性
B.
溶液中无醋酸分子
C.
氢离子的浓度恒定不变
D.
c(H+)=c(CH3COO-)
(3)外界条件对电离平衡的影响:
例:
CH3COOH
H+
+
CH3COO-
实验探究:温度对电离平衡的影响
实验方案
3:
取一支试管,加入2mL0.1mol/L的CH3COOH,测其pH,然后放在酒精灯上加热并测其pH。
◎实验分析与结论:
1、升温,醋酸电离平衡右移
越热越电离
数据与分析
实验结论
升温,
醋酸pH下降
正向移动
增大
增大
减小
逆向移动
增大
减小
增大
正向移动
减小
增大
减小
逆向移动
减小
增大
增大
正向移动
增大
增大
增大
正向移动
减小
减小
减小
增大
减小
增大
增大
减小
减小
练习:外界条件对电离平衡的影响
改变条件C
平衡移动
方向
C(H+)
C(Ac-)
C(HAc)
电离程度
(电离度)
加
热
加
盐
酸
加
NaOH(s)
加CH3COONa(s)
加CH3COOH
加
水
弱电解质的电离平衡
1、概念
2、特征:逆、等、动、定、变
3、外界条件对电离平衡的影响
(1)浓度:
越稀越电离
(2)温度:
越热越电离
(3)其他物质的影响
1.在100
mL
0.1
mol/L的醋酸溶液中,欲使醋酸的电离程度增大,H+浓度减小,可采用的方法是( )
A.加热
B.加入100
mL
0.1
mol/L的醋酸溶液
C.加入少量的0.5
mol/L的硫酸
D.加入少量的1
mol/L的NaOH溶液
NH3·H2O
NH4
+
+
OH
-
正
逆
逆
正
2
.在氨水中存在怎样的电离平衡?向其中分别加入适量的盐酸、NaOH溶液、NH4Cl溶液以及大量的水,对平衡有什么影响?
加入
物质
盐酸
NaOH
溶液
NH4Cl
溶液
加大量水
平衡移动
方向
第三章
第一节
弱电解质的电离
高二化学
学习目标
了解弱电解质平衡的建立过程;
会分析电离平衡的移动。
1.弱电解质的电离过程
取两支试管,分别加入约2mL
浓度均为0.1mol/L
的盐酸、醋酸溶液,然后分别测定这两种酸的pH。
1
3
0.1
0.001
探究实验1
说明:测定溶液pH的方法为取一小块试纸在表面皿上,用洁净
的玻璃棒蘸取待测液点(或滴)于试纸的中部,观察变化稳定后
的颜色,与标准比色卡对照,读出溶液的pH(读数为整数)。
pH
=
-lgc(H+)
试剂
pH
0.1mol/L
盐酸
0.1mol/L
醋酸溶液
C(H+)/(mol/L)
那么,溶液中是否存在H+
和
CH3COO-离
子结合成CH3COOH的过程呢?
CH3COOH
→
H+
+
CH3COO-
醋酸溶于水时,醋酸分子在水溶液中发生了部分电离:
深入探讨
探究实验2
取两支试管,先分别加入约2mL
0.1mol/L的盐酸,
再往其中一支试管中加入少量CH3COONa晶体,然后
往两支试管中分别加入镁条,观察反应的快慢程度。
反应速度快
反应速度慢
中加入醋酸钠
(H+
Cl—)
(CH3COO—
Na+
)
H+
CH3COO—
分析:
盐酸
讨论:
为什么这两个反应的反应速度不同?根本原因是什么?
试剂
与镁条反应速度的比较
0.1mol/L盐酸
0.1mol/L盐酸加入CH3COONa后
1.弱电解质的电离过程(以醋酸在水溶液中的电离为例)
CH3COO—
+
H+
→
CH3COOH
CH3COOH
→
CH3COO—
+
H+
分
析:
时间t
反应速率
弱电解质分子
电离成离子的速率
离子结合成弱
电解质分子的速率
t0
t1
电离
结合
最大
最大
最小
最小
逐渐减小
逐渐增大
减小
增大
不变
不变
t0~t1
t0
>t1
时间
c(CH3COOH)
c(CH3COO—)和c(H+)
(电离)
(结合)
2.电离平衡
1.弱电解质的电离过程
弱电解质在水溶液中的电离是一个可逆过程。
(2)特征:
①逆:
②等:
③动:
④定:
⑤变:
弱电解质的电离是可逆的
电离平衡是一种动态平衡
溶液中各分子、离子的浓度不变
条件改变时,电离平衡发生移动
1、在醋酸溶液中,CH3COOH的电离达到平衡状态的标志是(
)
溶液呈电中性
B.
溶液中无醋酸分子
C.
氢离子的浓度恒定不变
D.
c(H+)=c(CH3COO-)
(3)外界条件对电离平衡的影响:
例:
CH3COOH
H+
+
CH3COO-
实验探究:温度对电离平衡的影响
实验方案
3:
取一支试管,加入2mL0.1mol/L的CH3COOH,测其pH,然后放在酒精灯上加热并测其pH。
◎实验分析与结论:
1、升温,醋酸电离平衡右移
越热越电离
数据与分析
实验结论
升温,
醋酸pH下降
正向移动
增大
增大
减小
逆向移动
增大
减小
增大
正向移动
减小
增大
减小
逆向移动
减小
增大
增大
正向移动
增大
增大
增大
正向移动
减小
减小
减小
增大
减小
增大
增大
减小
减小
练习:外界条件对电离平衡的影响
改变条件C
平衡移动
方向
C(H+)
C(Ac-)
C(HAc)
电离程度
(电离度)
加
热
加
盐
酸
加
NaOH(s)
加CH3COONa(s)
加CH3COOH
加
水
弱电解质的电离平衡
1、概念
2、特征:逆、等、动、定、变
3、外界条件对电离平衡的影响
(1)浓度:
越稀越电离
(2)温度:
越热越电离
(3)其他物质的影响
1.在100
mL
0.1
mol/L的醋酸溶液中,欲使醋酸的电离程度增大,H+浓度减小,可采用的方法是( )
A.加热
B.加入100
mL
0.1
mol/L的醋酸溶液
C.加入少量的0.5
mol/L的硫酸
D.加入少量的1
mol/L的NaOH溶液
NH3·H2O
NH4
+
+
OH
-
正
逆
逆
正
2
.在氨水中存在怎样的电离平衡?向其中分别加入适量的盐酸、NaOH溶液、NH4Cl溶液以及大量的水,对平衡有什么影响?
加入
物质
盐酸
NaOH
溶液
NH4Cl
溶液
加大量水
平衡移动
方向
