1.5 酸和碱之间发生的反应 习题课件(24张ppt)
文档属性
| 名称 | 1.5 酸和碱之间发生的反应 习题课件(24张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 543.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2020-06-05 00:00:00 | ||
图片预览








文档简介
(共24张PPT)
第5节 酸和碱之间发生的反应
第1章 物质及其变化
第 5 节 酸和碱之间发生的反应
常 考 透 视
第 1 章 物质及其变化
挑 战 自 我
常考透视
常考1 知道酸和碱之间能发生反应,理解酸碱反应的实质。
第 5 节 酸和碱之间发生的反应
【考试热度】 ★★★
例1 如图 1-5-2 是氢氧化钠溶液和盐酸用滴加方式反应时,溶液的 pH 随滴入溶液体积的变化曲线。
(1)氢氧化钠和盐酸恰好完全反应时,溶液的 pH (填“大 于”“小于”或“等于”)7。
等于
第 5 节 酸和碱之间发生的反应
例1 如图 1-5-2 是氢氧化钠溶液和盐酸用滴加方式反应时,溶液的 pH 随滴入溶液体积的变化曲线。
(2)根据曲线判断,该反应是将____________(填“氢氧化钠溶液”或 “盐酸”,下同)滴入______中,理由 是______________________
________________。
(3)当滴入溶液的体积为 5 mL 时,所得溶液中的溶质为_________(填化学式),若在此溶液中滴入石蕊试液,溶液显______色。
氢氧化钠溶液
盐酸
随着滴入溶液体积的增加,溶
NaCl、HCl
红
液的pH 逐渐增大
第 5 节 酸和碱之间发生的反应
解析 从题给曲线分析,起点pH小于7,显酸性,随着滴入溶液体积的增加,溶液的pH逐渐增大,因此是将氢氧化钠溶液滴入盐酸中;当滴入溶液的体积为5 mL时,pH小于7,溶液显酸性,说明盐酸未反应完,所以溶液中的溶质应有反应生成的NaCl和未反应的HCl,此时滴入石蕊试液应显红色。
第 5 节 酸和碱之间发生的反应
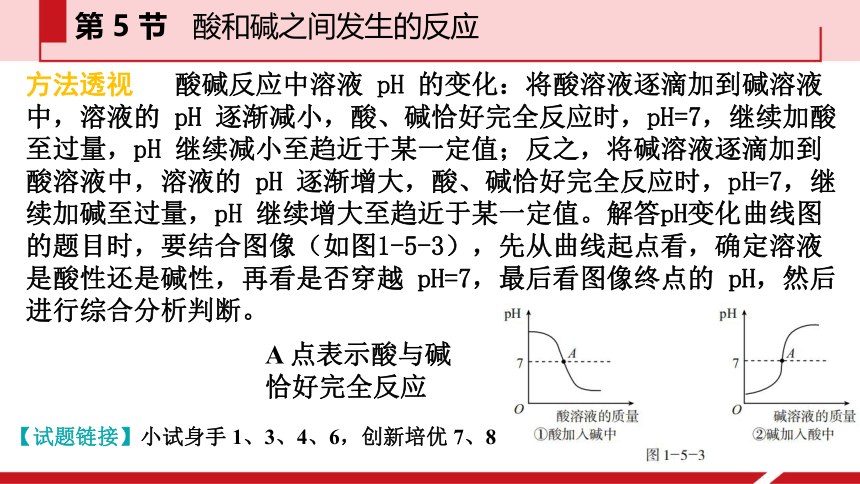
方法透视 酸碱反应中溶液 pH 的变化:将酸溶液逐滴加到碱溶液中,溶液的 pH 逐渐减小,酸、碱恰好完全反应时,pH=7,继续加酸至过量,pH 继续减小至趋近于某一定值;反之,将碱溶液逐滴加到酸溶液中,溶液的 pH 逐渐增大,酸、碱恰好完全反应时,pH=7,继续加碱至过量,pH 继续增大至趋近于某一定值。解答pH变化曲线图的题目时,要结合图像(如图1-5-3),先从曲线起点看,确定溶液是酸性还是碱性,再看是否穿越 pH=7,最后看图像终点的 pH,然后进行综合分析判断。
【试题链接】小试身手 1、3、4、6,创新培优 7、8
A 点表示酸与碱
恰好完全反应
第 5 节 酸和碱之间发生的反应
常考2 了解酸碱反应的一些应用;学习土壤酸碱性的测定方法。
【考试热度】 ★★
例2 下表是一些物质的 pH,对于胃酸过多的人,空腹时较宜食用的物质是( )
A.番茄 B.葡萄 C.牛奶 D.玉米粥
物质 番茄 葡萄 牛奶 玉米粥
pH 4.0 ~ 4.4 3.5 ~ 4.5 6.3 ~ 6.6 6.8 ~ 8.0
D
第 5 节 酸和碱之间发生的反应
方法透视 解题的关键是明确胃酸的成分及酸碱性 , 然后根据酸碱反应的知识进行解答。
【试题链接】 小试身手 2、5
挑战自我
第 5 节 酸和碱之间发生的反应
小试身手
1. 下列反应属于酸碱反应的是( )
A.CuO+H2SO4=CuSO4+H2O
B.CO2+Ca(OH)2=CaCO3↓+H2O
C.2NaOH+H2SO4=Na2SO4+2H2O
D.CaCO3+2HCl=CaCl2+H2O+CO2 ↑
C
第 5 节 酸和碱之间发生的反应
2 .生活中一些常见物质的 pH 如下。下列叙述不正确的是( )
A.酱油显碱性
B.肥皂水可缓解蚊虫叮咬皮肤时分泌蚁酸引起的皮肤痛痒
C.胃酸(主要成分为盐酸)过多患者,不宜多吃橘子
D.草木灰能减弱土壤的酸性
A
解析 酱油的pH小于7,显酸性;肥皂水显碱性,可与蚁酸反应;橘子显
酸性,故胃酸过多患者不宜多吃;草木灰显碱性,能减弱土壤的酸性。
第 5 节 酸和碱之间发生的反应
3. 某实验小组在探究盐酸和氢氧化钠溶液反应过程中溶液 pH 的变化规律时,得到如图1-5-5 所示曲线。下列有关该实验事实的说法正确的是( )
A.该实验是将氢氧化钠溶液滴入盐酸中
B.B 点表示盐酸和氢氧化钠恰好完全反应
C.A 点时的溶液能使酚酞试液变蓝
D.C 点时,溶液中的溶质只有氯化钠
B
第 5 节 酸和碱之间发生的反应
4. 如图 1-5-6 是盐酸滴入氢氧化钠溶液中有关粒子之间反应的示意图。下列说法错误的是( )
A.盐酸中含有氢离子和氯离子
B.氢氧化钠溶液中含有钠离子和氢氧根离子
C.两溶液混合时,氢离子与氢氧根离子结合生成水分子
D.两溶液混合时,钠离子与氯离子结合生成氯化钠分子
D
第 5 节 酸和碱之间发生的反应
5. 如图 1-5-7 是一种医用药品瓶上的标签,试根据标签上的内容 回答有关问题。
图 1-5-7
(1)请叙述“咀嚼后咽下”的好处:__________________________
______________________________________________。
(2)当胃酸(主要成分为盐酸)过多时,服用该药片后,在胃中
可能发生的化学反应为(用化学方程式表示)
① ________________________________;
②_________________________________。
主要成分:碳酸镁、氢氧化铝(大片状)
主治:胃痛、反酸、烧心等胃部不适症 用法:咀嚼后咽下
胃酸的反应快;或反应物的接触面积增大,化学反应速率加快)
MgCO3+2HCl===MgCl2+CO2↑+H2O
Al(OH)3+3HCl===AlCl3+3H2O
嚼碎后服用疗效快(或嚼碎后药物与
第 5 节 酸和碱之间发生的反应
5. 如图 1-5-7 是一种医用药品瓶上的标签,试根据标签上的内容 回答有关问题。
图 1-5-7
(3)患有胃溃疡(胃黏膜溃烂)的病人胃酸过多时,不宜服用含碳酸盐的抗酸药,其原因是__________________________________
__________。
主要成分:碳酸镁、氢氧化铝(大片状)
主治:胃痛、反酸、烧心等胃部不适症 用法:咀嚼后咽下
碳酸盐与盐酸作用生成二氧化碳气体, 会加重
胃溃疡病情
第 5 节 酸和碱之间发生的反应
6. 向盛有 10 mL NaOH 溶液(其中滴有少量无色酚酞试液)的烧杯中逐滴加入稀盐酸,用pH 计(用来精确测定溶液 pH 的仪器)测定溶液的 pH,所得数据如下表:
(1)当加入稀盐酸的体积为 mL 时,NaOH 溶液和稀盐
酸恰好完全反应。
10
解析 (1)pH=7时,氢氧化钠和稀盐酸恰好完全反应,由表格数据可知,此时消耗的稀盐酸的体积为10 mL。
第 5 节 酸和碱之间发生的反应
6. 向盛有 10 mL NaOH 溶液(其中滴有少量无色酚酞试液)的烧杯中逐滴加入稀盐酸,用pH 计(用来精确测定溶液 pH 的仪器)测定溶液的 pH,所得数据如下表:
(2)当加入稀盐酸的体积为 3 mL 时,溶液显 色;当加
入稀盐酸的体积为14 mL 时,溶液显 色。
红
无
第 5 节 酸和碱之间发生的反应
解析 (2)无色酚酞试液遇碱性溶液变红,遇酸性和中性溶液不变色;当加入稀盐酸的体积为3 mL时,烧杯中溶液的pH大于7,溶液显碱性,使无色酚酞试液变红;当加入稀盐酸的体积为14 mL时,烧杯中溶液的pH小于7,溶液显酸性,无色酚酞试液不变色。
第 5 节 酸和碱之间发生的反应
6. 向盛有 10 mL NaOH 溶液(其中滴有少量无色酚酞试液)的烧杯中逐滴加入稀盐酸,用pH 计(用来精确测定溶液 pH 的仪器)测定溶液的 pH,所得数据如下表:
(3)当烧杯中溶液的 pH=2.1 时,溶液中的溶质有 (填化学式)。
NaCl、HCl
解析 (3)当pH=2.1时,稀盐酸过量,此时溶液中的溶质既有生成的氯
化钠,又有未反应的氯化氢。
第 5 节 酸和碱之间发生的反应
7. 氢氧化钠与硫酸的反应无明显现象,某科学兴趣小组为证明氢氧化钠与硫酸发生了化学反应,进行了如下实验探究。
[ 实验探究 ] 小倩在试管中加入约 2 mL 稀氢氧化钠溶液,滴入 2 滴酚酞试液,振荡,溶液变为红色。然后向该试管中倒入稀硫酸,观察到溶液由红色变为无色,证明氢氧化钠与硫酸发生了反应,该反应的化学方程式为 。
[ 改进实验 ] 小娜使用与小倩相同的试剂,通过改进上述实验中某一步的操作方法,不但证明氢氧化钠与硫酸发生了反应,还能验证二者恰好完全反应,小娜改进的实验操作中关键的一点是
。
2NaOH+H2SO4===Na2SO4+2H2O
将“稀硫酸倒入氢氧化钠溶液中”改为“逐滴加入稀硫酸至红色恰好完全消失”
第 5 节 酸和碱之间发生的反应
[反思评价] 小霞提出也可以使用紫色石蕊试液代替无色酚酞试液进行上述实验。你认为 (填“酚酞试液”或“石蕊试液”)更适合用于验证二者恰好完全反应,你的理由是 。
酚酞试液
溶液颜色的改变明显,便于观察实验
第 5 节 酸和碱之间发生的反应
8. 用已知溶质质量分数的溶液可以测定未知溶液的溶质质量分数。实验室有一瓶标签模糊的稀盐酸,某同学为了测定其溶质质量分数,进行了如下实验:
①取一洁净的锥形瓶称量,然后往其中加入一定量的稀盐酸,并滴入几滴紫色石蕊试液(质量忽略不计),重新称量;
②往上述锥形瓶中逐滴加入溶质质量分数为16%的氢氧化钠溶液,边滴加边振荡,当观察到溶液由红色恰好变为紫色时,停止滴加,再次称量。数据如下表:
锥形瓶 锥形瓶+稀盐酸 锥形瓶+反应后溶液
质量/g 35.5 55.5 80.5
第 5 节 酸和碱之间发生的反应
(1)若要配制 500 g 16%的氢氧化钠溶液,需要氢氧化钠固
体 g。
80
解析(1)需要氢氧化钠固体的质量为500 g×16%=80 g。
第 5 节 酸和碱之间发生的反应
(2)本次实验中,实际消耗的氢氧化钠溶液的质量为 g。
25
解析 (2)反应所消耗的氢氢化钠溶液的质量为80.5 g-55.5 g=25 g。
第 5 节 酸和碱之间发生的反应
(3)请通过计算确定该瓶稀盐酸的溶质质量分数。
解:设该反应消耗HCl的质量为x。
HCl+NaOH===NaCl+H2O
36.5 40
x 25 g×16%
36.5 x .
40 = 25 g×16%
x=3.65 g
稀盐酸的溶质质量分数=×100%=18.25%。
答:该瓶稀盐酸的溶质质量分数为18.25%。
第5节 酸和碱之间发生的反应
第1章 物质及其变化
第 5 节 酸和碱之间发生的反应
常 考 透 视
第 1 章 物质及其变化
挑 战 自 我
常考透视
常考1 知道酸和碱之间能发生反应,理解酸碱反应的实质。
第 5 节 酸和碱之间发生的反应
【考试热度】 ★★★
例1 如图 1-5-2 是氢氧化钠溶液和盐酸用滴加方式反应时,溶液的 pH 随滴入溶液体积的变化曲线。
(1)氢氧化钠和盐酸恰好完全反应时,溶液的 pH (填“大 于”“小于”或“等于”)7。
等于
第 5 节 酸和碱之间发生的反应
例1 如图 1-5-2 是氢氧化钠溶液和盐酸用滴加方式反应时,溶液的 pH 随滴入溶液体积的变化曲线。
(2)根据曲线判断,该反应是将____________(填“氢氧化钠溶液”或 “盐酸”,下同)滴入______中,理由 是______________________
________________。
(3)当滴入溶液的体积为 5 mL 时,所得溶液中的溶质为_________(填化学式),若在此溶液中滴入石蕊试液,溶液显______色。
氢氧化钠溶液
盐酸
随着滴入溶液体积的增加,溶
NaCl、HCl
红
液的pH 逐渐增大
第 5 节 酸和碱之间发生的反应
解析 从题给曲线分析,起点pH小于7,显酸性,随着滴入溶液体积的增加,溶液的pH逐渐增大,因此是将氢氧化钠溶液滴入盐酸中;当滴入溶液的体积为5 mL时,pH小于7,溶液显酸性,说明盐酸未反应完,所以溶液中的溶质应有反应生成的NaCl和未反应的HCl,此时滴入石蕊试液应显红色。
第 5 节 酸和碱之间发生的反应
方法透视 酸碱反应中溶液 pH 的变化:将酸溶液逐滴加到碱溶液中,溶液的 pH 逐渐减小,酸、碱恰好完全反应时,pH=7,继续加酸至过量,pH 继续减小至趋近于某一定值;反之,将碱溶液逐滴加到酸溶液中,溶液的 pH 逐渐增大,酸、碱恰好完全反应时,pH=7,继续加碱至过量,pH 继续增大至趋近于某一定值。解答pH变化曲线图的题目时,要结合图像(如图1-5-3),先从曲线起点看,确定溶液是酸性还是碱性,再看是否穿越 pH=7,最后看图像终点的 pH,然后进行综合分析判断。
【试题链接】小试身手 1、3、4、6,创新培优 7、8
A 点表示酸与碱
恰好完全反应
第 5 节 酸和碱之间发生的反应
常考2 了解酸碱反应的一些应用;学习土壤酸碱性的测定方法。
【考试热度】 ★★
例2 下表是一些物质的 pH,对于胃酸过多的人,空腹时较宜食用的物质是( )
A.番茄 B.葡萄 C.牛奶 D.玉米粥
物质 番茄 葡萄 牛奶 玉米粥
pH 4.0 ~ 4.4 3.5 ~ 4.5 6.3 ~ 6.6 6.8 ~ 8.0
D
第 5 节 酸和碱之间发生的反应
方法透视 解题的关键是明确胃酸的成分及酸碱性 , 然后根据酸碱反应的知识进行解答。
【试题链接】 小试身手 2、5
挑战自我
第 5 节 酸和碱之间发生的反应
小试身手
1. 下列反应属于酸碱反应的是( )
A.CuO+H2SO4=CuSO4+H2O
B.CO2+Ca(OH)2=CaCO3↓+H2O
C.2NaOH+H2SO4=Na2SO4+2H2O
D.CaCO3+2HCl=CaCl2+H2O+CO2 ↑
C
第 5 节 酸和碱之间发生的反应
2 .生活中一些常见物质的 pH 如下。下列叙述不正确的是( )
A.酱油显碱性
B.肥皂水可缓解蚊虫叮咬皮肤时分泌蚁酸引起的皮肤痛痒
C.胃酸(主要成分为盐酸)过多患者,不宜多吃橘子
D.草木灰能减弱土壤的酸性
A
解析 酱油的pH小于7,显酸性;肥皂水显碱性,可与蚁酸反应;橘子显
酸性,故胃酸过多患者不宜多吃;草木灰显碱性,能减弱土壤的酸性。
第 5 节 酸和碱之间发生的反应
3. 某实验小组在探究盐酸和氢氧化钠溶液反应过程中溶液 pH 的变化规律时,得到如图1-5-5 所示曲线。下列有关该实验事实的说法正确的是( )
A.该实验是将氢氧化钠溶液滴入盐酸中
B.B 点表示盐酸和氢氧化钠恰好完全反应
C.A 点时的溶液能使酚酞试液变蓝
D.C 点时,溶液中的溶质只有氯化钠
B
第 5 节 酸和碱之间发生的反应
4. 如图 1-5-6 是盐酸滴入氢氧化钠溶液中有关粒子之间反应的示意图。下列说法错误的是( )
A.盐酸中含有氢离子和氯离子
B.氢氧化钠溶液中含有钠离子和氢氧根离子
C.两溶液混合时,氢离子与氢氧根离子结合生成水分子
D.两溶液混合时,钠离子与氯离子结合生成氯化钠分子
D
第 5 节 酸和碱之间发生的反应
5. 如图 1-5-7 是一种医用药品瓶上的标签,试根据标签上的内容 回答有关问题。
图 1-5-7
(1)请叙述“咀嚼后咽下”的好处:__________________________
______________________________________________。
(2)当胃酸(主要成分为盐酸)过多时,服用该药片后,在胃中
可能发生的化学反应为(用化学方程式表示)
① ________________________________;
②_________________________________。
主要成分:碳酸镁、氢氧化铝(大片状)
主治:胃痛、反酸、烧心等胃部不适症 用法:咀嚼后咽下
胃酸的反应快;或反应物的接触面积增大,化学反应速率加快)
MgCO3+2HCl===MgCl2+CO2↑+H2O
Al(OH)3+3HCl===AlCl3+3H2O
嚼碎后服用疗效快(或嚼碎后药物与
第 5 节 酸和碱之间发生的反应
5. 如图 1-5-7 是一种医用药品瓶上的标签,试根据标签上的内容 回答有关问题。
图 1-5-7
(3)患有胃溃疡(胃黏膜溃烂)的病人胃酸过多时,不宜服用含碳酸盐的抗酸药,其原因是__________________________________
__________。
主要成分:碳酸镁、氢氧化铝(大片状)
主治:胃痛、反酸、烧心等胃部不适症 用法:咀嚼后咽下
碳酸盐与盐酸作用生成二氧化碳气体, 会加重
胃溃疡病情
第 5 节 酸和碱之间发生的反应
6. 向盛有 10 mL NaOH 溶液(其中滴有少量无色酚酞试液)的烧杯中逐滴加入稀盐酸,用pH 计(用来精确测定溶液 pH 的仪器)测定溶液的 pH,所得数据如下表:
(1)当加入稀盐酸的体积为 mL 时,NaOH 溶液和稀盐
酸恰好完全反应。
10
解析 (1)pH=7时,氢氧化钠和稀盐酸恰好完全反应,由表格数据可知,此时消耗的稀盐酸的体积为10 mL。
第 5 节 酸和碱之间发生的反应
6. 向盛有 10 mL NaOH 溶液(其中滴有少量无色酚酞试液)的烧杯中逐滴加入稀盐酸,用pH 计(用来精确测定溶液 pH 的仪器)测定溶液的 pH,所得数据如下表:
(2)当加入稀盐酸的体积为 3 mL 时,溶液显 色;当加
入稀盐酸的体积为14 mL 时,溶液显 色。
红
无
第 5 节 酸和碱之间发生的反应
解析 (2)无色酚酞试液遇碱性溶液变红,遇酸性和中性溶液不变色;当加入稀盐酸的体积为3 mL时,烧杯中溶液的pH大于7,溶液显碱性,使无色酚酞试液变红;当加入稀盐酸的体积为14 mL时,烧杯中溶液的pH小于7,溶液显酸性,无色酚酞试液不变色。
第 5 节 酸和碱之间发生的反应
6. 向盛有 10 mL NaOH 溶液(其中滴有少量无色酚酞试液)的烧杯中逐滴加入稀盐酸,用pH 计(用来精确测定溶液 pH 的仪器)测定溶液的 pH,所得数据如下表:
(3)当烧杯中溶液的 pH=2.1 时,溶液中的溶质有 (填化学式)。
NaCl、HCl
解析 (3)当pH=2.1时,稀盐酸过量,此时溶液中的溶质既有生成的氯
化钠,又有未反应的氯化氢。
第 5 节 酸和碱之间发生的反应
7. 氢氧化钠与硫酸的反应无明显现象,某科学兴趣小组为证明氢氧化钠与硫酸发生了化学反应,进行了如下实验探究。
[ 实验探究 ] 小倩在试管中加入约 2 mL 稀氢氧化钠溶液,滴入 2 滴酚酞试液,振荡,溶液变为红色。然后向该试管中倒入稀硫酸,观察到溶液由红色变为无色,证明氢氧化钠与硫酸发生了反应,该反应的化学方程式为 。
[ 改进实验 ] 小娜使用与小倩相同的试剂,通过改进上述实验中某一步的操作方法,不但证明氢氧化钠与硫酸发生了反应,还能验证二者恰好完全反应,小娜改进的实验操作中关键的一点是
。
2NaOH+H2SO4===Na2SO4+2H2O
将“稀硫酸倒入氢氧化钠溶液中”改为“逐滴加入稀硫酸至红色恰好完全消失”
第 5 节 酸和碱之间发生的反应
[反思评价] 小霞提出也可以使用紫色石蕊试液代替无色酚酞试液进行上述实验。你认为 (填“酚酞试液”或“石蕊试液”)更适合用于验证二者恰好完全反应,你的理由是 。
酚酞试液
溶液颜色的改变明显,便于观察实验
第 5 节 酸和碱之间发生的反应
8. 用已知溶质质量分数的溶液可以测定未知溶液的溶质质量分数。实验室有一瓶标签模糊的稀盐酸,某同学为了测定其溶质质量分数,进行了如下实验:
①取一洁净的锥形瓶称量,然后往其中加入一定量的稀盐酸,并滴入几滴紫色石蕊试液(质量忽略不计),重新称量;
②往上述锥形瓶中逐滴加入溶质质量分数为16%的氢氧化钠溶液,边滴加边振荡,当观察到溶液由红色恰好变为紫色时,停止滴加,再次称量。数据如下表:
锥形瓶 锥形瓶+稀盐酸 锥形瓶+反应后溶液
质量/g 35.5 55.5 80.5
第 5 节 酸和碱之间发生的反应
(1)若要配制 500 g 16%的氢氧化钠溶液,需要氢氧化钠固
体 g。
80
解析(1)需要氢氧化钠固体的质量为500 g×16%=80 g。
第 5 节 酸和碱之间发生的反应
(2)本次实验中,实际消耗的氢氧化钠溶液的质量为 g。
25
解析 (2)反应所消耗的氢氢化钠溶液的质量为80.5 g-55.5 g=25 g。
第 5 节 酸和碱之间发生的反应
(3)请通过计算确定该瓶稀盐酸的溶质质量分数。
解:设该反应消耗HCl的质量为x。
HCl+NaOH===NaCl+H2O
36.5 40
x 25 g×16%
36.5 x .
40 = 25 g×16%
x=3.65 g
稀盐酸的溶质质量分数=×100%=18.25%。
答:该瓶稀盐酸的溶质质量分数为18.25%。
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
