苏教版高中化学必修二 2.2.1化学反应中的热量变化(第1课时) (共27张PPT)
文档属性
| 名称 | 苏教版高中化学必修二 2.2.1化学反应中的热量变化(第1课时) (共27张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 620.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-06 16:40:50 | ||
图片预览







文档简介
(共27张PPT)
专题2
化学反应与能量转化
2020年4月20日
第二单元
化学反应中的热量
第1课时
化学反应中的热量变化
暖宝宝发热材料主要由:铁粉、活性碳、蛭石、水、盐等材料构成。
蛭石是一种铁镁质铝硅酸盐矿物,因加热时能迅速膨胀,弯曲呈水蛭(蚂蟥)状而得名。
实验1
向一支试管中放入光亮的镁条,加入大约5mL
2mol/L盐酸,用手触摸试管外壁。
实验2
解开塑料袋上的绳子,使氢氧化钡晶体与氯化铵晶体混合,用手轻轻揉搓,使之充分反应。用手触摸塑料袋。
Mg
+
2HCl
=
MgCl2
+H2
↑
Ba(OH)2.8H2O
+
2NH4Cl
=
BaCl2
+
2NH3↑
+
10H2O
感觉发热
感觉冰凉
反应吸热
反应放热
镁条燃烧
②天然气(主要成分为甲烷)的燃烧
③铝热反应
④高温下木炭与二氧化碳反应生成
一氧化碳。
放热
放热
放热
吸热
放热
放热
吸热
吸热
高温煅烧石灰石
⑥氧化钙与水的反应
⑦水的分解
⑧盐酸与氢氧化钠溶液反应
判断下列反应是放热反应还是吸热反应?
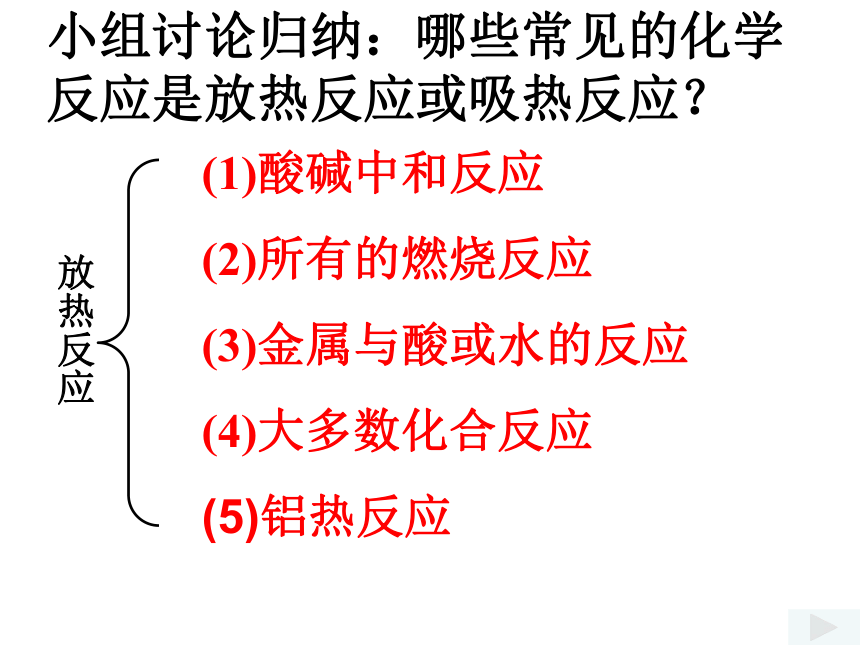
小组讨论归纳:哪些常见的化学反应是放热反应或吸热反应?
(1)酸碱中和反应
(2)所有的燃烧反应
(3)金属与酸或水的反应
(4)大多数化合反应
(5)铝热反应
放热反应
小组讨论归纳:哪些常见的化学反应是放热反应或吸热反应?
吸热反应
有两位同学:
甲说:放热反应不需外界条件相助,都
可以自然发生。
乙说:没有外界条件相助,所有吸热反
应都不能发生。
你认为他们的说法正确吗?请结合实例做简单阐释。
×
×
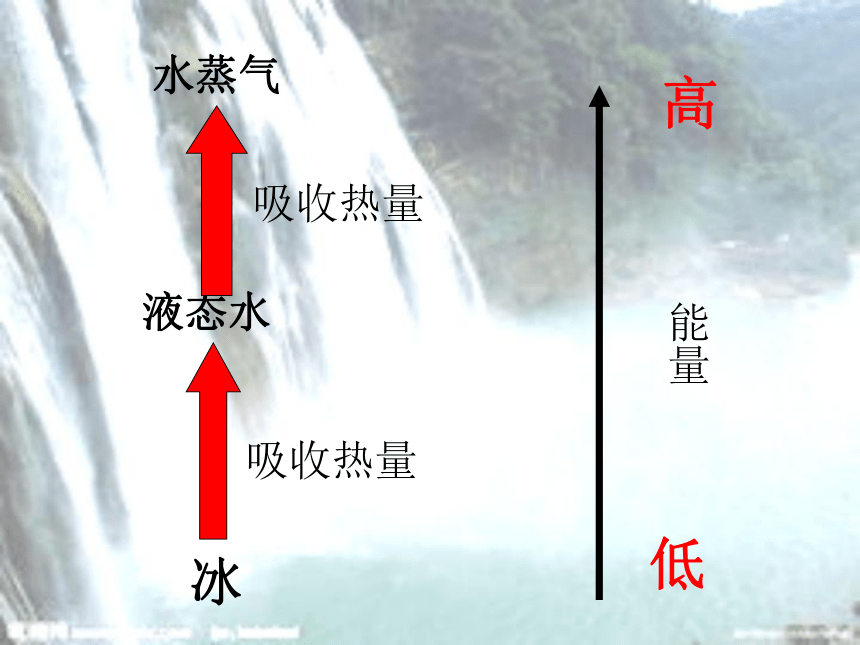
冰
液态水
水蒸气
吸收热量
吸收热量
小组讨论:
从反应物和生成物贮存的能量相对大小的角度试分析:为什么
①Mg
+2HCl
=MgCl2
+H2
↑是放热反应
②Ba(OH)2.8H2O
+
2NH4Cl
=
BaCl2
+
2NH3↑
+
10H2O是吸热反应。
从能量角度分析
反应物的总能量高
生成物的总能量低
放出热量
反应物的总能量
>
生成物的总能量
放热反应
生成物的总能量高
反应物的总能量低
吸热热量
生成物的总能量
>
反应物的总能量
吸热反应
阅读课本P36第一小段文字
请你从化学键断裂与生成角度分析:
H2
+Cl2
=
2HCl
为什么是放热反应?
断开化学键吸收的能量>形成化学键放出的能量
断开化学键吸收能量,形成化学键放出能量
吸热反应:
放热反应:
断开化学键吸收的能量<形成化学键放出的能量
从化学键角度分析
二、热化学方程式
1.定义:表明反应放出或吸收的热量的化学方
程式叫热化学方程式。
如:
C(s)+O2(g)=CO2(g)
△H=-393.6kJ
?mol-1
CaCO3
(s)
=
CaO(s)
+CO2(g)
△H=
+
178.5
kJ/mol
观察与比较
氢气燃烧的化学方程式:
2H2
+
O2
==2H2O
点燃
氢气燃烧的热化学方程式
②
2H2(g)
+
O2(g)
=2H2O(l)
△H
=-571.6
kJ
?mol-
1
③H2(g)
+1/2O2(g)
=H2O(l)
△H
=-285.8
kJ
?mol-
1
①
2H2(g)
+
O2(g)
=2H2O(g)
△H
=-483.6
kJ
?mol-1
④
H2O(l)
=H2(g)
+1/2O2(g)
△H
=+285.8
kJ
?mol-
1
注:气态(g)、液态(l)、固态(s)、溶液(aq)
热化学方程式书写原则
⑴标明物质的状态:气态(g)、液态(l)
固态(s)、溶液(aq),不标↑、↓
⑶
化学计量数可以是整数或分数,
只表示物质的量,不表示微粒个数
(4)
△H
的值与化学计量数成正比。
⑵标明△H的正负及单位(
kJ/mol
),放热反应“-”,吸热反应“+”,不标点燃、△
(5)注明反应时的温度和压强,如不注明则指25℃
、101KPa
3.意义
描述了化学反应中的物质变化和热量变化
①C(s)+O2(g)=CO2(g)
△H=-393.5kJ
?mol-1
物质
热量
②CaCO3
(s)
=
CaO(s)
+
CO2(g)
△H
=
+
178.5
kJ
?mol-
1
【问题解决
】1.
对热化学方程式H2(g)
+
I2(g)
=
2HI(g);△H
=
+52kJ·mol-1的叙述中,正确的是(
)
A.1mol
H2(g)和1mol
I2(g)完全反应一定需
要吸收52kJ热量
B.1个H2和1个I2完全反应生成2个HI需要吸收52kJ热量
C.1mol
H2(g)与1mol
I2(g)完全反应生成2mol
HI(g)放出52kJ热量
D.1mol
H2(g)与1mol
I2(g)完全反应生成2mol
HI(g)吸收52kJ热量
D
【合作解决】
C、CO、CH4完全燃烧的热化学方程式可以分别表示为:
C(s)
+
O2(g)
=
CO2
(g)
△H
=
-
393.6
kJ?mol-
1
2CO(g)
+
O2(g)
=2CO2
(g)
△
H
=
-
565.
2
kJ
?mol-
1
CH4(g)
+
2O2(g)
=
CO2
(g)
+
2H2O(l)
△H
=
-
889.6
kJ
?mol-
①完全燃烧相等物质的量的上述物质,放出热量的大小顺序为_______________
CH4>
C
>
CO
CH4
②完全燃烧相等质量的C(s)和CH4(g),放出热量较多的是____________
自我总结
①化学能转化为热能就是____热反应,热能转化为化学能就是____热反应。
②从_____总能量和_____总能量相对大小及化学键的______和_____角度去理解化学反应中热量变化的原因。
③热化学方程式既体现了
守恒定律,又体现了
守恒定律。
反应物
生成物
断裂
形成
质量
能量
课堂检测
1、下列反应中是吸热反应的是(
)
A.碳酸钙受热分解
B.酒精燃烧
C.铝粉与氧化铁粉末反应
D.氧化钙溶于水
A
2、电视上“自热米饭”的广告播得很火,它介绍在食用时,将一无色液体加入到一白色固体中,放上装米饭的盒子,过几分钟米饭马上就热气腾腾,可以食用了,非常方便。请你推测白色固体和无色液体可能是如下哪个组合( )
A.氯化钠和水
B.浓硫酸和水
C.氧化钙和水
D.固体酒精和水
C
3、有如下3个热化学方程式:
H2(g)+1/2O2(g)
=
H2O(g)
ΔH=akJ·mol-1
H2(g)+1/2O2(g)
=
H2O(l)
ΔH=bkJ·mol-1
2H2(g)+O2(g)
=
2H2O(l)
ΔH=ckJ·mol-1
关于它们的下列表述正确的是(
)
A.
它们都是吸热反应
B.
a、b和c均为正值
C.
a=b
D.
2b=c
D
4、如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中放入几小块镁片,再滴入5mL盐酸于试管中。
试回答下列问题:
(1)实验中观察到的现象是____
(2)产生上述现象的原因是____
(3)写出有关反应的离子方程式_
(4)由实验推知,氯化镁溶液和
氢气的总能量___(填“大于”、“小
于”或“等于”)镁片和盐酸的总能量。
(1)现象是镁片逐渐溶解、有
大量气泡产生、烧杯中有固体析出。
(2)产生上述现象的原因是镁片
和盐酸反应放出氢气,该反应为
放热反应,Ca(OH)2溶解度随温度
升高而减少,析出固体使溶液变
浑浊。
(3)写出有关反应的离子方程式
Mg
+
2H+
=
Mg2+
+H2
↑
(4)由实验推知,氯化镁溶液和氢气的总能量小于(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
谢谢
专题2
化学反应与能量转化
2020年4月20日
第二单元
化学反应中的热量
第1课时
化学反应中的热量变化
暖宝宝发热材料主要由:铁粉、活性碳、蛭石、水、盐等材料构成。
蛭石是一种铁镁质铝硅酸盐矿物,因加热时能迅速膨胀,弯曲呈水蛭(蚂蟥)状而得名。
实验1
向一支试管中放入光亮的镁条,加入大约5mL
2mol/L盐酸,用手触摸试管外壁。
实验2
解开塑料袋上的绳子,使氢氧化钡晶体与氯化铵晶体混合,用手轻轻揉搓,使之充分反应。用手触摸塑料袋。
Mg
+
2HCl
=
MgCl2
+H2
↑
Ba(OH)2.8H2O
+
2NH4Cl
=
BaCl2
+
2NH3↑
+
10H2O
感觉发热
感觉冰凉
反应吸热
反应放热
镁条燃烧
②天然气(主要成分为甲烷)的燃烧
③铝热反应
④高温下木炭与二氧化碳反应生成
一氧化碳。
放热
放热
放热
吸热
放热
放热
吸热
吸热
高温煅烧石灰石
⑥氧化钙与水的反应
⑦水的分解
⑧盐酸与氢氧化钠溶液反应
判断下列反应是放热反应还是吸热反应?
小组讨论归纳:哪些常见的化学反应是放热反应或吸热反应?
(1)酸碱中和反应
(2)所有的燃烧反应
(3)金属与酸或水的反应
(4)大多数化合反应
(5)铝热反应
放热反应
小组讨论归纳:哪些常见的化学反应是放热反应或吸热反应?
吸热反应
有两位同学:
甲说:放热反应不需外界条件相助,都
可以自然发生。
乙说:没有外界条件相助,所有吸热反
应都不能发生。
你认为他们的说法正确吗?请结合实例做简单阐释。
×
×
冰
液态水
水蒸气
吸收热量
吸收热量
小组讨论:
从反应物和生成物贮存的能量相对大小的角度试分析:为什么
①Mg
+2HCl
=MgCl2
+H2
↑是放热反应
②Ba(OH)2.8H2O
+
2NH4Cl
=
BaCl2
+
2NH3↑
+
10H2O是吸热反应。
从能量角度分析
反应物的总能量高
生成物的总能量低
放出热量
反应物的总能量
>
生成物的总能量
放热反应
生成物的总能量高
反应物的总能量低
吸热热量
生成物的总能量
>
反应物的总能量
吸热反应
阅读课本P36第一小段文字
请你从化学键断裂与生成角度分析:
H2
+Cl2
=
2HCl
为什么是放热反应?
断开化学键吸收的能量>形成化学键放出的能量
断开化学键吸收能量,形成化学键放出能量
吸热反应:
放热反应:
断开化学键吸收的能量<形成化学键放出的能量
从化学键角度分析
二、热化学方程式
1.定义:表明反应放出或吸收的热量的化学方
程式叫热化学方程式。
如:
C(s)+O2(g)=CO2(g)
△H=-393.6kJ
?mol-1
CaCO3
(s)
=
CaO(s)
+CO2(g)
△H=
+
178.5
kJ/mol
观察与比较
氢气燃烧的化学方程式:
2H2
+
O2
==2H2O
点燃
氢气燃烧的热化学方程式
②
2H2(g)
+
O2(g)
=2H2O(l)
△H
=-571.6
kJ
?mol-
1
③H2(g)
+1/2O2(g)
=H2O(l)
△H
=-285.8
kJ
?mol-
1
①
2H2(g)
+
O2(g)
=2H2O(g)
△H
=-483.6
kJ
?mol-1
④
H2O(l)
=H2(g)
+1/2O2(g)
△H
=+285.8
kJ
?mol-
1
注:气态(g)、液态(l)、固态(s)、溶液(aq)
热化学方程式书写原则
⑴标明物质的状态:气态(g)、液态(l)
固态(s)、溶液(aq),不标↑、↓
⑶
化学计量数可以是整数或分数,
只表示物质的量,不表示微粒个数
(4)
△H
的值与化学计量数成正比。
⑵标明△H的正负及单位(
kJ/mol
),放热反应“-”,吸热反应“+”,不标点燃、△
(5)注明反应时的温度和压强,如不注明则指25℃
、101KPa
3.意义
描述了化学反应中的物质变化和热量变化
①C(s)+O2(g)=CO2(g)
△H=-393.5kJ
?mol-1
物质
热量
②CaCO3
(s)
=
CaO(s)
+
CO2(g)
△H
=
+
178.5
kJ
?mol-
1
【问题解决
】1.
对热化学方程式H2(g)
+
I2(g)
=
2HI(g);△H
=
+52kJ·mol-1的叙述中,正确的是(
)
A.1mol
H2(g)和1mol
I2(g)完全反应一定需
要吸收52kJ热量
B.1个H2和1个I2完全反应生成2个HI需要吸收52kJ热量
C.1mol
H2(g)与1mol
I2(g)完全反应生成2mol
HI(g)放出52kJ热量
D.1mol
H2(g)与1mol
I2(g)完全反应生成2mol
HI(g)吸收52kJ热量
D
【合作解决】
C、CO、CH4完全燃烧的热化学方程式可以分别表示为:
C(s)
+
O2(g)
=
CO2
(g)
△H
=
-
393.6
kJ?mol-
1
2CO(g)
+
O2(g)
=2CO2
(g)
△
H
=
-
565.
2
kJ
?mol-
1
CH4(g)
+
2O2(g)
=
CO2
(g)
+
2H2O(l)
△H
=
-
889.6
kJ
?mol-
①完全燃烧相等物质的量的上述物质,放出热量的大小顺序为_______________
CH4>
C
>
CO
CH4
②完全燃烧相等质量的C(s)和CH4(g),放出热量较多的是____________
自我总结
①化学能转化为热能就是____热反应,热能转化为化学能就是____热反应。
②从_____总能量和_____总能量相对大小及化学键的______和_____角度去理解化学反应中热量变化的原因。
③热化学方程式既体现了
守恒定律,又体现了
守恒定律。
反应物
生成物
断裂
形成
质量
能量
课堂检测
1、下列反应中是吸热反应的是(
)
A.碳酸钙受热分解
B.酒精燃烧
C.铝粉与氧化铁粉末反应
D.氧化钙溶于水
A
2、电视上“自热米饭”的广告播得很火,它介绍在食用时,将一无色液体加入到一白色固体中,放上装米饭的盒子,过几分钟米饭马上就热气腾腾,可以食用了,非常方便。请你推测白色固体和无色液体可能是如下哪个组合( )
A.氯化钠和水
B.浓硫酸和水
C.氧化钙和水
D.固体酒精和水
C
3、有如下3个热化学方程式:
H2(g)+1/2O2(g)
=
H2O(g)
ΔH=akJ·mol-1
H2(g)+1/2O2(g)
=
H2O(l)
ΔH=bkJ·mol-1
2H2(g)+O2(g)
=
2H2O(l)
ΔH=ckJ·mol-1
关于它们的下列表述正确的是(
)
A.
它们都是吸热反应
B.
a、b和c均为正值
C.
a=b
D.
2b=c
D
4、如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中放入几小块镁片,再滴入5mL盐酸于试管中。
试回答下列问题:
(1)实验中观察到的现象是____
(2)产生上述现象的原因是____
(3)写出有关反应的离子方程式_
(4)由实验推知,氯化镁溶液和
氢气的总能量___(填“大于”、“小
于”或“等于”)镁片和盐酸的总能量。
(1)现象是镁片逐渐溶解、有
大量气泡产生、烧杯中有固体析出。
(2)产生上述现象的原因是镁片
和盐酸反应放出氢气,该反应为
放热反应,Ca(OH)2溶解度随温度
升高而减少,析出固体使溶液变
浑浊。
(3)写出有关反应的离子方程式
Mg
+
2H+
=
Mg2+
+H2
↑
(4)由实验推知,氯化镁溶液和氢气的总能量小于(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
谢谢
