苏教版高中化学必修二 2.2.1化学反应中的热量变化(第2课时) (共23张PPT)
文档属性
| 名称 | 苏教版高中化学必修二 2.2.1化学反应中的热量变化(第2课时) (共23张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 666.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-06 16:46:19 | ||
图片预览






文档简介
(共23张PPT)
专题2
化学反应与能量转化
2020年4月20日
第二单元
化学反应中的热量
第2课时
化学反应中的热量变化
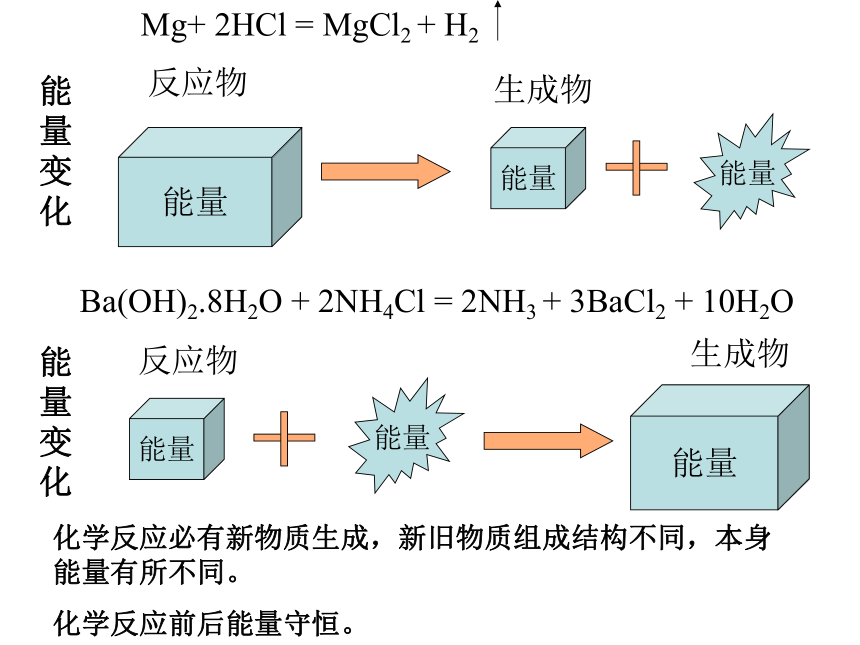
能量
反应物
能量
生成物
能量
能量
能量
能量
反应物
生成物
能量变化
能量变化
Ba(OH)2.8H2O
+
2NH4Cl
=
2NH3
+
3BaCl2
+
10H2O
化学反应必有新物质生成,新旧物质组成结构不同,本身能量有所不同。
化学反应前后能量守恒。
从宏观角度看反应能量变化的实质
吸热反应:
∑
E(反应物)
<
∑
E(生成物)
∑
E(生成物)
=
∑
E(反应物)
+
吸收的热量
放热反应:
∑
E(反应物)
>
∑
E(生成物)
∑
E(反应物)
=
∑
E(生成物)
+
放出的热量
1.∑E(反应物)>∑E(生成物)------放热反应
(能量释放)
(能量贮存)
2.∑E(反应物)<∑E(生成物)------吸热反应
反应物总能量=能量+生成物总能量
反应物总能量+能量=生成物总能量
化学反应的过程,可以看成是能量的“贮存”或“释放”的过程
从微观角度看反应能量变化的实质
化学反应的实质:旧键的断裂和新键的形成
对于同一个键,断键吸收的能量和成键放出的能量在数值上相等。
若断键吸收的能量大于成键放出的能量则表现为吸收能量。
若断键吸收的能量小于成键放出的能量则表现为放出能量。
H2(g)
+
Cl2
(g)
====
2HCl
(g)
反应的能量变化示意图
1molH2分子中的化学键断裂时需吸收436.4kJ的能量
1molCl2化学键断裂时需吸收242.7kJ的能量
2molHCl的化学键形成时要释放431.8kJ/mol×2=863.6kJ的能量
热量变化:-(863.6-242.7-436.4
)
kJ
已知拆开1molH2需要消耗436kJ能量,拆开1molO2需要消耗496kJ能量,形成水分子中的1molH-O能够释放463kJ能量。
你能根据以上所给的数据判断反应:
2H2(g)+O2(g)=2H2O(g)
是放热反应吗?并通过计算得出
△H
=?
H-O-H
△H
=-484
kJ
?mol-1
△H=反应物的键能之和
—生成物的键能之和
O2
H2O
吸收能量
放出能量
化学反应能量变化的本质(从微观看)
2H2+O2===2H2O
点燃
化学反应的实质:旧键断裂(吸收能量),新键形成(放出能量)
E
反应历程
△E
=
kJ/mol
吸收1370.8
kJ/mol
放出1851.2
kJ/mol
480.4
(注:2mol
H2和1mol
O2反应)
?
2H2(g)
+
O2(g)==2H2O(g)
△H=-480.4
kJ/mol
课本
p37
交流与讨论
△H
=
∑(反应物的总键能)
-
∑(生成物的总键能)
E
反应历程
△E
=
kJ/mol
吸收1851.2kJ/mol
放出1370.8kJ/mol
480.4
(注:2mol
H2
O分解)
?
△H
=
∑(反应物的总键能)
-
∑(生成物的总键能)
2H2O(g)
==
2H2(g)
+
O2(g)
△H=+480.4
kJ/mol
三、燃料燃烧释放的热量
我们把同质量不同燃料,完全燃烧后放出的热量用热值来表示(表2-4)
为什么质量相同的不同燃料,完全燃烧放出的热量不一样?
热值:表示燃料完全燃烧释放热量的大小
单位:kJ
?mol-1
①
现今用的燃料是什么?主要是什么?
②
燃料充分燃烧的条件有哪些?
③
燃料燃烧时,空气不足或大大过量,分别会造成什么后果?
④
导致酸雨的主要原因之一是什么?
⑤
怎样高效、清洁地利用煤炭?
⑥
怎样提高固体和液体燃料的燃烧效率?
提高燃料的使用效率
空气不足,燃烧就不完全,浪费资源,产生的大量CO危害人体健康;过量的空气会带走部分热量,同样造成浪费
将固体燃料粉碎,或将液体燃料以雾状喷出,以增大燃料与空气的接触面积
煤中所含硫在燃烧时会生成SO2
要有适当过量的空气;燃料与空气要有足够大的接触面积
高效清洁利用煤炭的重要途径
将焦炭在高温下与水蒸气反应,则得到CO和H2
练习:简要说明使煤炉中的煤充分燃烧所应采取的措施。
打开炉门
在煤饼上打孔或将煤做成煤块
燃烧时要有足够多的空气
燃料与空气要有足够大的接触面
1.下列对热化学方程式1/2H2(g)+
1/2I2(g)==
HI(g);△H
=+26kJ·mol-1的叙述中,正确的是(
)
A、1mol氢气和1mol碘蒸气完全反应需要吸收26kJ的热量
B、1个氢分子和1个碘分子完全反应需要吸收52kJ的热量
C、1molH2(g)与1mol
I2(g)完全反应生成2mol的HI气体需吸收52kJ的热量
D、1/2molH2(g)与
1/2mol
I2(g)完全反应放出26kJ的热量
C
课堂检测
2.
已知:H-H键能为436.4kJ·mol-1,Cl-Cl键能为242.7kJ·mol-1,H-Cl键能为431.8kJ·mol-1,下列有关反应H2+Cl2=2HCl的说法正确的是(
)
A.放热反应
B.放出184.5kJ/mol热量
C.吸热反应
D.吸收184.5kJ/mol热量
AB
ΔH=-431.8
kJ·mol-1×2
+
436.4
kJ·mol-1
+
242.7
kJ·mol-1
=-184.5
kJ·mol-1
3.已知破坏各1mol
N≡N键、H-H键和N-H键分别需吸收的能量为946kJ、436kJ、391kJ。计算1molN2(g)和3molH2(g)完全转化为NH3(g)的反应热的理论值。
化学键断裂共需吸收的能量为:
946kJ+1308kJ=2254
kJ
化学键形成时放出能量为:
391
kJ·mol-1×6mol=2346
kJ
。
△H=
-92kJ·mol-1
4.今有如下三个热化学方程式:
H2(g)+1/2O2(g)=H2O(g);ΔH=
a
kJ/
mol
H2(g)+1/2O2(g)=H2O(l);ΔH=
b
kJ/
mol
2H2(g)+
O2(g)=2H2O(l);ΔH=
c
kJ/
mol
关于它们的下列表述正确的是
(
)
A.它们都是吸热反应
B.a、b和c均为正值
C.a=b
D.2b=c
D
5
.氢气在氧气中燃烧产生蓝色火焰,在反应中,
破坏1molH-H键消耗的能量为Q1kJ,
破坏1molO
=
O键消耗的能量为Q2kJ,
形成1molH-O键释放的能量为Q3kJ。
下列关系式中正确的是(
)
B
A.
2Q1+Q2>4Q3
B.2Q1+Q2<4Q3
C.
Q1+Q2D.
Q1+Q2=Q3
6
.已知1mol白磷转化成1mol红磷,放出18.39
kJ热量,又知:
P4(白,s)+5O2
=
2P2O5(s);
ΔH1,
4P(红,s)+5O2
=
2P2O5(s);
ΔH2
则ΔH1和ΔH2的关系正确的是(
)
A.ΔH1>ΔH2
B.ΔH1<ΔH2
C.ΔH1=ΔH2
D.无法确定
【解析】设想P4(白)转化为P(红),由题意第一个反应放的热量大于第二个反应,故ΔH1<ΔH2。
B
7
.如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中放入几小块镁片,再滴入5mL盐酸于试管中。
试回答下列问题:
(1)实验中观察到的现象是____
(2)产生上述现象的原因是____
(3)写出有关反应的离子方程式_
(4)由实验推知,氯化镁溶液和
氢气的总能量___(填“大于”、“小
于”或“等于”)镁片和盐酸的总能量。
(1)现象是镁片逐渐溶解、有
大量气泡产生、烧杯中有固体析出。
(2)产生上述现象的原因是镁片
和盐酸反应放出氢气,该反应为
放热反应,Ca(OH)2溶解度随温度
升高而减少,析出固体使溶液变
浑浊。
(3)写出有关反应的离子方程式
Mg
+
2H+
=
Mg2+
+H2
↑
(4)由实验推知,氯化镁溶液和氢气的总能量小于(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
谢谢
专题2
化学反应与能量转化
2020年4月20日
第二单元
化学反应中的热量
第2课时
化学反应中的热量变化
能量
反应物
能量
生成物
能量
能量
能量
能量
反应物
生成物
能量变化
能量变化
Ba(OH)2.8H2O
+
2NH4Cl
=
2NH3
+
3BaCl2
+
10H2O
化学反应必有新物质生成,新旧物质组成结构不同,本身能量有所不同。
化学反应前后能量守恒。
从宏观角度看反应能量变化的实质
吸热反应:
∑
E(反应物)
<
∑
E(生成物)
∑
E(生成物)
=
∑
E(反应物)
+
吸收的热量
放热反应:
∑
E(反应物)
>
∑
E(生成物)
∑
E(反应物)
=
∑
E(生成物)
+
放出的热量
1.∑E(反应物)>∑E(生成物)------放热反应
(能量释放)
(能量贮存)
2.∑E(反应物)<∑E(生成物)------吸热反应
反应物总能量=能量+生成物总能量
反应物总能量+能量=生成物总能量
化学反应的过程,可以看成是能量的“贮存”或“释放”的过程
从微观角度看反应能量变化的实质
化学反应的实质:旧键的断裂和新键的形成
对于同一个键,断键吸收的能量和成键放出的能量在数值上相等。
若断键吸收的能量大于成键放出的能量则表现为吸收能量。
若断键吸收的能量小于成键放出的能量则表现为放出能量。
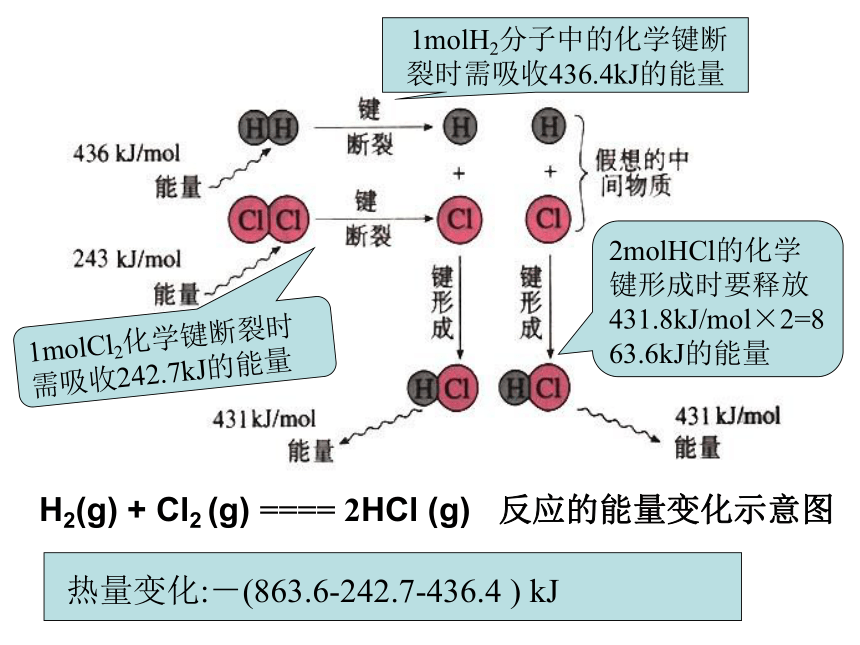
H2(g)
+
Cl2
(g)
====
2HCl
(g)
反应的能量变化示意图
1molH2分子中的化学键断裂时需吸收436.4kJ的能量
1molCl2化学键断裂时需吸收242.7kJ的能量
2molHCl的化学键形成时要释放431.8kJ/mol×2=863.6kJ的能量
热量变化:-(863.6-242.7-436.4
)
kJ
已知拆开1molH2需要消耗436kJ能量,拆开1molO2需要消耗496kJ能量,形成水分子中的1molH-O能够释放463kJ能量。
你能根据以上所给的数据判断反应:
2H2(g)+O2(g)=2H2O(g)
是放热反应吗?并通过计算得出
△H
=?
H-O-H
△H
=-484
kJ
?mol-1
△H=反应物的键能之和
—生成物的键能之和
O2
H2O
吸收能量
放出能量
化学反应能量变化的本质(从微观看)
2H2+O2===2H2O
点燃
化学反应的实质:旧键断裂(吸收能量),新键形成(放出能量)
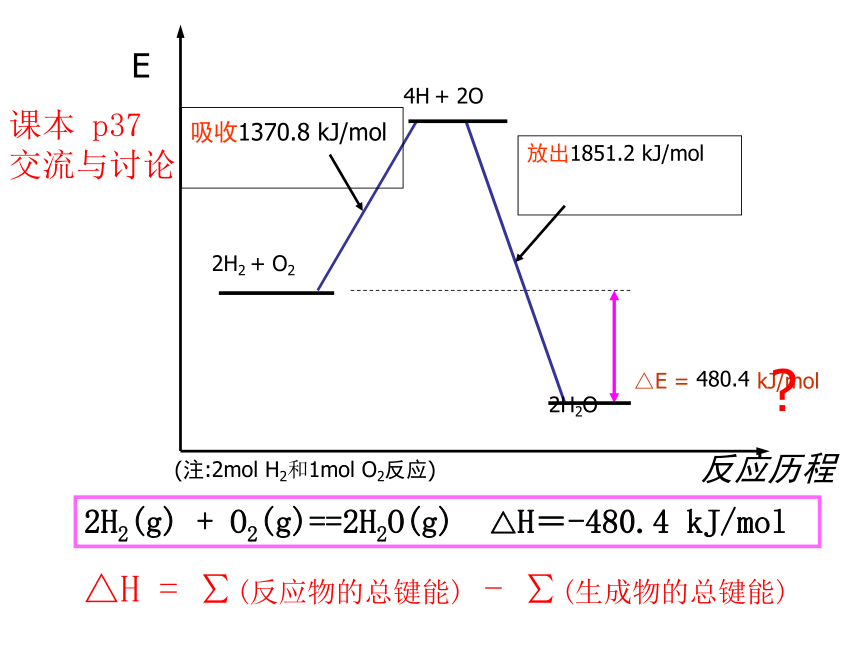
E
反应历程
△E
=
kJ/mol
吸收1370.8
kJ/mol
放出1851.2
kJ/mol
480.4
(注:2mol
H2和1mol
O2反应)
?
2H2(g)
+
O2(g)==2H2O(g)
△H=-480.4
kJ/mol
课本
p37
交流与讨论
△H
=
∑(反应物的总键能)
-
∑(生成物的总键能)
E
反应历程
△E
=
kJ/mol
吸收1851.2kJ/mol
放出1370.8kJ/mol
480.4
(注:2mol
H2
O分解)
?
△H
=
∑(反应物的总键能)
-
∑(生成物的总键能)
2H2O(g)
==
2H2(g)
+
O2(g)
△H=+480.4
kJ/mol
三、燃料燃烧释放的热量
我们把同质量不同燃料,完全燃烧后放出的热量用热值来表示(表2-4)
为什么质量相同的不同燃料,完全燃烧放出的热量不一样?
热值:表示燃料完全燃烧释放热量的大小
单位:kJ
?mol-1
①
现今用的燃料是什么?主要是什么?
②
燃料充分燃烧的条件有哪些?
③
燃料燃烧时,空气不足或大大过量,分别会造成什么后果?
④
导致酸雨的主要原因之一是什么?
⑤
怎样高效、清洁地利用煤炭?
⑥
怎样提高固体和液体燃料的燃烧效率?
提高燃料的使用效率
空气不足,燃烧就不完全,浪费资源,产生的大量CO危害人体健康;过量的空气会带走部分热量,同样造成浪费
将固体燃料粉碎,或将液体燃料以雾状喷出,以增大燃料与空气的接触面积
煤中所含硫在燃烧时会生成SO2
要有适当过量的空气;燃料与空气要有足够大的接触面积
高效清洁利用煤炭的重要途径
将焦炭在高温下与水蒸气反应,则得到CO和H2
练习:简要说明使煤炉中的煤充分燃烧所应采取的措施。
打开炉门
在煤饼上打孔或将煤做成煤块
燃烧时要有足够多的空气
燃料与空气要有足够大的接触面
1.下列对热化学方程式1/2H2(g)+
1/2I2(g)==
HI(g);△H
=+26kJ·mol-1的叙述中,正确的是(
)
A、1mol氢气和1mol碘蒸气完全反应需要吸收26kJ的热量
B、1个氢分子和1个碘分子完全反应需要吸收52kJ的热量
C、1molH2(g)与1mol
I2(g)完全反应生成2mol的HI气体需吸收52kJ的热量
D、1/2molH2(g)与
1/2mol
I2(g)完全反应放出26kJ的热量
C
课堂检测
2.
已知:H-H键能为436.4kJ·mol-1,Cl-Cl键能为242.7kJ·mol-1,H-Cl键能为431.8kJ·mol-1,下列有关反应H2+Cl2=2HCl的说法正确的是(
)
A.放热反应
B.放出184.5kJ/mol热量
C.吸热反应
D.吸收184.5kJ/mol热量
AB
ΔH=-431.8
kJ·mol-1×2
+
436.4
kJ·mol-1
+
242.7
kJ·mol-1
=-184.5
kJ·mol-1
3.已知破坏各1mol
N≡N键、H-H键和N-H键分别需吸收的能量为946kJ、436kJ、391kJ。计算1molN2(g)和3molH2(g)完全转化为NH3(g)的反应热的理论值。
化学键断裂共需吸收的能量为:
946kJ+1308kJ=2254
kJ
化学键形成时放出能量为:
391
kJ·mol-1×6mol=2346
kJ
。
△H=
-92kJ·mol-1
4.今有如下三个热化学方程式:
H2(g)+1/2O2(g)=H2O(g);ΔH=
a
kJ/
mol
H2(g)+1/2O2(g)=H2O(l);ΔH=
b
kJ/
mol
2H2(g)+
O2(g)=2H2O(l);ΔH=
c
kJ/
mol
关于它们的下列表述正确的是
(
)
A.它们都是吸热反应
B.a、b和c均为正值
C.a=b
D.2b=c
D
5
.氢气在氧气中燃烧产生蓝色火焰,在反应中,
破坏1molH-H键消耗的能量为Q1kJ,
破坏1molO
=
O键消耗的能量为Q2kJ,
形成1molH-O键释放的能量为Q3kJ。
下列关系式中正确的是(
)
B
A.
2Q1+Q2>4Q3
B.2Q1+Q2<4Q3
C.
Q1+Q2
Q1+Q2=Q3
6
.已知1mol白磷转化成1mol红磷,放出18.39
kJ热量,又知:
P4(白,s)+5O2
=
2P2O5(s);
ΔH1,
4P(红,s)+5O2
=
2P2O5(s);
ΔH2
则ΔH1和ΔH2的关系正确的是(
)
A.ΔH1>ΔH2
B.ΔH1<ΔH2
C.ΔH1=ΔH2
D.无法确定
【解析】设想P4(白)转化为P(红),由题意第一个反应放的热量大于第二个反应,故ΔH1<ΔH2。
B
7
.如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中放入几小块镁片,再滴入5mL盐酸于试管中。
试回答下列问题:
(1)实验中观察到的现象是____
(2)产生上述现象的原因是____
(3)写出有关反应的离子方程式_
(4)由实验推知,氯化镁溶液和
氢气的总能量___(填“大于”、“小
于”或“等于”)镁片和盐酸的总能量。
(1)现象是镁片逐渐溶解、有
大量气泡产生、烧杯中有固体析出。
(2)产生上述现象的原因是镁片
和盐酸反应放出氢气,该反应为
放热反应,Ca(OH)2溶解度随温度
升高而减少,析出固体使溶液变
浑浊。
(3)写出有关反应的离子方程式
Mg
+
2H+
=
Mg2+
+H2
↑
(4)由实验推知,氯化镁溶液和氢气的总能量小于(填“大于”、“小于”或“等于”)镁片和盐酸的总能量。
谢谢
