人教版高二年级选修五 第三章第四节 有机合成(48张ppt)
文档属性
| 名称 | 人教版高二年级选修五 第三章第四节 有机合成(48张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-06 16:47:52 | ||
图片预览




文档简介
(共48张PPT)
选修五
第三章
第四节
有机合成
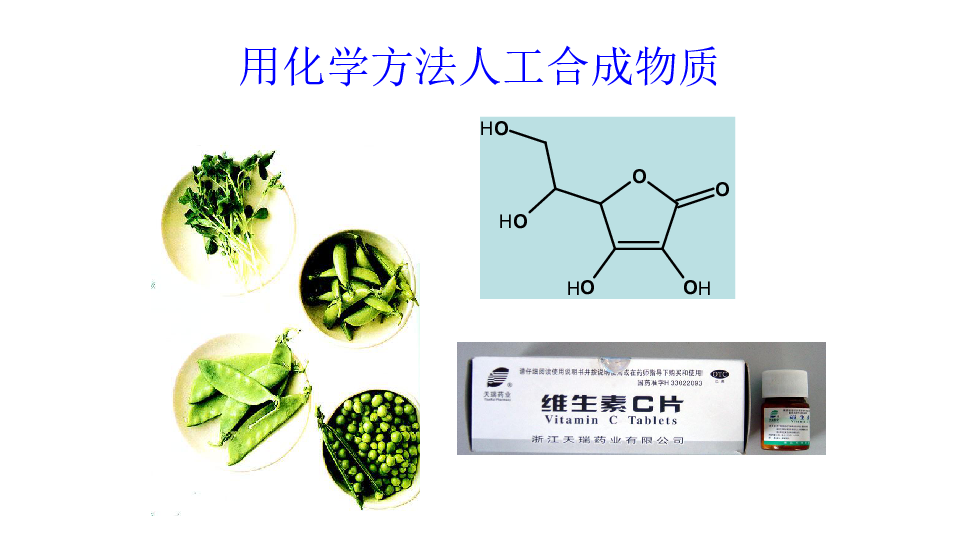
用化学方法人工合成物质
用化学方法人工合成物质
修饰
自然
物质
解热镇痛药物——阿司匹林
卡托普利、青霉素
用化学方法人工合成物质
创造新物质,如尼龙、涤纶、炸药、医药等等
宇航服中应用了一百三十多种新型材料。其中多数是有机合成材料。
“水立方”是我国第一个采用ETFE(乙烯—四氟乙烯共聚物)膜材料作为立面维护体系的建筑。
我们世界上每年合成的近百万个新化合物中约70%以上是有机化合物。
学习目标:
1.
熟悉各类有机物的性质和相互转化关系;
2.
认识并掌握逆向合成法的思维方法。
学习重点:逆向合成法
名称
官能团
主要化学性质
烷烃
----------------
烯烃
炔烃
芳香烃
----------------
卤代烃
—X
醇
—OH
酚
—OH
醛
—CHO
酮
羧酸
—COOH
酯
—COOR
燃烧氧化
、取代、裂化
氧化、加成、加聚
氧化、加成、加聚
氧化、取代、加成
水解、消去
取代、消去、氧化
弱酸性、取代、显色、氧化
加成、氧化、聚合
加成
酸性、酯化
水解
知识回顾:
有机反应的基本类型
烷烃、苯及同系物、醇的卤代,苯的硝化,醇的分子间脱水,酯化反应,酯的水解反应等。
有机物加氧或去氢的反应,如:醛基的氧化、醇的催化氧化,烯烃、炔烃,醛,醇,苯的同系物被KMnO4氧化,有机物的燃烧
1)取代反应
2)加成反应
3)氧化反应
知识回顾:
有机物加氢或去氧的反应,如:烯烃、炔烃、苯、醛等与氢气的加成反应。
4)还原反应
烯烃、炔烃、苯、醛等分子中含有的不饱和键可与H2、HX、X2、H2O等加成
;醛、酮中的C=O可与H2加成
5)消去反应
有机化合物在一定条件下,从一个分子中脱去一个小分子(如HX、H2O),而形成不饱和化合物的反应。如卤代烃、乙醇。
6)酯化反应
醇和含氧酸起作用,生成酯和水的反应叫做酯化反应。
①酯的水解反应:酯与水发生作用生成相应的醇和羧酸(或羧酸盐)的反应。
②卤代烃在NaOH的水溶液中水解。
③双糖,多糖,油脂,蛋白质的水解
由小分子加成聚合生成高分子化合物的反应。如乙烯加聚生成聚乙烯。
7)水解反应
8)加聚反应
阅读课本P64第三自然段,回答:
1、什么是有机合成?
2、有机合成的任务有哪些?
3、用示意图表示出有机合成过程。
自学与交流
利用简单、易得的原料,通过有机反应,生成具有特定结构和功能的有机化合物。
1、有机合成:
2、有机合成的任务:
(1)目标化合物分子碳链骨架的构建;
(2)官能团的转化。
一、有机合成的过程
碳链发生变化(包括碳链增长、缩短、成环)
基础原料
中间体1
目标
化合物
中间体2
辅助原料1
辅助原料2
辅助原料3
副产物1
副产物2
3、有机合成的过程:
有机合成过程示意图
4、有机合成遵循的原则
1、起始原料要廉价、易得、低毒、低污染——通常采用4个C以下的单官能团化合物和单取代苯。
2、尽量选择步骤最少的合成路线——以保证较高的产率。
3、满足“绿色化学”的要求。
4、操作简单、条件温和、能耗低、易实现。
5、尊重客观事实,按一定顺序反应。
必备的基本知识
官能团的引入
官能团的消除
官能团的衍变
有机成环反应规律
二、官能团的引入方法
①引入C=C双键
1)某些醇的消去引入C=C
CH3CH2
OH
浓硫酸
170℃
CH2==CH2↑
+H2O
醇
△
CH2=CH2↑+
NaBr+
H2O
CH3CH2Br
+NaOH
2)卤代烃的消去引入C=C
3)炔烃加成引入C=C
CH≡CH
+
HBr
CH2=CHBr
催化剂
△
三种方法
②引入卤原子(—X)
1)烃与X2取代
CH4
+Cl2
CH3Cl+
HCl
光照
2)不饱和烃与HX或X2加成
CH2==CH2+Br2
CH2BrCH2Br
3)醇与HX取代
C2H5OH
+
HBr
C2H5Br
+
H2O
△
催化剂
三种方法
①甲烷和氯气
②苯和溴
③酚和溴水
③引入羟基(—OH)
1)烯烃与水的加成
CH2==CH2
+H2O
CH3CH2OH
催化剂
加热加压
2)醛(酮)与氢气加成
CH3CHO
+H2
CH3CH2OH
催化剂
Δ
3)卤代烃的水解(碱性)
C2H5Br
+NaOH
C2H5OH
+
NaBr
水
△
4)酯的水解
稀H2SO4
CH3COOH+C2H5OH
CH3COOC2H5
+
H2O
△
四种方法
引入-CHO或羰基的方法有:
引入-COOH的方法有:
(1)某些醇氧化
(2)糖类水解
(3)炔烃水化
(1)醛氧化
(2)苯的同系物被强氧化剂氧化
(3)羧酸盐酸化
(4)酯的酸性水解
1、通过加成反应消除不饱和键
三、官能团的消除方法
【思考】怎样消去不饱和键?消去醛基?消去羟基?
CH2=CH2+H2
CH3CH3
Ni
△
CH3CH=O+H2
CH3CH2OH
催化剂
Δ
2、通过加成(加H)或氧化(加O)消除醛基
3、通过消去或氧化或酯化等消去羟基
H3CHC=O+H2
CH3CH2OH
催化剂
Δ
2CH3CHO+O2
2CH3COOH
催化剂
Δ
CH3OH+HCOOH
HCOOCH3+H2O
浓硫酸△
CH3CH2OH
CH2=CH2+H2O
浓硫酸△
2CH3CH2OH+O2
2CH3CHO+2H2O
Cu
△
1.
不同官能团间的转换(利用衍生关系)
四、官能团的衍变
RCH2CH2-X
R-CH=CH2
RCH2CH2OH
RCH2CHO
RCH2COOH
RCH2COOCH3
2.
通过某种化学途径增加官能团
CH3CH2OH
HOCH2CH2OH
CH2=CH2
ClCH2CH2Cl
CH2=CHCH2CH3
CH3CH=CHCH3
CH3CHClCH2CH3
CH3CH=CH2
CH3CH2CH2OH
CH3CH(OH)CH3
3.
通过某种途径使官能团的位置改变
还原
水
解
酯
羧酸
醛
醇
卤代烃
氧化
氧化
烯
烷
炔
【小结】官能团的衍变
酯
化
取代
H2加成
H2不完全加成
水解
取代
1.
形成环酯
五
有机合成中碳架的构建
(一)有机成环反应规律
2.
氨基酸形成环状肽
3.
形成环醚
4.形成环酸酐
5.形成环烃
(2)加成反应、聚合反应:
共轭二烯烃+单烯烃→六元环烯烃
(2)、碳链的增长:
(1)加聚反应
缩聚反应
(2)酯化反应
(3)碳碳双键或醛、酮和HCN先加成后水解
(5)醇分子间脱水(取代反应)生成醚
(4)羟醛缩合
CH3CHO+HCN
基础原料
辅助原料
副产物
副产物
中间体
中间体
辅助原料
辅助原料
目标化合物
六、有机合成的方法
1、正向合成分析法(又称顺推法)
此法采用正向思维方法,从已知原料入手,找出可直接合成的所需要的中间产物,并同样找出它的下一步产物,依次类推,逐步推向合成目标有机物。
如何以乙烯为基础原料,无机原料可以任选,合成下列物质:
(1)CH3CH2OH
(2)CH3COOH
(3)CH3COOCH2CH3
基础原料
中间体
目标化合物
中间体
练一练
2、逆向合成分析法
基础原料
中间体
中间体
目标化合物
逆向合成分析法示意图
又称逆推法,其特点是从产物出发,由后向前推,先找出产物的前一步原料(中间体),并同样找出它的前一步原料,如此继续直至到达简单的初始原料为止。
原料
中间产物
产品
顺
顺
逆
逆
以
为基础原料,无机原料可
以任选,合成
【探讨学习1】
浓硫酸/△
NaOH溶液
△
Cl2
光照
CH3
C-
O-CH2
=
O
C-
O-CH2
=
O
CH3
CH2Cl
CH2OH
CHO
COOH
催化剂
△
催化剂
△
35
C—
OH
C—
OH
O
O
H2C—
OH
H2C—
OH
H2C—
Cl
H2C—
Cl
CH2
CH2
C—
OC2H5
C—
OC2H5
O
O
(石油裂解气)
CH3CH2OH
+H2O
+Cl2
[O]
浓H2SO4
水解
探讨学习2
如何以乙烯为原料合成乙二酸(草酸)二乙酯?
1
2
3
4
5
△
如何由乙烯合成环乙二酸乙二酯?
O
C
CH2
C
CH2
O
O
O
O
C
CH2
C
CH2
O
O
O
采用逆向合成法分析并写出各步的反应方程式:
HOCH2-CH2OH
HOOC-COOH
OHC-CHO
HOCH2-CH2OH
BrCH2-CH2Br
CH2=CH2
1
加成
2
水解
3
氧化
4
氧化
5
酯化
【练习2】
(1917年4月10日–1979年7月8日
),
1917年4月10日生于美国马萨诸塞州的波士顿自幼爱好化学,在小学和中学时期,经常在家中地下室进行实验。十六岁进入麻省理工学院学习,1937年获得博士学位。
毕业后进入哈佛大学执教,1950年任教授。伍德沃德是有机化学界公认的天才,当代最著名的有机合成大师。1965年和1981年两次获得诺贝尔化学奖。据不完全统计,他合成的各种结构复杂的有机物达二十多种,所以被称为“现代有机合成之父”.
罗伯特·伯恩斯·伍德沃德简介
【学与问】(教材P66)
A
B
C
93.0%
81.7%
85.6%
90.0%
总产率=1×93.0%×81.7%×90.0%×85.6%=58.54%
总产率计算——
多步反应一次计算
请计算一下该合成路线的总产率是多少?
(卡托普利)
结论:合成步骤越多,总产率就越低。
思考:有机合成应遵循什么样的原则?
39
常用的三条有机合成路线
3、芳香族化合物的合成路线
COOH
∣
芳香酯
↓
↖
↙
【知识归纳】
由反应条件确定官能团:
反应条件
可能官能团
浓硫酸
①醇的消去(醇羟基)
②酯化反应(含有羟基、羧基)
③两分子醇生成醚
稀硫酸
①酯的水解(含有酯基)
②二糖、多糖(淀粉)的水解(20%硫酸)
NaOH水溶液
①卤代烃的水解
②酯的水解
NaOH醇溶液
卤代烃消去(—X)
反应条件
可能官能团
H2、催化剂
加成(碳碳双键、碳碳三键、醛基、羰基、苯环)
O2/Cu、加热
醇羟基(—CH2OH、CHOH)
Cl2(Br2)/Fe
苯环
Cl2(Br2)/光照
烷烃或苯环上烷烃基
反应条件
可能官能团
与新制氢氧化铜产生砖红色沉淀
醛基(羧基为中和反应)
使溴水褪色
碳碳双键、—C≡C—
加溴水产生白色沉淀、遇Fe3+显紫色
酚羟基
A
O2
B
O2
C
A是醇(—CH2OH)或乙烯
45
一 、烃的衍生物之间的转化关系
二、有机反应和有机合成
本节小结
46
三、反应条件与物质性质
1.温度不同,反应类型和产物不同
(1)乙醇的脱水反应:乙醇与浓H2SO4共热至170
℃,主要发生消去反应(属分子内脱水)生成乙烯(浓硫酸起脱水剂和催化剂双重作用):
原理:
CH2=CH2↑+H2O
若将温度调至140
℃,主要发生分子间脱水(不是消去反应而是取代反应)生成乙醚:
C2H5—O—C2H5+H2O
47
(2)甲酸与新制Cu(OH)2悬浊液混合,常温下主要发生中和反应:
2HCOOH+Cu(OH)2→Cu(HCOO)2+2H2O
而加热煮沸则主要发生氧化还原反应:
HCOOH+2Cu(OH)2
Cu2O↓+CO2↑+3H2O
2.溶剂不同,反应类型和产物不同
溴乙烷与强碱的水溶液共热则发生取代反应(也称为水解)生成乙醇,但跟强碱的醇溶液共热却发生消去反应生成乙烯。
CH3—CH2—Br+NaOH(水溶液)
CH3—CH2—OH+NaBr
CH3—CH2—Br+NaOH(醇溶液)
CH2=CH2↑+H2O+NaBr
48
3.催化剂不同,反应进行的方向不同
CH3COOH+C2H5OH
CH3COOC2H5+H2O
CH3COOC2H5+H2O
CH3COOH+C2H5OH
4.酸碱性不同,其水解程度不同,产物不同
酯的碱性水解程度大于酯的酸性水解,这是因为碱和酯水解生成的酸发生中和反应,从而使酯的水解平衡向正反应方向移动。
稀H2SO4
选修五
第三章
第四节
有机合成
用化学方法人工合成物质
用化学方法人工合成物质
修饰
自然
物质
解热镇痛药物——阿司匹林
卡托普利、青霉素
用化学方法人工合成物质
创造新物质,如尼龙、涤纶、炸药、医药等等
宇航服中应用了一百三十多种新型材料。其中多数是有机合成材料。
“水立方”是我国第一个采用ETFE(乙烯—四氟乙烯共聚物)膜材料作为立面维护体系的建筑。
我们世界上每年合成的近百万个新化合物中约70%以上是有机化合物。
学习目标:
1.
熟悉各类有机物的性质和相互转化关系;
2.
认识并掌握逆向合成法的思维方法。
学习重点:逆向合成法
名称
官能团
主要化学性质
烷烃
----------------
烯烃
炔烃
芳香烃
----------------
卤代烃
—X
醇
—OH
酚
—OH
醛
—CHO
酮
羧酸
—COOH
酯
—COOR
燃烧氧化
、取代、裂化
氧化、加成、加聚
氧化、加成、加聚
氧化、取代、加成
水解、消去
取代、消去、氧化
弱酸性、取代、显色、氧化
加成、氧化、聚合
加成
酸性、酯化
水解
知识回顾:
有机反应的基本类型
烷烃、苯及同系物、醇的卤代,苯的硝化,醇的分子间脱水,酯化反应,酯的水解反应等。
有机物加氧或去氢的反应,如:醛基的氧化、醇的催化氧化,烯烃、炔烃,醛,醇,苯的同系物被KMnO4氧化,有机物的燃烧
1)取代反应
2)加成反应
3)氧化反应
知识回顾:
有机物加氢或去氧的反应,如:烯烃、炔烃、苯、醛等与氢气的加成反应。
4)还原反应
烯烃、炔烃、苯、醛等分子中含有的不饱和键可与H2、HX、X2、H2O等加成
;醛、酮中的C=O可与H2加成
5)消去反应
有机化合物在一定条件下,从一个分子中脱去一个小分子(如HX、H2O),而形成不饱和化合物的反应。如卤代烃、乙醇。
6)酯化反应
醇和含氧酸起作用,生成酯和水的反应叫做酯化反应。
①酯的水解反应:酯与水发生作用生成相应的醇和羧酸(或羧酸盐)的反应。
②卤代烃在NaOH的水溶液中水解。
③双糖,多糖,油脂,蛋白质的水解
由小分子加成聚合生成高分子化合物的反应。如乙烯加聚生成聚乙烯。
7)水解反应
8)加聚反应
阅读课本P64第三自然段,回答:
1、什么是有机合成?
2、有机合成的任务有哪些?
3、用示意图表示出有机合成过程。
自学与交流
利用简单、易得的原料,通过有机反应,生成具有特定结构和功能的有机化合物。
1、有机合成:
2、有机合成的任务:
(1)目标化合物分子碳链骨架的构建;
(2)官能团的转化。
一、有机合成的过程
碳链发生变化(包括碳链增长、缩短、成环)
基础原料
中间体1
目标
化合物
中间体2
辅助原料1
辅助原料2
辅助原料3
副产物1
副产物2
3、有机合成的过程:
有机合成过程示意图
4、有机合成遵循的原则
1、起始原料要廉价、易得、低毒、低污染——通常采用4个C以下的单官能团化合物和单取代苯。
2、尽量选择步骤最少的合成路线——以保证较高的产率。
3、满足“绿色化学”的要求。
4、操作简单、条件温和、能耗低、易实现。
5、尊重客观事实,按一定顺序反应。
必备的基本知识
官能团的引入
官能团的消除
官能团的衍变
有机成环反应规律
二、官能团的引入方法
①引入C=C双键
1)某些醇的消去引入C=C
CH3CH2
OH
浓硫酸
170℃
CH2==CH2↑
+H2O
醇
△
CH2=CH2↑+
NaBr+
H2O
CH3CH2Br
+NaOH
2)卤代烃的消去引入C=C
3)炔烃加成引入C=C
CH≡CH
+
HBr
CH2=CHBr
催化剂
△
三种方法
②引入卤原子(—X)
1)烃与X2取代
CH4
+Cl2
CH3Cl+
HCl
光照
2)不饱和烃与HX或X2加成
CH2==CH2+Br2
CH2BrCH2Br
3)醇与HX取代
C2H5OH
+
HBr
C2H5Br
+
H2O
△
催化剂
三种方法
①甲烷和氯气
②苯和溴
③酚和溴水
③引入羟基(—OH)
1)烯烃与水的加成
CH2==CH2
+H2O
CH3CH2OH
催化剂
加热加压
2)醛(酮)与氢气加成
CH3CHO
+H2
CH3CH2OH
催化剂
Δ
3)卤代烃的水解(碱性)
C2H5Br
+NaOH
C2H5OH
+
NaBr
水
△
4)酯的水解
稀H2SO4
CH3COOH+C2H5OH
CH3COOC2H5
+
H2O
△
四种方法
引入-CHO或羰基的方法有:
引入-COOH的方法有:
(1)某些醇氧化
(2)糖类水解
(3)炔烃水化
(1)醛氧化
(2)苯的同系物被强氧化剂氧化
(3)羧酸盐酸化
(4)酯的酸性水解
1、通过加成反应消除不饱和键
三、官能团的消除方法
【思考】怎样消去不饱和键?消去醛基?消去羟基?
CH2=CH2+H2
CH3CH3
Ni
△
CH3CH=O+H2
CH3CH2OH
催化剂
Δ
2、通过加成(加H)或氧化(加O)消除醛基
3、通过消去或氧化或酯化等消去羟基
H3CHC=O+H2
CH3CH2OH
催化剂
Δ
2CH3CHO+O2
2CH3COOH
催化剂
Δ
CH3OH+HCOOH
HCOOCH3+H2O
浓硫酸△
CH3CH2OH
CH2=CH2+H2O
浓硫酸△
2CH3CH2OH+O2
2CH3CHO+2H2O
Cu
△
1.
不同官能团间的转换(利用衍生关系)
四、官能团的衍变
RCH2CH2-X
R-CH=CH2
RCH2CH2OH
RCH2CHO
RCH2COOH
RCH2COOCH3
2.
通过某种化学途径增加官能团
CH3CH2OH
HOCH2CH2OH
CH2=CH2
ClCH2CH2Cl
CH2=CHCH2CH3
CH3CH=CHCH3
CH3CHClCH2CH3
CH3CH=CH2
CH3CH2CH2OH
CH3CH(OH)CH3
3.
通过某种途径使官能团的位置改变
还原
水
解
酯
羧酸
醛
醇
卤代烃
氧化
氧化
烯
烷
炔
【小结】官能团的衍变
酯
化
取代
H2加成
H2不完全加成
水解
取代
1.
形成环酯
五
有机合成中碳架的构建
(一)有机成环反应规律
2.
氨基酸形成环状肽
3.
形成环醚
4.形成环酸酐
5.形成环烃
(2)加成反应、聚合反应:
共轭二烯烃+单烯烃→六元环烯烃
(2)、碳链的增长:
(1)加聚反应
缩聚反应
(2)酯化反应
(3)碳碳双键或醛、酮和HCN先加成后水解
(5)醇分子间脱水(取代反应)生成醚
(4)羟醛缩合
CH3CHO+HCN
基础原料
辅助原料
副产物
副产物
中间体
中间体
辅助原料
辅助原料
目标化合物
六、有机合成的方法
1、正向合成分析法(又称顺推法)
此法采用正向思维方法,从已知原料入手,找出可直接合成的所需要的中间产物,并同样找出它的下一步产物,依次类推,逐步推向合成目标有机物。
如何以乙烯为基础原料,无机原料可以任选,合成下列物质:
(1)CH3CH2OH
(2)CH3COOH
(3)CH3COOCH2CH3
基础原料
中间体
目标化合物
中间体
练一练
2、逆向合成分析法
基础原料
中间体
中间体
目标化合物
逆向合成分析法示意图
又称逆推法,其特点是从产物出发,由后向前推,先找出产物的前一步原料(中间体),并同样找出它的前一步原料,如此继续直至到达简单的初始原料为止。
原料
中间产物
产品
顺
顺
逆
逆
以
为基础原料,无机原料可
以任选,合成
【探讨学习1】
浓硫酸/△
NaOH溶液
△
Cl2
光照
CH3
C-
O-CH2
=
O
C-
O-CH2
=
O
CH3
CH2Cl
CH2OH
CHO
COOH
催化剂
△
催化剂
△
35
C—
OH
C—
OH
O
O
H2C—
OH
H2C—
OH
H2C—
Cl
H2C—
Cl
CH2
CH2
C—
OC2H5
C—
OC2H5
O
O
(石油裂解气)
CH3CH2OH
+H2O
+Cl2
[O]
浓H2SO4
水解
探讨学习2
如何以乙烯为原料合成乙二酸(草酸)二乙酯?
1
2
3
4
5
△
如何由乙烯合成环乙二酸乙二酯?
O
C
CH2
C
CH2
O
O
O
O
C
CH2
C
CH2
O
O
O
采用逆向合成法分析并写出各步的反应方程式:
HOCH2-CH2OH
HOOC-COOH
OHC-CHO
HOCH2-CH2OH
BrCH2-CH2Br
CH2=CH2
1
加成
2
水解
3
氧化
4
氧化
5
酯化
【练习2】
(1917年4月10日–1979年7月8日
),
1917年4月10日生于美国马萨诸塞州的波士顿自幼爱好化学,在小学和中学时期,经常在家中地下室进行实验。十六岁进入麻省理工学院学习,1937年获得博士学位。
毕业后进入哈佛大学执教,1950年任教授。伍德沃德是有机化学界公认的天才,当代最著名的有机合成大师。1965年和1981年两次获得诺贝尔化学奖。据不完全统计,他合成的各种结构复杂的有机物达二十多种,所以被称为“现代有机合成之父”.
罗伯特·伯恩斯·伍德沃德简介
【学与问】(教材P66)
A
B
C
93.0%
81.7%
85.6%
90.0%
总产率=1×93.0%×81.7%×90.0%×85.6%=58.54%
总产率计算——
多步反应一次计算
请计算一下该合成路线的总产率是多少?
(卡托普利)
结论:合成步骤越多,总产率就越低。
思考:有机合成应遵循什么样的原则?
39
常用的三条有机合成路线
3、芳香族化合物的合成路线
COOH
∣
芳香酯
↓
↖
↙
【知识归纳】
由反应条件确定官能团:
反应条件
可能官能团
浓硫酸
①醇的消去(醇羟基)
②酯化反应(含有羟基、羧基)
③两分子醇生成醚
稀硫酸
①酯的水解(含有酯基)
②二糖、多糖(淀粉)的水解(20%硫酸)
NaOH水溶液
①卤代烃的水解
②酯的水解
NaOH醇溶液
卤代烃消去(—X)
反应条件
可能官能团
H2、催化剂
加成(碳碳双键、碳碳三键、醛基、羰基、苯环)
O2/Cu、加热
醇羟基(—CH2OH、CHOH)
Cl2(Br2)/Fe
苯环
Cl2(Br2)/光照
烷烃或苯环上烷烃基
反应条件
可能官能团
与新制氢氧化铜产生砖红色沉淀
醛基(羧基为中和反应)
使溴水褪色
碳碳双键、—C≡C—
加溴水产生白色沉淀、遇Fe3+显紫色
酚羟基
A
O2
B
O2
C
A是醇(—CH2OH)或乙烯
45
一 、烃的衍生物之间的转化关系
二、有机反应和有机合成
本节小结
46
三、反应条件与物质性质
1.温度不同,反应类型和产物不同
(1)乙醇的脱水反应:乙醇与浓H2SO4共热至170
℃,主要发生消去反应(属分子内脱水)生成乙烯(浓硫酸起脱水剂和催化剂双重作用):
原理:
CH2=CH2↑+H2O
若将温度调至140
℃,主要发生分子间脱水(不是消去反应而是取代反应)生成乙醚:
C2H5—O—C2H5+H2O
47
(2)甲酸与新制Cu(OH)2悬浊液混合,常温下主要发生中和反应:
2HCOOH+Cu(OH)2→Cu(HCOO)2+2H2O
而加热煮沸则主要发生氧化还原反应:
HCOOH+2Cu(OH)2
Cu2O↓+CO2↑+3H2O
2.溶剂不同,反应类型和产物不同
溴乙烷与强碱的水溶液共热则发生取代反应(也称为水解)生成乙醇,但跟强碱的醇溶液共热却发生消去反应生成乙烯。
CH3—CH2—Br+NaOH(水溶液)
CH3—CH2—OH+NaBr
CH3—CH2—Br+NaOH(醇溶液)
CH2=CH2↑+H2O+NaBr
48
3.催化剂不同,反应进行的方向不同
CH3COOH+C2H5OH
CH3COOC2H5+H2O
CH3COOC2H5+H2O
CH3COOH+C2H5OH
4.酸碱性不同,其水解程度不同,产物不同
酯的碱性水解程度大于酯的酸性水解,这是因为碱和酯水解生成的酸发生中和反应,从而使酯的水解平衡向正反应方向移动。
稀H2SO4
