芜湖一中2019-2020学年高二下学期人教版化学选修3同步教案第二章 分子结构与性质第一节共价键
文档属性
| 名称 | 芜湖一中2019-2020学年高二下学期人教版化学选修3同步教案第二章 分子结构与性质第一节共价键 |  | |
| 格式 | zip | ||
| 文件大小 | 208.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-06 17:06:35 | ||
图片预览


文档简介
第二章
分子结构与性质
第一节
共价键(第一课时)
教学目标:
1、复习化学键的概念,能用电子式表示常见物质的离子键或共价键的形成过程。
2、知道共价键的主要类型δ键和π键。
3、说出δ键和π键的明显差别和一般规律。
教学重点、难点:价层电子对互斥模型
课前预习:
1、共价键是常见化学键之一,它是指
其本质是
。
2、
判断δ键和π键的一般规律是:共价单键是
键;而共价双键中有
个δ键,共价三键中有
个δ键,其余为π键。
学习过程
[引入]
NaCl、HCl的形成过程
前面学习了电子云和轨道理论,对于HCl中H、Cl原子形成共价键时,电子云如何重叠?
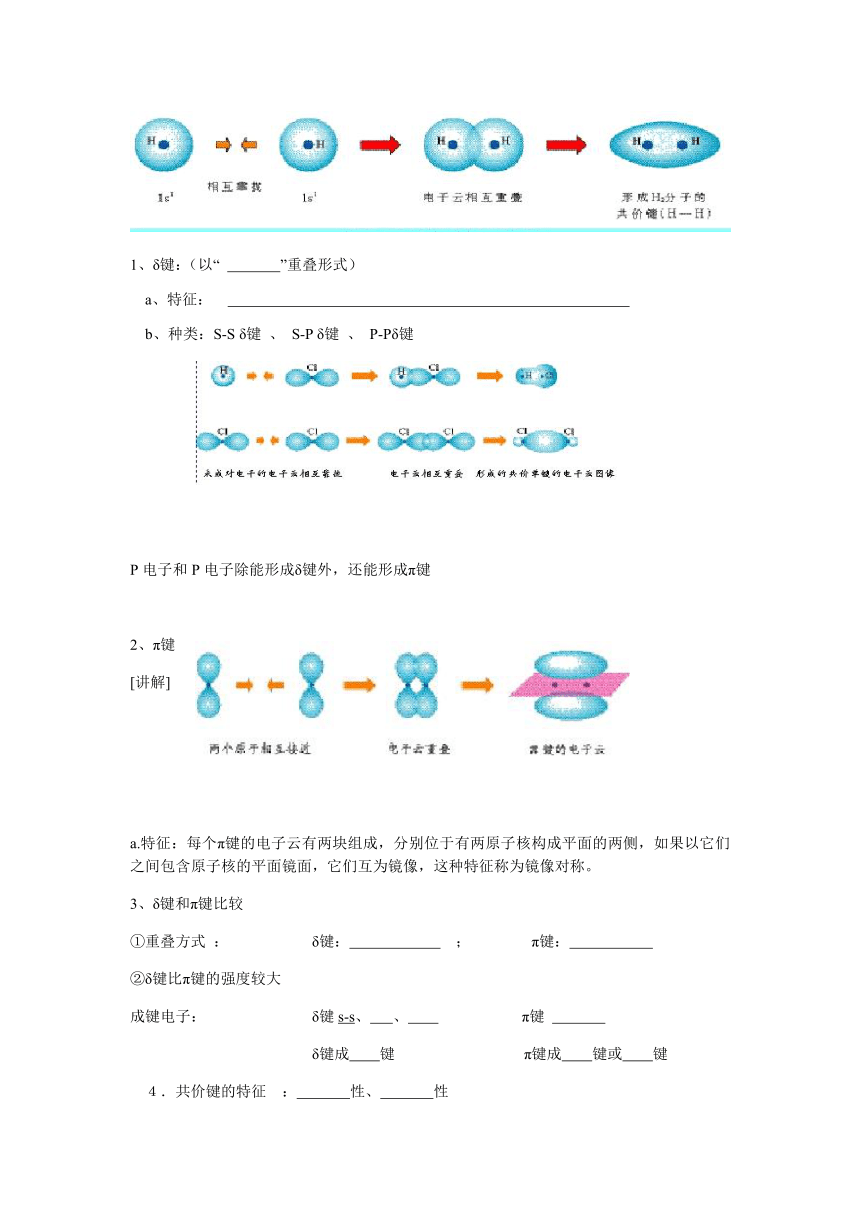
例:H2的形成
1、δ键:(以“
”重叠形式)
a、特征:
b、种类:S-S
δ键
、
S-P
δ键
、
P-Pδ键
P电子和P电子除能形成δ键外,还能形成π键
2、π键
[讲解]
a.特征:每个π键的电子云有两块组成,分别位于有两原子核构成平面的两侧,如果以它们之间包含原子核的平面镜面,它们互为镜像,这种特征称为镜像对称。
3、δ键和π键比较
①重叠方式
:
δ键:
;
π键:
②δ键比π键的强度较大
成键电子:
δ键s-s、
、
π键
δ键成
键
π键成
键或
键
4.共价键的特征
:
性、
性
[小结]
【案例练习】
1、下列各组物质中,所有化学键都是共价键的是(
)
A.H2S和Na2O2
B.H2O2和CaF2
C.NH3和N2
D.HNO3和NaCl
2.对δ键的认识不正确的是(
)
A.δ键不属于共价键,是另一种化学键
B.S-Sδ键与S-Pδ键的对称性相同
C.分子中含有共价键,则至少含有一个δ键
D.含有π键的化合物与只含δ键的化合物的化学性质不同
3、乙烯分子中C-C之间有
个σ键,
个π键。乙烯易发生加成反应是因为分子中C-C之间的一个
键易断裂。
【课后作业】
1、下列分子中存在π键的是(
)
A.H2
B.Cl2
C.N2
D.HCl
2、下列说法中,正确的是
A.在N2分子中,两个原子的总键能是单个键能的三倍
B.N2分子中有一个σ键、两个π键
C.N2分子中有两个个σ键、一个π键
D.N2分子中存在一个σ键、一个π键
3、下列分子中,含有非极性键的化合物的是
A.H2
B.CO2
C.H2O
D.C2H4
4、在HCl分子中,由H原子的一个
轨道与Cl原子的一个
轨道形成一个
键;在Cl2分子中两个Cl原子以
轨道形成一个
键。
第一节
共价键(第二课时)
教学目标:
1、认识键能、键长、键角等键参数的概念
2、能用键参数――键能、键长、键角说明简单分子的某些性质
3、知道等电子原理,结合实例说明“等电子原理的应用”
教学难点、重点:键参数的概念,等电子原理
课前预习:
1、键参数通常包括
、
与
2、等电子原理的概念:
3、互为等电子体的物质其
(填“物理”或“化学”,下同)性质相近,而
性质差异较大。
学习过程
N2与H2在常温下很难反应,必须在高温下才能发生反应,而F2与H2在冷暗处就能发生化学反应,为什么?
[讨论]
二、键参数
1.键能
①概念:
②单位:
[阅读书33页,表2-1]
1、键能大小与键的强度的关系?
2、键能与化学反应的能量变化的关系?
2.键长
①概念:
②单位:
③键长越短,共价键越
,形成的物质越
多原子分子的形状如何?就必须要了解多原子分子中两共价键之间的夹角。
3.键角:
例如:CO2结构为O=C=O,键角为
°,为
形分子。
H2O 键角105°V形
CH4 键角109°28′正四面体
[小结]
键能、键长、键角是共价键的三个参数
键能、键长决定了共价键的稳定性;键长、键角决定了分子的空间构型。
[板书]
三、等电子原理
1.等电子体:
如:CO和N2,CH4和NH4+
2.等电子体性质相似
[阅读课本表2-3]
[小结]
【案例练习】
1、下列各说法中正确的是
( )
A.分子中键能越高,键长越大,则分子越稳定
B.元素周期表中的ⅠA族(除H外)和ⅦA族元素的原子间不能形成共价键
C.水分子可表示为HO—H,分子中键角为180°
D.H—O键键能为463KJ/mol,即18克H2O分解成H2和O2时,消耗能量为2×463KJ
2.下列说法中,错误的是
( )
A.键长越长,化学键越牢固
B.成键原子间原子轨道重叠越多,共价键越牢固
C.对双原子分子来讲,键能越大,含有该键的分子越稳定
D.原子间通过共用电子对所形成的化学键叫共价键
3、下列分子中键角最大的是
( )
A.CH4
B.NH3
C.H2O
D.CO2
4.与NO3-互为等电子体的是( )
A.SO3
B.BF3
C.CH4
D.NO2
5.由课本表2-1可知.H-H的键能为436kJ/mol.它所表示的意义是___________.如果要使1molH2分解为2molH原子,你认为是吸收能量还是放出能量?____.能量数值____.当两个原子形成共价键时,原子轨道重叠的程度越大,共价键的键能____,两原子核间的平均距离――键长____.
【课后作业】
1、下列说法中正确的是
( )
A.双原子分子中化学键键能越大,分子越牢固
B.双原子分子中化学键键长越长,分子越牢固
C.双原子分子中化学键键角越大,分子越牢固
D.在同一分子中,σ键要比π键的分子轨道重叠程度一样多,只是重叠的方向不同
2、下列物质属于等电子体一组的是( )
A.CH4和NH4+
B.B3H6N3和C6H6
C.F-和Mg
D.H2O和CH4
3、三氯化磷分子的空间构型是三角锥形而不是平面正三角形,下列关于三氯化磷分子空间构型理由的叙述,不正确的是
( )
A.PCl3分子中三个共价键的键长,键角都相等
B.PCl3分子中的P-Cl键属于极性共价键
C.PCl3分子中三个共价键键能,键角均相等
D.PCl3是非极性分子
4、下列单质分子中,键长最长,键能最小的是( )
A.H2
B.Cl2
C.Br2
D.I2
分子结构与性质
第一节
共价键(第一课时)
教学目标:
1、复习化学键的概念,能用电子式表示常见物质的离子键或共价键的形成过程。
2、知道共价键的主要类型δ键和π键。
3、说出δ键和π键的明显差别和一般规律。
教学重点、难点:价层电子对互斥模型
课前预习:
1、共价键是常见化学键之一,它是指
其本质是
。
2、
判断δ键和π键的一般规律是:共价单键是
键;而共价双键中有
个δ键,共价三键中有
个δ键,其余为π键。
学习过程
[引入]
NaCl、HCl的形成过程
前面学习了电子云和轨道理论,对于HCl中H、Cl原子形成共价键时,电子云如何重叠?
例:H2的形成
1、δ键:(以“
”重叠形式)
a、特征:
b、种类:S-S
δ键
、
S-P
δ键
、
P-Pδ键
P电子和P电子除能形成δ键外,还能形成π键
2、π键
[讲解]
a.特征:每个π键的电子云有两块组成,分别位于有两原子核构成平面的两侧,如果以它们之间包含原子核的平面镜面,它们互为镜像,这种特征称为镜像对称。
3、δ键和π键比较
①重叠方式
:
δ键:
;
π键:
②δ键比π键的强度较大
成键电子:
δ键s-s、
、
π键
δ键成
键
π键成
键或
键
4.共价键的特征
:
性、
性
[小结]
【案例练习】
1、下列各组物质中,所有化学键都是共价键的是(
)
A.H2S和Na2O2
B.H2O2和CaF2
C.NH3和N2
D.HNO3和NaCl
2.对δ键的认识不正确的是(
)
A.δ键不属于共价键,是另一种化学键
B.S-Sδ键与S-Pδ键的对称性相同
C.分子中含有共价键,则至少含有一个δ键
D.含有π键的化合物与只含δ键的化合物的化学性质不同
3、乙烯分子中C-C之间有
个σ键,
个π键。乙烯易发生加成反应是因为分子中C-C之间的一个
键易断裂。
【课后作业】
1、下列分子中存在π键的是(
)
A.H2
B.Cl2
C.N2
D.HCl
2、下列说法中,正确的是
A.在N2分子中,两个原子的总键能是单个键能的三倍
B.N2分子中有一个σ键、两个π键
C.N2分子中有两个个σ键、一个π键
D.N2分子中存在一个σ键、一个π键
3、下列分子中,含有非极性键的化合物的是
A.H2
B.CO2
C.H2O
D.C2H4
4、在HCl分子中,由H原子的一个
轨道与Cl原子的一个
轨道形成一个
键;在Cl2分子中两个Cl原子以
轨道形成一个
键。
第一节
共价键(第二课时)
教学目标:
1、认识键能、键长、键角等键参数的概念
2、能用键参数――键能、键长、键角说明简单分子的某些性质
3、知道等电子原理,结合实例说明“等电子原理的应用”
教学难点、重点:键参数的概念,等电子原理
课前预习:
1、键参数通常包括
、
与
2、等电子原理的概念:
3、互为等电子体的物质其
(填“物理”或“化学”,下同)性质相近,而
性质差异较大。
学习过程
N2与H2在常温下很难反应,必须在高温下才能发生反应,而F2与H2在冷暗处就能发生化学反应,为什么?
[讨论]
二、键参数
1.键能
①概念:
②单位:
[阅读书33页,表2-1]
1、键能大小与键的强度的关系?
2、键能与化学反应的能量变化的关系?
2.键长
①概念:
②单位:
③键长越短,共价键越
,形成的物质越
多原子分子的形状如何?就必须要了解多原子分子中两共价键之间的夹角。
3.键角:
例如:CO2结构为O=C=O,键角为
°,为
形分子。
H2O 键角105°V形
CH4 键角109°28′正四面体
[小结]
键能、键长、键角是共价键的三个参数
键能、键长决定了共价键的稳定性;键长、键角决定了分子的空间构型。
[板书]
三、等电子原理
1.等电子体:
如:CO和N2,CH4和NH4+
2.等电子体性质相似
[阅读课本表2-3]
[小结]
【案例练习】
1、下列各说法中正确的是
( )
A.分子中键能越高,键长越大,则分子越稳定
B.元素周期表中的ⅠA族(除H外)和ⅦA族元素的原子间不能形成共价键
C.水分子可表示为HO—H,分子中键角为180°
D.H—O键键能为463KJ/mol,即18克H2O分解成H2和O2时,消耗能量为2×463KJ
2.下列说法中,错误的是
( )
A.键长越长,化学键越牢固
B.成键原子间原子轨道重叠越多,共价键越牢固
C.对双原子分子来讲,键能越大,含有该键的分子越稳定
D.原子间通过共用电子对所形成的化学键叫共价键
3、下列分子中键角最大的是
( )
A.CH4
B.NH3
C.H2O
D.CO2
4.与NO3-互为等电子体的是( )
A.SO3
B.BF3
C.CH4
D.NO2
5.由课本表2-1可知.H-H的键能为436kJ/mol.它所表示的意义是___________.如果要使1molH2分解为2molH原子,你认为是吸收能量还是放出能量?____.能量数值____.当两个原子形成共价键时,原子轨道重叠的程度越大,共价键的键能____,两原子核间的平均距离――键长____.
【课后作业】
1、下列说法中正确的是
( )
A.双原子分子中化学键键能越大,分子越牢固
B.双原子分子中化学键键长越长,分子越牢固
C.双原子分子中化学键键角越大,分子越牢固
D.在同一分子中,σ键要比π键的分子轨道重叠程度一样多,只是重叠的方向不同
2、下列物质属于等电子体一组的是( )
A.CH4和NH4+
B.B3H6N3和C6H6
C.F-和Mg
D.H2O和CH4
3、三氯化磷分子的空间构型是三角锥形而不是平面正三角形,下列关于三氯化磷分子空间构型理由的叙述,不正确的是
( )
A.PCl3分子中三个共价键的键长,键角都相等
B.PCl3分子中的P-Cl键属于极性共价键
C.PCl3分子中三个共价键键能,键角均相等
D.PCl3是非极性分子
4、下列单质分子中,键长最长,键能最小的是( )
A.H2
B.Cl2
C.Br2
D.I2
