人教版高中化学必修二1.3 化学键-课件(共20张PPT)
文档属性
| 名称 | 人教版高中化学必修二1.3 化学键-课件(共20张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 407.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-06 17:08:27 | ||
图片预览








文档简介
(共20张PPT)
第三节
化学键
必修二
第一章
物质结构
元素周期律
Q1-1
初中化学中曾经讨论过的化学反应的
实质是什么?请以
2H2
+
O2
=2H2O为例说明。
【复习】
Q1-2?
氢气在氧气中的燃烧是放热反应,但
这个反应只有在点燃的条件下才能发生,请
你猜测一下,这是为什么?
构成物质分子的原子重新组合成新的分子。
【复习】
根据图片信息,从微观的角度思考:
水的沸腾
条件:加热到1000C
水的分解
条件:通电或加热到20000C
Q2-1
水分解成氢气和氧气时为什么要吸收热量?
Q2-2?
液态水变成水蒸气时要吸收热量,这些能
量的作用是什么?
Q2-3
这两组数据说明了什么?
A?
NaCl是怎样如何形成的?
原子在周期表中位置
宏观物质:
微观粒子
剧烈燃烧,黄色火焰,产生大量白烟
钠、氯气
化学方程式:
现
象:
宏观物质:
为了方便起见,我们在元素符号的周围用“?”或“x”来表示原子的最外层电子,这种式子叫做电子式
Q3-1?
Na原子与Cl原子是怎样形成氯化钠?
用电子式表示NaCl形成过程:
Q4-1
NaCl是由什么粒子组成?
Q4-2
相反电荷的离子之间存在什么作用呢?
带相反电荷离子之间的相互作用称为离子键
由离子键构成的化合物叫做离子化合物
(只要含有离子键的化合物就属于离子化合物)
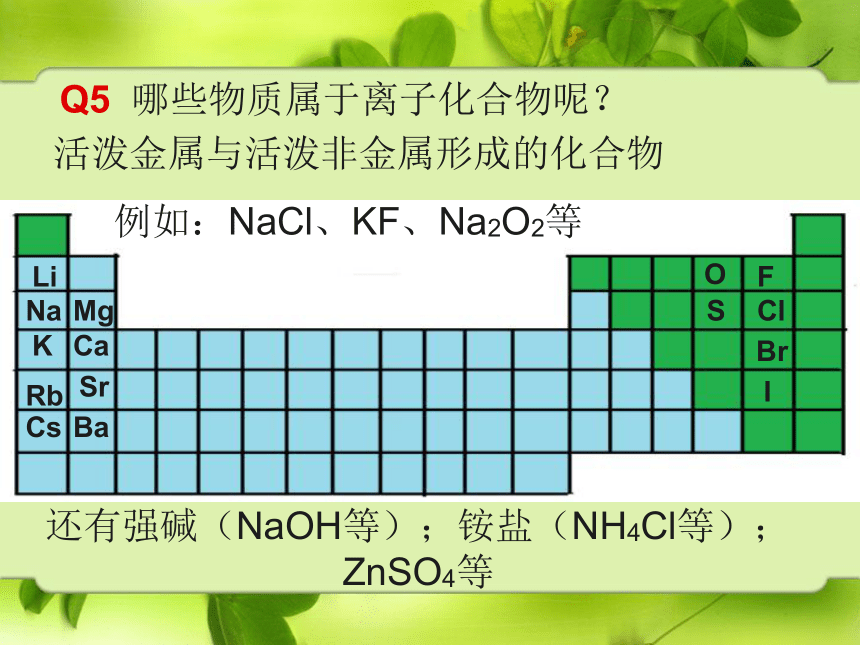
Q5
哪些物质属于离子化合物呢?
活泼金属与活泼非金属形成的化合物
例如:NaCl、KF、Na2O2等
还有强碱(NaOH等);铵盐(NH4Cl等);ZnSO4等
用电子式表示了NaCl的形成过程,还可以表示其它离子化合物的形成过程,试着用电子式表示MgBr2的形成过程。
再用电子式表示Na2S的形成过程
写出下列物质的电子式
NaCl、MgBr2、Na2S、Na2O2、NaOH、NH4Cl
【思
考】
B?
HCl是如何形成的?
Q6?
在Na2O2、NaOH、NH4Cl中,除含有离子键还包含什么作用?
【知识回顾】
Q1-1?
什么是离子键?
Q1-2?
用电子式表示出NaCl、MgBr2、Na2S的形成过程?
用电子式表示出HCl的形成过程
用电子式表示出H2、Cl2的形成过程
Q2
分析H和Cl的原子结构,你认为H2、Cl2、HCl的形成与氯化钠会是一样的吗?
【思考与交流】
你能用电子式表示出H2O的形成过程吗?
练习:
HClO
H2O2
NaOH
NH4Cl
写出以下物质的电子式。
H2
HCl
Cl2
NaBr
你能用电子式表示下列物质的形成过程吗?
练习:
Q3
在H2、Cl2中存在的共价键与在HCl、H2O中存在的共价键有何不同?
不同种原子之间形成
同种原子之间形成
极性键
非极性键
共价键
【思考与交流】
Q4
离子化合物与共价化合物有什么区别?
下列说法中正确的是(
)
A
含有共价键的化合物一定是共价化合物
B
只含有共价键的物质一定是共价化合物
C
离子化合物中可能含有极性共价键或非极性共价键
D
全部由非金属元素组成的化合物一定是共价化合物
C
Q5
现在你对化学反应的实质又有
怎样的认识的?
【思考题】
1、在Na2O2、NaOH、NH4Cl
中,除含有离子键还包含什么作用?
2、HCl是如何形成的?
用化学键的观点来解释H2和Cl2的反应过程。
共价键与离子键的比较
两种相同或不同的非金属
活泼金属与活泼非金属
原
子
阴、阳离子
形成共用电子对
静电作用
项目
类型
共价键
离子键
成键元素
成键粒子
成键本质
化合物电子式
【科学视野】
分子间作用力和氢键
一、分子间作用力(范德华力)
对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,熔沸点也越高。
本质:分子间的静电作用
观察右图,思考:
同主族元素的氢化物的沸点有何特点?
二、氢键
比分子间作用力强,但比化学键弱,也可以看做是一种较强的分子间作用力。
氢键会使物质的熔沸点升高。
本质:分子间的静电作用
第三节
化学键
必修二
第一章
物质结构
元素周期律
Q1-1
初中化学中曾经讨论过的化学反应的
实质是什么?请以
2H2
+
O2
=2H2O为例说明。
【复习】
Q1-2?
氢气在氧气中的燃烧是放热反应,但
这个反应只有在点燃的条件下才能发生,请
你猜测一下,这是为什么?
构成物质分子的原子重新组合成新的分子。
【复习】
根据图片信息,从微观的角度思考:
水的沸腾
条件:加热到1000C
水的分解
条件:通电或加热到20000C
Q2-1
水分解成氢气和氧气时为什么要吸收热量?
Q2-2?
液态水变成水蒸气时要吸收热量,这些能
量的作用是什么?
Q2-3
这两组数据说明了什么?
A?
NaCl是怎样如何形成的?
原子在周期表中位置
宏观物质:
微观粒子
剧烈燃烧,黄色火焰,产生大量白烟
钠、氯气
化学方程式:
现
象:
宏观物质:
为了方便起见,我们在元素符号的周围用“?”或“x”来表示原子的最外层电子,这种式子叫做电子式
Q3-1?
Na原子与Cl原子是怎样形成氯化钠?
用电子式表示NaCl形成过程:
Q4-1
NaCl是由什么粒子组成?
Q4-2
相反电荷的离子之间存在什么作用呢?
带相反电荷离子之间的相互作用称为离子键
由离子键构成的化合物叫做离子化合物
(只要含有离子键的化合物就属于离子化合物)
Q5
哪些物质属于离子化合物呢?
活泼金属与活泼非金属形成的化合物
例如:NaCl、KF、Na2O2等
还有强碱(NaOH等);铵盐(NH4Cl等);ZnSO4等
用电子式表示了NaCl的形成过程,还可以表示其它离子化合物的形成过程,试着用电子式表示MgBr2的形成过程。
再用电子式表示Na2S的形成过程
写出下列物质的电子式
NaCl、MgBr2、Na2S、Na2O2、NaOH、NH4Cl
【思
考】
B?
HCl是如何形成的?
Q6?
在Na2O2、NaOH、NH4Cl中,除含有离子键还包含什么作用?
【知识回顾】
Q1-1?
什么是离子键?
Q1-2?
用电子式表示出NaCl、MgBr2、Na2S的形成过程?
用电子式表示出HCl的形成过程
用电子式表示出H2、Cl2的形成过程
Q2
分析H和Cl的原子结构,你认为H2、Cl2、HCl的形成与氯化钠会是一样的吗?
【思考与交流】
你能用电子式表示出H2O的形成过程吗?
练习:
HClO
H2O2
NaOH
NH4Cl
写出以下物质的电子式。
H2
HCl
Cl2
NaBr
你能用电子式表示下列物质的形成过程吗?
练习:
Q3
在H2、Cl2中存在的共价键与在HCl、H2O中存在的共价键有何不同?
不同种原子之间形成
同种原子之间形成
极性键
非极性键
共价键
【思考与交流】
Q4
离子化合物与共价化合物有什么区别?
下列说法中正确的是(
)
A
含有共价键的化合物一定是共价化合物
B
只含有共价键的物质一定是共价化合物
C
离子化合物中可能含有极性共价键或非极性共价键
D
全部由非金属元素组成的化合物一定是共价化合物
C
Q5
现在你对化学反应的实质又有
怎样的认识的?
【思考题】
1、在Na2O2、NaOH、NH4Cl
中,除含有离子键还包含什么作用?
2、HCl是如何形成的?
用化学键的观点来解释H2和Cl2的反应过程。
共价键与离子键的比较
两种相同或不同的非金属
活泼金属与活泼非金属
原
子
阴、阳离子
形成共用电子对
静电作用
项目
类型
共价键
离子键
成键元素
成键粒子
成键本质
化合物电子式
【科学视野】
分子间作用力和氢键
一、分子间作用力(范德华力)
对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,熔沸点也越高。
本质:分子间的静电作用
观察右图,思考:
同主族元素的氢化物的沸点有何特点?
二、氢键
比分子间作用力强,但比化学键弱,也可以看做是一种较强的分子间作用力。
氢键会使物质的熔沸点升高。
本质:分子间的静电作用
