沪科版高中化学高二下册-12.1 杜康酿酒话乙醇—乙醇 教案
文档属性
| 名称 | 沪科版高中化学高二下册-12.1 杜康酿酒话乙醇—乙醇 教案 |

|
|
| 格式 | zip | ||
| 文件大小 | 76.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-08 15:27:33 | ||
图片预览

文档简介
乙醇的教学设计
一
、教学设计思路分析
1.教材分析
学好本节内容对下一课时学习生活中的另外一种常见的有机物《乙酸》以及其它烃的衍生物具有指导性的作用。同时它也是与生产、生活、社会密切联系的典型的烃的衍生物。因此,本节内容是全章的重点之一。
《普通高中化学课程标准》对本节的要求是:知道乙醇的主要性质,认识其在日常生活中的应用,建议通过探究掌握乙醇的重要化学性质。
2.教学内容组织
本节课的教学内容是选取生活中的典型代表有机物——乙醇,介绍其基本的结构、主要性质以及在生产、生活中的应用,建立有机物“(组成)结构—性质—用途”的认识关系,使学生形成一定的分析和解决问题的能力。
乙醇是与生活、生产联系非常紧密的一种物质,初中已经教授过其分子组成、俗名、物理性质等知识;乙醇是继烃之后重点学习的第一个含氧有机物,是学习有机物中氧原子成键特点的一个重要载体,是对比碳氢键和氢氧键活性的有力例证;对乙醇结构的理解过程也是学生深化同分异构体概念的过程;乙醇是掌握羟基性质的代表物质;乙醇在有机物的相互转化中处于核心地位。因此,本节内容是全章乃至有机物知识的重点之一。
二、
教学设计方案
1)教学目标:
1.知识与技能:
(1)掌握乙醇的分子结构和化学性质。
(2)让学生知道官能团对有机物性质的重要影响,建立“(组成)结构──性质──用途”的有机物学习模式。
(3)使学生了解乙醇在生产生活中的应用及与身体健康的密切关系。
2.过程与方法:
(1)分析乙醇的结构,由结构决定性质去理解乙醇的反应,通过实验探究,比较分析等方法探索乙醇的化学性质。
(2)通过比较乙烷、水和乙醇结构、性质的差异,认识官能团决定有机物的性质。
(3)通过动手实验,提高实验能力、观察能力和对实验现象的分析能力。
3.情感态度价值观:
通过实验探究,体验科学探究成功的喜悦,增强学习化学知识的兴趣;同时培养他们与他人合作的良好心理品质。
2)
教学重点和难点:
教学重点:乙醇结构和化学性质
教学难点:使学生建立乙醇的立体结构模型,并能从结构角度初步认识乙醇的氧化反应
3)
教学方法:
讲授、模型、学生实验探究、观察、对比、归纳、小组合作、讨论等。
为鼓励学生主动学习,培养学生的科学素养,本节主要采用实验探究法,让学生带着问题,动手操作,从实验现象中思考、质疑、讨论,在教师引导下得出结论。整体思路:教师设疑——实验——学生讨论——教师点拨——学生得出结论——教师小结。
4)教学用具:多媒体辅助教具;四氯化碳、无水乙醇、金属钠、铜丝;试管、酒精灯、镊子、小刀、火柴、滤纸等。
三、
教学流程图
四、教学过程:
教学环节
教师活动
学生活动
设计意图
情境引入
展示各种含有酒精的调味品和饮料的图片及有关酒的诗词
观看图片,学生自由回答
创设问题情境,激发学生学习兴趣,引出课题
乙醇的物理性质
引导学生得出乙醇相关物理性质。结合乙醇在生活中的应用。提问:乙醇与前面学习的有机物的物理性质有何不同?为什么?
观察、实验、小结乙醇的物理性质
培养学生的观察、实验能力。用问题激发学生对乙醇分子结构探究的兴趣。
展示乙醇的比例及结构模
型
展示乙醇的比例及结构模型。讲解乙醇分子的重要原子团(官能团):羟基(-OH)。引导学生比较乙醇与乙烷及水在结构上的异同,拆插乙醇分子模型。讲解-C2H5是疏水性原子团,-OH是亲水性原子团,故乙醇既可溶于水,又可溶于有机溶剂。
学生写出乙醇的分子式、结构式及结构简式。分析得出:乙醇分子中存在-C2H5和-OH
加深学生对乙醇分子空间结构的认识。使学生关注到乙醇与乙烷及水在结构上的相似与不同。让学生明白“结构决定性质”。
分析乙醇分子的化学键并预测分子中可能的断键方式
教师提出问题:①乙醇分子中有几种等效氢②乙醇分子中哪些化学键可能发生断裂。
学生分析、讨论得出可能断键的方式
分析乙醇结构为探索乙醇的性质奠定基础。培养学生分析问题的能力。
[实验探究1]钠和乙醇的反应。录像[实验]
水和金属钠
复习金属钠与水的反应。引导学生预测乙醇可能断键的位置及可能出现的现象,并在学生实验的过程中及时指导该探究实验的操作及实验现象观察、分析、记录等。提问:通过钠与乙醇和水对比,说明了什么?
1、描述钠与水的反应实验现象,书写化学方程式2、分组做钠与乙醇的探究实验、观察并分析实验现象
运用类比原理预测乙醇与钠的反应结果,培养学生分析、观察能力。通过引导,使学生认识到烃基对-OH产生了影响。
落实化学反应方程式
提问:1.根据实验现象完成乙醇与钠的反应方程式,指出反应类型。2.如何检验生成的气体是氢气?
书写化学方程式:2Na+2C2H5OH→H2↑+
2C2H5ONa
落实基础知识
实验2:无水乙醇的催化氧化
教师提问,乙醇能与氧气反应吗?如果可以,请你举例。布置学生实验:现在我们探讨在改变实验条件的情况下,乙醇与氧气的反应现象及反应产物。
学生回答:乙醇与氧气的燃烧反应。分组实验:向试管中注入约2ml无水乙醇,取一根光洁的铜丝绕成螺旋状,放在酒精灯外焰加热,然后再伸入无水乙醇中,反复几次,观察铜丝的变化并闻液体的气味。
将乙醇的燃烧与催化氧化放在一起,引导学生分析反应的异同点,关注反应条件不同带来的产物不同。
分析乙醇催化氧化的过程
提问:铜丝颜色有何变化?液体的气味有何变化?教师边讲解边板书:2Cu+O22CuO2CH3CH2OH+O22CH3CHO+2H2O
回答:铜丝加热后变黑,伸入乙醇中变红色,闻到刺激性气味气体。观看乙醇催化氧化的Flash动画,并书写反应的化学方程式
从乙醇的结构出发理解乙醇的催化氧化的反应过程,同时加深对催化剂概念的认识。
对比乙醇燃烧与催化氧化反应的异同
问题:乙醇燃烧与催化氧化反应,碳元素的化合价有何变化?两反应有何异同?
思考讨论小结
提出有机反应中氧化反应的概念
身边的化学
1、乙醇在人体中的代谢机理及对人体的影响。2、
酒后驾车的检测。
观看图片并讨论乙醇对人体及社会的利与弊
对学生进行交通法规,健康保健及商业道德进行教育
乙醇的用途
提问:除了做调味品和饮料,你还知道乙醇在生活中还有哪些用途吗?
学生总结归纳乙醇的用途
使学生理解性质决定用途,了解酒精汽油的优点,加强学生的环保及节能意识。
课堂小结
【投影】通过本节课的学习,你学到了哪些新的知识??
学生整理归纳
培养学生总结问题的能力
随堂检测
下列关于乙醇的说法中,正确的是(
)
A.1mol乙醇与足量的钠反应可以生成3mol的
氢气
B.乙醇与水的混合物可以用分液漏斗分离
C.乙醇分子中羟基上的氢原子不如水分子中羟基上的氢原子活泼
D.乙醇在燃烧反应和催化氧化反应中,断键的位置相同。
练习
知识巩固
布置作业
1.请你设计实验验证乙醇与钠反应,断O-H键,而不是断C-H健;2.查阅工业酒精中毒事件的有关资料,谈谈工业酒精对人体的危害。
提高学生对知识的应用能力;培养学生关注社会的意识,对学生进行商业道德教育。
五、板书设计:
乙醇
1、
乙醇的物理性质:
无色、透明,具有特殊香味的液体,密度小于水,与水以任意比互溶,能溶解多种无机化合物和有机物,易挥发。
2、
乙醇的结构
化学式:
C2H6O
结构式:
结构简式:CH3CH2OH
或
C2H5
OH
官能团:-OH
(羟基)
3、
化学性质:
1、与金属的反应
2、氧化反应:
(1)
点燃:
(2)
催化氧化:
4、
乙醇的应用:
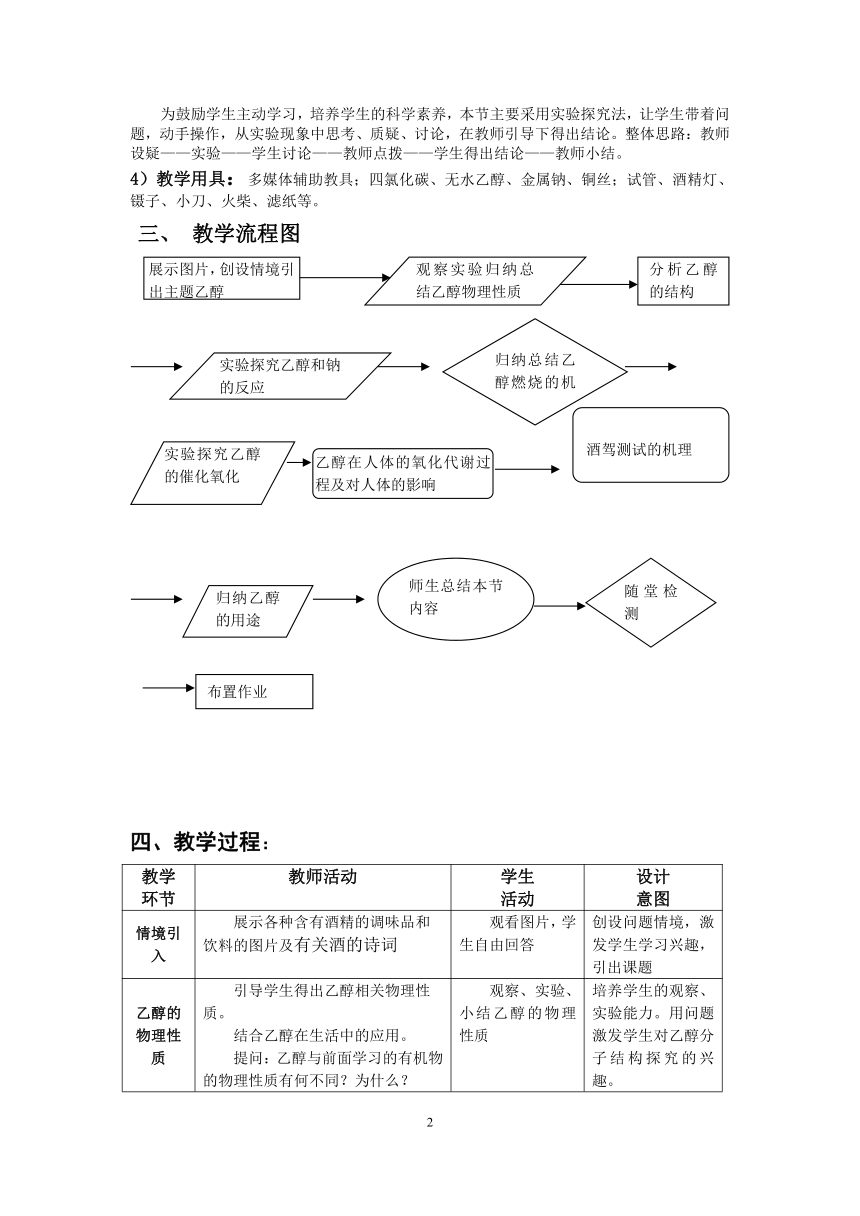
展示图片,创设情境引出主题乙醇
观察实验归纳总结乙醇物理性质
分析乙醇的结构
实验探究乙醇和钠的反应
归纳总结乙醇燃烧的机理和应用
实验探究乙醇的催化氧化
乙醇在人体的氧化代谢过程及对人体的影响
酒驾测试的机理
归纳乙醇的用途
师生总结本节内容
随堂检测
布置作业
2C2H5OH
+2
Na
2CH3CH2ONa
+
H2
C2H5
OH
+
3
O2
2CO2
+3H2O
点燃
2CH3CH2OH+O2
2
CH3CHO+2H2O
催化剂
5
一
、教学设计思路分析
1.教材分析
学好本节内容对下一课时学习生活中的另外一种常见的有机物《乙酸》以及其它烃的衍生物具有指导性的作用。同时它也是与生产、生活、社会密切联系的典型的烃的衍生物。因此,本节内容是全章的重点之一。
《普通高中化学课程标准》对本节的要求是:知道乙醇的主要性质,认识其在日常生活中的应用,建议通过探究掌握乙醇的重要化学性质。
2.教学内容组织
本节课的教学内容是选取生活中的典型代表有机物——乙醇,介绍其基本的结构、主要性质以及在生产、生活中的应用,建立有机物“(组成)结构—性质—用途”的认识关系,使学生形成一定的分析和解决问题的能力。
乙醇是与生活、生产联系非常紧密的一种物质,初中已经教授过其分子组成、俗名、物理性质等知识;乙醇是继烃之后重点学习的第一个含氧有机物,是学习有机物中氧原子成键特点的一个重要载体,是对比碳氢键和氢氧键活性的有力例证;对乙醇结构的理解过程也是学生深化同分异构体概念的过程;乙醇是掌握羟基性质的代表物质;乙醇在有机物的相互转化中处于核心地位。因此,本节内容是全章乃至有机物知识的重点之一。
二、
教学设计方案
1)教学目标:
1.知识与技能:
(1)掌握乙醇的分子结构和化学性质。
(2)让学生知道官能团对有机物性质的重要影响,建立“(组成)结构──性质──用途”的有机物学习模式。
(3)使学生了解乙醇在生产生活中的应用及与身体健康的密切关系。
2.过程与方法:
(1)分析乙醇的结构,由结构决定性质去理解乙醇的反应,通过实验探究,比较分析等方法探索乙醇的化学性质。
(2)通过比较乙烷、水和乙醇结构、性质的差异,认识官能团决定有机物的性质。
(3)通过动手实验,提高实验能力、观察能力和对实验现象的分析能力。
3.情感态度价值观:
通过实验探究,体验科学探究成功的喜悦,增强学习化学知识的兴趣;同时培养他们与他人合作的良好心理品质。
2)
教学重点和难点:
教学重点:乙醇结构和化学性质
教学难点:使学生建立乙醇的立体结构模型,并能从结构角度初步认识乙醇的氧化反应
3)
教学方法:
讲授、模型、学生实验探究、观察、对比、归纳、小组合作、讨论等。
为鼓励学生主动学习,培养学生的科学素养,本节主要采用实验探究法,让学生带着问题,动手操作,从实验现象中思考、质疑、讨论,在教师引导下得出结论。整体思路:教师设疑——实验——学生讨论——教师点拨——学生得出结论——教师小结。
4)教学用具:多媒体辅助教具;四氯化碳、无水乙醇、金属钠、铜丝;试管、酒精灯、镊子、小刀、火柴、滤纸等。
三、
教学流程图
四、教学过程:
教学环节
教师活动
学生活动
设计意图
情境引入
展示各种含有酒精的调味品和饮料的图片及有关酒的诗词
观看图片,学生自由回答
创设问题情境,激发学生学习兴趣,引出课题
乙醇的物理性质
引导学生得出乙醇相关物理性质。结合乙醇在生活中的应用。提问:乙醇与前面学习的有机物的物理性质有何不同?为什么?
观察、实验、小结乙醇的物理性质
培养学生的观察、实验能力。用问题激发学生对乙醇分子结构探究的兴趣。
展示乙醇的比例及结构模
型
展示乙醇的比例及结构模型。讲解乙醇分子的重要原子团(官能团):羟基(-OH)。引导学生比较乙醇与乙烷及水在结构上的异同,拆插乙醇分子模型。讲解-C2H5是疏水性原子团,-OH是亲水性原子团,故乙醇既可溶于水,又可溶于有机溶剂。
学生写出乙醇的分子式、结构式及结构简式。分析得出:乙醇分子中存在-C2H5和-OH
加深学生对乙醇分子空间结构的认识。使学生关注到乙醇与乙烷及水在结构上的相似与不同。让学生明白“结构决定性质”。
分析乙醇分子的化学键并预测分子中可能的断键方式
教师提出问题:①乙醇分子中有几种等效氢②乙醇分子中哪些化学键可能发生断裂。
学生分析、讨论得出可能断键的方式
分析乙醇结构为探索乙醇的性质奠定基础。培养学生分析问题的能力。
[实验探究1]钠和乙醇的反应。录像[实验]
水和金属钠
复习金属钠与水的反应。引导学生预测乙醇可能断键的位置及可能出现的现象,并在学生实验的过程中及时指导该探究实验的操作及实验现象观察、分析、记录等。提问:通过钠与乙醇和水对比,说明了什么?
1、描述钠与水的反应实验现象,书写化学方程式2、分组做钠与乙醇的探究实验、观察并分析实验现象
运用类比原理预测乙醇与钠的反应结果,培养学生分析、观察能力。通过引导,使学生认识到烃基对-OH产生了影响。
落实化学反应方程式
提问:1.根据实验现象完成乙醇与钠的反应方程式,指出反应类型。2.如何检验生成的气体是氢气?
书写化学方程式:2Na+2C2H5OH→H2↑+
2C2H5ONa
落实基础知识
实验2:无水乙醇的催化氧化
教师提问,乙醇能与氧气反应吗?如果可以,请你举例。布置学生实验:现在我们探讨在改变实验条件的情况下,乙醇与氧气的反应现象及反应产物。
学生回答:乙醇与氧气的燃烧反应。分组实验:向试管中注入约2ml无水乙醇,取一根光洁的铜丝绕成螺旋状,放在酒精灯外焰加热,然后再伸入无水乙醇中,反复几次,观察铜丝的变化并闻液体的气味。
将乙醇的燃烧与催化氧化放在一起,引导学生分析反应的异同点,关注反应条件不同带来的产物不同。
分析乙醇催化氧化的过程
提问:铜丝颜色有何变化?液体的气味有何变化?教师边讲解边板书:2Cu+O22CuO2CH3CH2OH+O22CH3CHO+2H2O
回答:铜丝加热后变黑,伸入乙醇中变红色,闻到刺激性气味气体。观看乙醇催化氧化的Flash动画,并书写反应的化学方程式
从乙醇的结构出发理解乙醇的催化氧化的反应过程,同时加深对催化剂概念的认识。
对比乙醇燃烧与催化氧化反应的异同
问题:乙醇燃烧与催化氧化反应,碳元素的化合价有何变化?两反应有何异同?
思考讨论小结
提出有机反应中氧化反应的概念
身边的化学
1、乙醇在人体中的代谢机理及对人体的影响。2、
酒后驾车的检测。
观看图片并讨论乙醇对人体及社会的利与弊
对学生进行交通法规,健康保健及商业道德进行教育
乙醇的用途
提问:除了做调味品和饮料,你还知道乙醇在生活中还有哪些用途吗?
学生总结归纳乙醇的用途
使学生理解性质决定用途,了解酒精汽油的优点,加强学生的环保及节能意识。
课堂小结
【投影】通过本节课的学习,你学到了哪些新的知识??
学生整理归纳
培养学生总结问题的能力
随堂检测
下列关于乙醇的说法中,正确的是(
)
A.1mol乙醇与足量的钠反应可以生成3mol的
氢气
B.乙醇与水的混合物可以用分液漏斗分离
C.乙醇分子中羟基上的氢原子不如水分子中羟基上的氢原子活泼
D.乙醇在燃烧反应和催化氧化反应中,断键的位置相同。
练习
知识巩固
布置作业
1.请你设计实验验证乙醇与钠反应,断O-H键,而不是断C-H健;2.查阅工业酒精中毒事件的有关资料,谈谈工业酒精对人体的危害。
提高学生对知识的应用能力;培养学生关注社会的意识,对学生进行商业道德教育。
五、板书设计:
乙醇
1、
乙醇的物理性质:
无色、透明,具有特殊香味的液体,密度小于水,与水以任意比互溶,能溶解多种无机化合物和有机物,易挥发。
2、
乙醇的结构
化学式:
C2H6O
结构式:
结构简式:CH3CH2OH
或
C2H5
OH
官能团:-OH
(羟基)
3、
化学性质:
1、与金属的反应
2、氧化反应:
(1)
点燃:
(2)
催化氧化:
4、
乙醇的应用:
展示图片,创设情境引出主题乙醇
观察实验归纳总结乙醇物理性质
分析乙醇的结构
实验探究乙醇和钠的反应
归纳总结乙醇燃烧的机理和应用
实验探究乙醇的催化氧化
乙醇在人体的氧化代谢过程及对人体的影响
酒驾测试的机理
归纳乙醇的用途
师生总结本节内容
随堂检测
布置作业
2C2H5OH
+2
Na
2CH3CH2ONa
+
H2
C2H5
OH
+
3
O2
2CO2
+3H2O
点燃
2CH3CH2OH+O2
2
CH3CHO+2H2O
催化剂
5
