科粤版九年级下册化学《 第六章 金属 6.2 金属的化学性质》课件 (共23张PPT)
文档属性
| 名称 | 科粤版九年级下册化学《 第六章 金属 6.2 金属的化学性质》课件 (共23张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-07 17:32:30 | ||
图片预览







文档简介
(共23张PPT)
6.2
金属的化学性质
黄铜是铜、锌合金,由于其外观与黄金相似,常被不法商贩用来冒充黄金牟取暴利,你知道哪些方法可以鉴别黄铜和黄金?
活动一:金属跟氧气的反应
火星四射,放出大量的热,生成黑色固体。
发出白光,放热,生成白色粉末状固体。
由红色变成黑色。
镁比铜活泼
结论:许多金属都能跟氧气反应,生成氧化物。
镁比铁活泼
思考:是不是所有金属都与氧气反应?
提示:真金不怕火炼
实
验
现
象
化学方程式
活泼性比较
镁在空气中燃烧
?
铁丝在氧气中燃烧
铜在酒精灯上加热
“真金不怕火炼”
你知道吗?
“真金不怕火炼”说明了金既使在高温下也不与氧气反应。由此可见,并不是所有金属都与氧气反应,除金外,银、铂等金属也不能与氧气反应。
早在16世纪中叶,瑞士化学家帕拉赛斯就发现,有些金属和酸可以反应生成一种可燃性气体—氢气。并且发现不同的金属与酸反应时的剧烈程度不同。
活动二:金属与稀盐酸(或稀硫酸)反应
铝跟稀盐酸反应
铁跟稀盐酸反应
铜跟稀盐酸反应
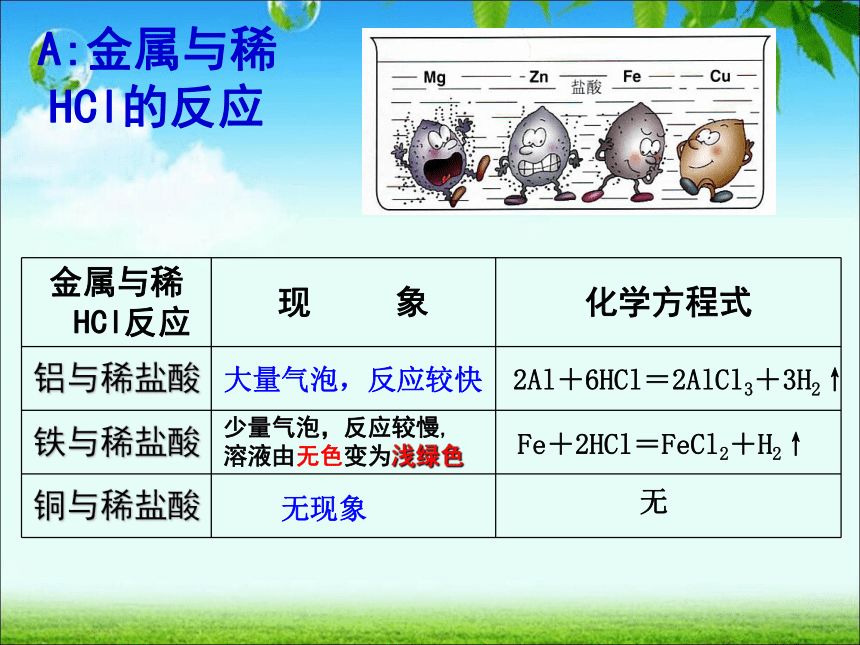
A:金属与稀HCl的反应
大量气泡,反应较快
少量气泡,反应较慢,溶液由无色变为浅绿色
无现象
2Al+6HCl=2AlCl3+3H2↑
Fe+2HCl=FeCl2+H2↑
无
金属与稀HCl反应
现
象
化学方程式
铝与稀盐酸
铁与稀盐酸
铜与稀盐酸
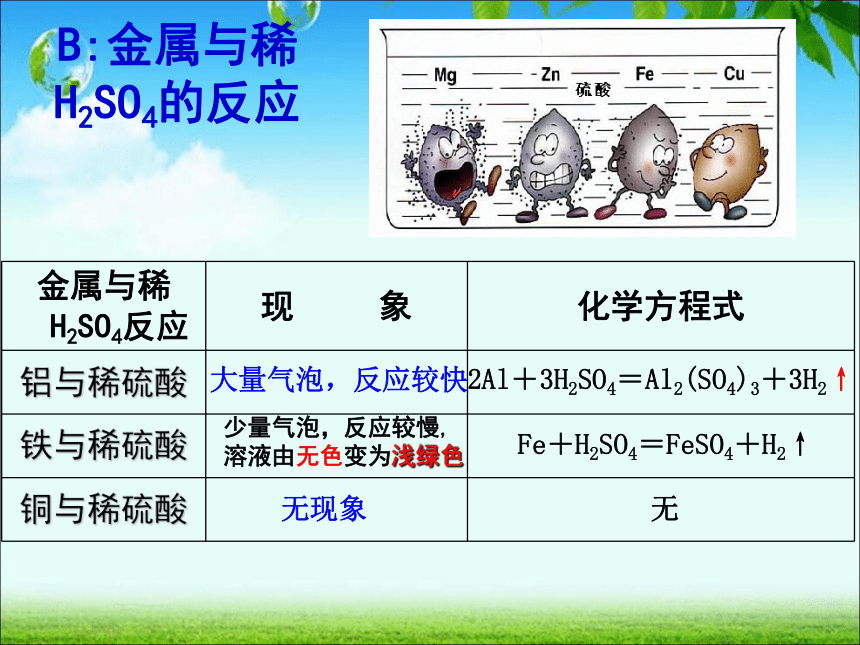
B:金属与稀H2SO4的反应
大量气泡,反应较快
少量气泡,反应较慢,溶液由无色变为浅绿色
无现象
2Al+3H2SO4=Al2(SO4)3+3H2↑
Fe+H2SO4=FeSO4+H2↑
无
金属与稀H2SO4反应
现
象
化学方程式
铝与稀硫酸
铁与稀硫酸
铜与稀硫酸
实验分析
①由铝、铁与稀盐酸(或稀硫酸)反应,而铜不与稀盐酸(或稀硫酸)反应,说明铝铁的金属活动性比铜强,它们能够置换酸中的氢,是活泼金属。
②铁与稀盐酸(或稀硫酸)反应时生成+2价铁的化合物,命名时读作“亚铁”,
FeCl2名称为氯化亚铁,FeSO4名称为硫酸亚铁,它们的溶液均呈浅绿色。
结论:活泼金属可跟稀盐酸和稀硫酸一类的稀酸发生置换反应,放出氢气。
活动三:金属跟某些金属化合物溶液的反应
a
铝与硫酸铜溶液
b
铁与硫酸铜溶液
c
铜与硫酸铝溶液
金属跟某些金属化合物溶液的反应
铝表面有红色物质生成,溶液由蓝色变为无色
铁钉表面有红色物质生成,溶液由蓝色变成浅绿色。
无现象
无
Fe+CuSO4=Cu+FeSO4
2Al+3CuSO4=Al2(SO4)3+3Cu
结论:较活泼金属可跟较不活泼金属化合物的溶液发生置换反应,将较不活泼金属置换出来。
实
验
现
象
化学方程式
铝丝浸入CuSO4溶液中
?
?
铁钉浸入CuSO4溶液中
?
铜浸入Al2(SO4)3溶液中
?
【说明】
1.根据金属与氧气、稀盐酸(或稀硫酸)反应的剧烈程度来判断金属的活动性。
2.根据金属与某些金属化合物溶液的反应,也能判断金属的活动性。
科学家经过多方面的研究,对金属的活动性进行排列
金属活动性顺序表及其应用:
1.在金属活动性顺序里:金属的位置越
______,它的活动性就越强。
2.在金属活动性顺序里:位于
____
前面的金属能置换出盐酸、稀硫酸中的_____。
3.在金属活动性顺序里:位于_____
的金属能把位于____
的金属从它们的化合物的
_____里置换出来。
(K、Ca、Na除外!)
靠前
氢
前面
后面
溶液
氢
单质
化合物
化合物
单质
A+BC=AC+B
置换反应:
(1)定义:由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应,叫做置换反应。
(2)置换反应用字母可表示为:
A+BC==B+AC
木炭还原氧化铜:
C+2CuO
2Cu+CO2↑
氢气还原氧化铜:
H2+CuO
Cu+H2O
铁与盐酸的反应:
Fe+2HCl==FeCl2+
H2↑
铁与硫酸铜的反应:
Fe+CuSO4==Cu+FeSO4
镁在二氧化碳中燃烧:2Mg+CO2
C+2MgO
这四个反应都是置换反应,由此可以看出参加反应的化合物可为氧化物、酸、盐等。
【本节知
识
结
构】
金
属
的
性
质
金属的物理性质
金属的
化学性质
金属与稀盐酸
、稀硫酸反应
(
置换反应
)
Fe
+
2HCl
==
FeCl2
+
H2
↑
Fe
+
H2SO4
==
FeSO4
+
H2
↑
2Al
+
6HCl
==
2AlCl3
+
3H2
↑
2Al+3H2SO4==Al2(SO4)3+3H2↑
金属与某些化
合物溶液反应
(
置换反应
)
2Al+3CuSO4==Al2(SO4)3+3Cu
Fe+CuSO4==Cu+FeSO4
Cu+2AgNO3==2Ag+Cu(NO3)2
置换反应:由单质和化合物反应,生成单质和化合物的反应
金属活动性顺序
2、判断金属活动性顺序的方法
(1)根据金属与氧气反应的难易程度或者反应现象的剧烈程度判断。
(2)可根据金属是否与稀盐酸或稀硫酸反应或反应的剧烈程度判断金属的活动性强弱。
(3)可根据金属能不能把另一种金属从金属化合物的溶液中置换出来,判断金属活动性的强弱。
化学反应的基本类型
化合反应:A
+
B
+
…
→
AB…(多变一)
分解反应:AB…
→A
+
B
+
…
(一变多)
置换反应:A
+BC
→AC
+
B
一、金属的化学性质:
1、与氧气反应
(金属越活泼,反应越容易,越剧烈)
2、氢前金属+盐酸(稀硫酸)(置换反应)
(金属越活泼,反应越容易,越剧烈)
3、位于前面的金属把位于后面的金属从它的化合物的溶液中置换出来。
二、金属活动顺序及其应用
(判断金属能否在溶液中发生置换反应,及反应的快慢)
三、置换反应(A+BC
==
B+AC)
学完本节课你应该知道
1.真金不怕火炼这句广为流传的俗语,能充分体现金具有的性质是(
)
A.硬度小
B.密度较大
C.导电性好
D.化学性质稳定
D
2.有X、Y、Z三种金属,将X、Y浸入稀盐酸中,Y溶解、X不溶解;将X浸入Z的硫酸盐溶液中,X的表面附着Z的金属,则三种金属活动性由强到弱的顺序为(
)
A.
Z>Y>X
B.
Y>X>Z
C.Z>X>Y
D.
Y>Z>X
B
3.某金属A能与硫酸铜溶液发生置换反应,但不能跟氯化锌溶液反应,关于A、铜、锌的金属活动性由强到弱排列正确的是(
)
A.Zn、A、
Cu
B.Zn、Cu
、A
C.A、
Zn
、Cu
D.
Cu、
A
、Zn
A
6.2
金属的化学性质
黄铜是铜、锌合金,由于其外观与黄金相似,常被不法商贩用来冒充黄金牟取暴利,你知道哪些方法可以鉴别黄铜和黄金?
活动一:金属跟氧气的反应
火星四射,放出大量的热,生成黑色固体。
发出白光,放热,生成白色粉末状固体。
由红色变成黑色。
镁比铜活泼
结论:许多金属都能跟氧气反应,生成氧化物。
镁比铁活泼
思考:是不是所有金属都与氧气反应?
提示:真金不怕火炼
实
验
现
象
化学方程式
活泼性比较
镁在空气中燃烧
?
铁丝在氧气中燃烧
铜在酒精灯上加热
“真金不怕火炼”
你知道吗?
“真金不怕火炼”说明了金既使在高温下也不与氧气反应。由此可见,并不是所有金属都与氧气反应,除金外,银、铂等金属也不能与氧气反应。
早在16世纪中叶,瑞士化学家帕拉赛斯就发现,有些金属和酸可以反应生成一种可燃性气体—氢气。并且发现不同的金属与酸反应时的剧烈程度不同。
活动二:金属与稀盐酸(或稀硫酸)反应
铝跟稀盐酸反应
铁跟稀盐酸反应
铜跟稀盐酸反应
A:金属与稀HCl的反应
大量气泡,反应较快
少量气泡,反应较慢,溶液由无色变为浅绿色
无现象
2Al+6HCl=2AlCl3+3H2↑
Fe+2HCl=FeCl2+H2↑
无
金属与稀HCl反应
现
象
化学方程式
铝与稀盐酸
铁与稀盐酸
铜与稀盐酸
B:金属与稀H2SO4的反应
大量气泡,反应较快
少量气泡,反应较慢,溶液由无色变为浅绿色
无现象
2Al+3H2SO4=Al2(SO4)3+3H2↑
Fe+H2SO4=FeSO4+H2↑
无
金属与稀H2SO4反应
现
象
化学方程式
铝与稀硫酸
铁与稀硫酸
铜与稀硫酸
实验分析
①由铝、铁与稀盐酸(或稀硫酸)反应,而铜不与稀盐酸(或稀硫酸)反应,说明铝铁的金属活动性比铜强,它们能够置换酸中的氢,是活泼金属。
②铁与稀盐酸(或稀硫酸)反应时生成+2价铁的化合物,命名时读作“亚铁”,
FeCl2名称为氯化亚铁,FeSO4名称为硫酸亚铁,它们的溶液均呈浅绿色。
结论:活泼金属可跟稀盐酸和稀硫酸一类的稀酸发生置换反应,放出氢气。
活动三:金属跟某些金属化合物溶液的反应
a
铝与硫酸铜溶液
b
铁与硫酸铜溶液
c
铜与硫酸铝溶液
金属跟某些金属化合物溶液的反应
铝表面有红色物质生成,溶液由蓝色变为无色
铁钉表面有红色物质生成,溶液由蓝色变成浅绿色。
无现象
无
Fe+CuSO4=Cu+FeSO4
2Al+3CuSO4=Al2(SO4)3+3Cu
结论:较活泼金属可跟较不活泼金属化合物的溶液发生置换反应,将较不活泼金属置换出来。
实
验
现
象
化学方程式
铝丝浸入CuSO4溶液中
?
?
铁钉浸入CuSO4溶液中
?
铜浸入Al2(SO4)3溶液中
?
【说明】
1.根据金属与氧气、稀盐酸(或稀硫酸)反应的剧烈程度来判断金属的活动性。
2.根据金属与某些金属化合物溶液的反应,也能判断金属的活动性。
科学家经过多方面的研究,对金属的活动性进行排列
金属活动性顺序表及其应用:
1.在金属活动性顺序里:金属的位置越
______,它的活动性就越强。
2.在金属活动性顺序里:位于
____
前面的金属能置换出盐酸、稀硫酸中的_____。
3.在金属活动性顺序里:位于_____
的金属能把位于____
的金属从它们的化合物的
_____里置换出来。
(K、Ca、Na除外!)
靠前
氢
前面
后面
溶液
氢
单质
化合物
化合物
单质
A+BC=AC+B
置换反应:
(1)定义:由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应,叫做置换反应。
(2)置换反应用字母可表示为:
A+BC==B+AC
木炭还原氧化铜:
C+2CuO
2Cu+CO2↑
氢气还原氧化铜:
H2+CuO
Cu+H2O
铁与盐酸的反应:
Fe+2HCl==FeCl2+
H2↑
铁与硫酸铜的反应:
Fe+CuSO4==Cu+FeSO4
镁在二氧化碳中燃烧:2Mg+CO2
C+2MgO
这四个反应都是置换反应,由此可以看出参加反应的化合物可为氧化物、酸、盐等。
【本节知
识
结
构】
金
属
的
性
质
金属的物理性质
金属的
化学性质
金属与稀盐酸
、稀硫酸反应
(
置换反应
)
Fe
+
2HCl
==
FeCl2
+
H2
↑
Fe
+
H2SO4
==
FeSO4
+
H2
↑
2Al
+
6HCl
==
2AlCl3
+
3H2
↑
2Al+3H2SO4==Al2(SO4)3+3H2↑
金属与某些化
合物溶液反应
(
置换反应
)
2Al+3CuSO4==Al2(SO4)3+3Cu
Fe+CuSO4==Cu+FeSO4
Cu+2AgNO3==2Ag+Cu(NO3)2
置换反应:由单质和化合物反应,生成单质和化合物的反应
金属活动性顺序
2、判断金属活动性顺序的方法
(1)根据金属与氧气反应的难易程度或者反应现象的剧烈程度判断。
(2)可根据金属是否与稀盐酸或稀硫酸反应或反应的剧烈程度判断金属的活动性强弱。
(3)可根据金属能不能把另一种金属从金属化合物的溶液中置换出来,判断金属活动性的强弱。
化学反应的基本类型
化合反应:A
+
B
+
…
→
AB…(多变一)
分解反应:AB…
→A
+
B
+
…
(一变多)
置换反应:A
+BC
→AC
+
B
一、金属的化学性质:
1、与氧气反应
(金属越活泼,反应越容易,越剧烈)
2、氢前金属+盐酸(稀硫酸)(置换反应)
(金属越活泼,反应越容易,越剧烈)
3、位于前面的金属把位于后面的金属从它的化合物的溶液中置换出来。
二、金属活动顺序及其应用
(判断金属能否在溶液中发生置换反应,及反应的快慢)
三、置换反应(A+BC
==
B+AC)
学完本节课你应该知道
1.真金不怕火炼这句广为流传的俗语,能充分体现金具有的性质是(
)
A.硬度小
B.密度较大
C.导电性好
D.化学性质稳定
D
2.有X、Y、Z三种金属,将X、Y浸入稀盐酸中,Y溶解、X不溶解;将X浸入Z的硫酸盐溶液中,X的表面附着Z的金属,则三种金属活动性由强到弱的顺序为(
)
A.
Z>Y>X
B.
Y>X>Z
C.Z>X>Y
D.
Y>Z>X
B
3.某金属A能与硫酸铜溶液发生置换反应,但不能跟氯化锌溶液反应,关于A、铜、锌的金属活动性由强到弱排列正确的是(
)
A.Zn、A、
Cu
B.Zn、Cu
、A
C.A、
Zn
、Cu
D.
Cu、
A
、Zn
A
