人教版高二化学选修4第三章第一节 弱电解质的电离(共24张PPT)
文档属性
| 名称 | 人教版高二化学选修4第三章第一节 弱电解质的电离(共24张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 552.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-08 21:28:34 | ||
图片预览








文档简介
(共24张PPT)
化学:第三章第一节《弱电解质的电离》课件PPT(新人教版选修4)
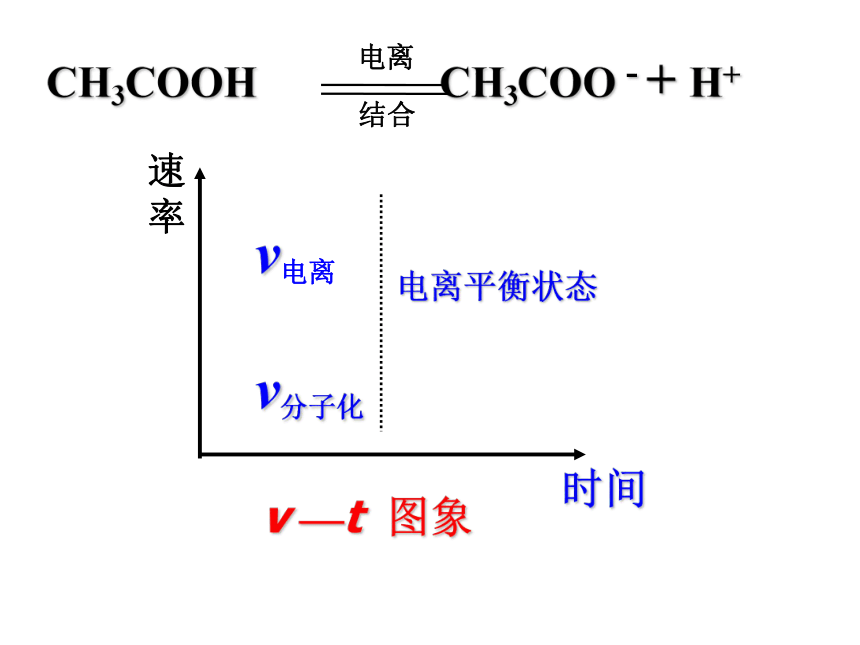
弱电解质的电离平衡
一、弱电解质的电离平衡:
[交流与讨论]
(1)什么是电离平衡?
(2)电离平衡的特征是什么?
结合化学平衡理论回答:
v
—t
图象
1.定义:
2.特征:
在一定条件下,当弱电解质分子电离成离子的速率和离子重新结合成分子的速率相等,溶液中各分子和离子的浓度不再发生变化,电离过程就达到平衡状态.
动动态平衡
定平衡后溶液中各分子、离子的浓度不变。
变条件改变时,电离平衡发生移动。
二、影响电离平衡的外界条件:
浓
度
①改变弱电解质浓度
②同离子效应:
减小生成的离子的浓度
a.加水稀释:正向移动,电离程度增大。
b.增大浓度:正向移动,电离程度减小
逆向移动
正向移动
温度:
电离吸热,升高温度,平衡正向移动
增大生成的离子的浓度
1.CH3COO-和H+在溶液中能否大量共存?
为什么?
2.
H+浓度相同,溶液体积也相同的盐
酸和醋酸分别与过量的锌反应,最后放出
H2的量谁多?
[思考1]
3.同体积同浓度的HAc和HCl中和同浓度的NaOH,耗体积
.
相同
HAC多
下列几种情况能否引起电离平衡移动?
向哪个方向移动?
①加水
②通入氨气
③加NH4Cl固体
④加NaOH固体
⑤加CH3COOH溶液
⑥加MgCl2粉末
⑦
加热(不考虑氨气挥发)
⑧加压
在氨水中存在下列电离平衡:
NH3·H2O
NH4
+
+
OH
-
△H
>
0
[思考]
3:
1.金属导电与电解质溶液导电有何不同?升温对二者的导电性有何影响?
自由电子的定向移动;
自由移动的离子定向移动.
升温时,金属导电性减弱;
弱电解质溶液导电性增强.
[思考4]
2.弱电解质加水稀释时,电离程度_____,离子浓度______.
(填变大、变小、不变或不能确定)
变大
不能确定
[思考5]
[思考6]一定量的冰醋酸加水稀释的变化如图所示:
H+
(1)稀释过程中,溶液的导电能力将如何变化?
(2)稀释过程中,冰醋酸的电离程度如何变化?
(3)若将冰醋酸改为1mol/L的醋酸溶液,曲线将如何变化?
例:
25
0C时,0.1mol/L的CH3COOH溶液中,C(H+)=1.0×10-3mol/L,求该温度下CH3COOH的电离度?
三.弱电解质的电离度
:
影响电离度大小的因素:
(1)内因:
弱电解质本身的性质
(2)外因:
a.温度:
b.浓度:
[注意]讲一种弱电解质的电离度时,应指出该电解质溶液的浓度和温度,如不注明温度通常指25℃。
增大
增大
增大
减小
减小
增大
增大
增大
减小
减小
减小
减小
减小
减小
减小
增大
增大
增大
减小
增大
增大
减小
减小
减小
减小
减小
减小
增大
增大
增大
增大
增大
增大
增大
增大
电离程度
n(H+)
C(H+)
C(AC-)
C(HAC)
加水
加冰醋酸
加醋酸钠
加HCl
加NaOH
锌粒
升温
四.
弱电解质电离程度的电离常数:
①意义:K值越大,电离程度越大。
②可以用电离常数表示弱酸弱碱的相对强弱:
③影响电离平衡常数大小的因素:
A.电离平衡常数大小是由物质的本性决定的,在同一温度下,不同弱电解质的电离常数不同。
B.弱电解质的电离平衡常数大小受温度变化的影响,不受其浓度变化的影响。
多元弱酸,分步电离,第一步电离大于第二步电离,第二步电离远大于第三步电离.
[结论]多元弱酸的酸性由第一步电离决定。
随堂检测
1.化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂:
HIn(溶液红色)
H++In—(溶液无色)
浓度为0.02mol/L的下列溶液:①盐酸
②石灰水
③NaCl溶液
④NaHSO4溶液
⑤NaHCO3溶液
⑥氨水
其中能使指示剂显红色的是
(
)
A
①④⑤
B
②⑤⑥
C
①④
D
②③⑥
C
2.在RNH2·H2O
RNH3++OH-的平衡中,要使RNH2·H2O的电离程度及c(OH-)都增大,可采取的措施(
)
A.通入氯化氢
B.加少量氢氧化钠固体
C.加水
D.升温
D
3.在25℃时,用蒸馏水稀释氨水,随溶液的稀释,下列各项中始终保持增大趋势的是(
)
B.
C.
D.
A.
A
4.相同温度下,两种稀氨水A和B,浓度分别为0.2mol/L和0.1mol/L,则A、B的OH-浓度之比为(
)
A.大于2
B.
小于2
C.
等于2
D.
不能肯定
B
5.
1mol/L的盐酸、醋酸、硫酸各1L,分别加入足量的铁。
开始反应时产生氢气的速率________
,
最终收集到的氢气的物质的量______
。
硫酸>盐酸>醋酸
硫酸>盐酸=醋酸
a﹥c﹥
b
C
相等
⑴“0”点导电能力为0的理由是:
⑵a、b、c三点对应溶液的PH值由大到小的顺序是
⑶a、b、c三点中电离程度最大的是
。电离平衡常数的关系
.
①加碱②加碳酸钠③加镁或锌
化学:第三章第一节《弱电解质的电离》课件PPT(新人教版选修4)
弱电解质的电离平衡
一、弱电解质的电离平衡:
[交流与讨论]
(1)什么是电离平衡?
(2)电离平衡的特征是什么?
结合化学平衡理论回答:
v
—t
图象
1.定义:
2.特征:
在一定条件下,当弱电解质分子电离成离子的速率和离子重新结合成分子的速率相等,溶液中各分子和离子的浓度不再发生变化,电离过程就达到平衡状态.
动动态平衡
定平衡后溶液中各分子、离子的浓度不变。
变条件改变时,电离平衡发生移动。
二、影响电离平衡的外界条件:
浓
度
①改变弱电解质浓度
②同离子效应:
减小生成的离子的浓度
a.加水稀释:正向移动,电离程度增大。
b.增大浓度:正向移动,电离程度减小
逆向移动
正向移动
温度:
电离吸热,升高温度,平衡正向移动
增大生成的离子的浓度
1.CH3COO-和H+在溶液中能否大量共存?
为什么?
2.
H+浓度相同,溶液体积也相同的盐
酸和醋酸分别与过量的锌反应,最后放出
H2的量谁多?
[思考1]
3.同体积同浓度的HAc和HCl中和同浓度的NaOH,耗体积
.
相同
HAC多
下列几种情况能否引起电离平衡移动?
向哪个方向移动?
①加水
②通入氨气
③加NH4Cl固体
④加NaOH固体
⑤加CH3COOH溶液
⑥加MgCl2粉末
⑦
加热(不考虑氨气挥发)
⑧加压
在氨水中存在下列电离平衡:
NH3·H2O
NH4
+
+
OH
-
△H
>
0
[思考]
3:
1.金属导电与电解质溶液导电有何不同?升温对二者的导电性有何影响?
自由电子的定向移动;
自由移动的离子定向移动.
升温时,金属导电性减弱;
弱电解质溶液导电性增强.
[思考4]
2.弱电解质加水稀释时,电离程度_____,离子浓度______.
(填变大、变小、不变或不能确定)
变大
不能确定
[思考5]
[思考6]一定量的冰醋酸加水稀释的变化如图所示:
H+
(1)稀释过程中,溶液的导电能力将如何变化?
(2)稀释过程中,冰醋酸的电离程度如何变化?
(3)若将冰醋酸改为1mol/L的醋酸溶液,曲线将如何变化?
例:
25
0C时,0.1mol/L的CH3COOH溶液中,C(H+)=1.0×10-3mol/L,求该温度下CH3COOH的电离度?
三.弱电解质的电离度
:
影响电离度大小的因素:
(1)内因:
弱电解质本身的性质
(2)外因:
a.温度:
b.浓度:
[注意]讲一种弱电解质的电离度时,应指出该电解质溶液的浓度和温度,如不注明温度通常指25℃。
增大
增大
增大
减小
减小
增大
增大
增大
减小
减小
减小
减小
减小
减小
减小
增大
增大
增大
减小
增大
增大
减小
减小
减小
减小
减小
减小
增大
增大
增大
增大
增大
增大
增大
增大
电离程度
n(H+)
C(H+)
C(AC-)
C(HAC)
加水
加冰醋酸
加醋酸钠
加HCl
加NaOH
锌粒
升温
四.
弱电解质电离程度的电离常数:
①意义:K值越大,电离程度越大。
②可以用电离常数表示弱酸弱碱的相对强弱:
③影响电离平衡常数大小的因素:
A.电离平衡常数大小是由物质的本性决定的,在同一温度下,不同弱电解质的电离常数不同。
B.弱电解质的电离平衡常数大小受温度变化的影响,不受其浓度变化的影响。
多元弱酸,分步电离,第一步电离大于第二步电离,第二步电离远大于第三步电离.
[结论]多元弱酸的酸性由第一步电离决定。
随堂检测
1.化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂:
HIn(溶液红色)
H++In—(溶液无色)
浓度为0.02mol/L的下列溶液:①盐酸
②石灰水
③NaCl溶液
④NaHSO4溶液
⑤NaHCO3溶液
⑥氨水
其中能使指示剂显红色的是
(
)
A
①④⑤
B
②⑤⑥
C
①④
D
②③⑥
C
2.在RNH2·H2O
RNH3++OH-的平衡中,要使RNH2·H2O的电离程度及c(OH-)都增大,可采取的措施(
)
A.通入氯化氢
B.加少量氢氧化钠固体
C.加水
D.升温
D
3.在25℃时,用蒸馏水稀释氨水,随溶液的稀释,下列各项中始终保持增大趋势的是(
)
B.
C.
D.
A.
A
4.相同温度下,两种稀氨水A和B,浓度分别为0.2mol/L和0.1mol/L,则A、B的OH-浓度之比为(
)
A.大于2
B.
小于2
C.
等于2
D.
不能肯定
B
5.
1mol/L的盐酸、醋酸、硫酸各1L,分别加入足量的铁。
开始反应时产生氢气的速率________
,
最终收集到的氢气的物质的量______
。
硫酸>盐酸>醋酸
硫酸>盐酸=醋酸
a﹥c﹥
b
C
相等
⑴“0”点导电能力为0的理由是:
⑵a、b、c三点对应溶液的PH值由大到小的顺序是
⑶a、b、c三点中电离程度最大的是
。电离平衡常数的关系
.
①加碱②加碳酸钠③加镁或锌
