金属的活动性顺序(课件 22张PPT)
文档属性
| 名称 | 金属的活动性顺序(课件 22张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 756.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2020-06-08 08:44:45 | ||
图片预览








文档简介
(共22张PPT)
金
铁
铜
用实验来比较金属的活泼性的方法
1、比较金属与酸反应的情况
2、金属与盐溶液的反应情况
3、金属与金属化合物的反应情况
4、金属与水的反应情况
如何比较镁、锌、铜的活泼性呢?
镁条、锌粒、铜片分别
放入稀盐酸中
镁
锌
铜
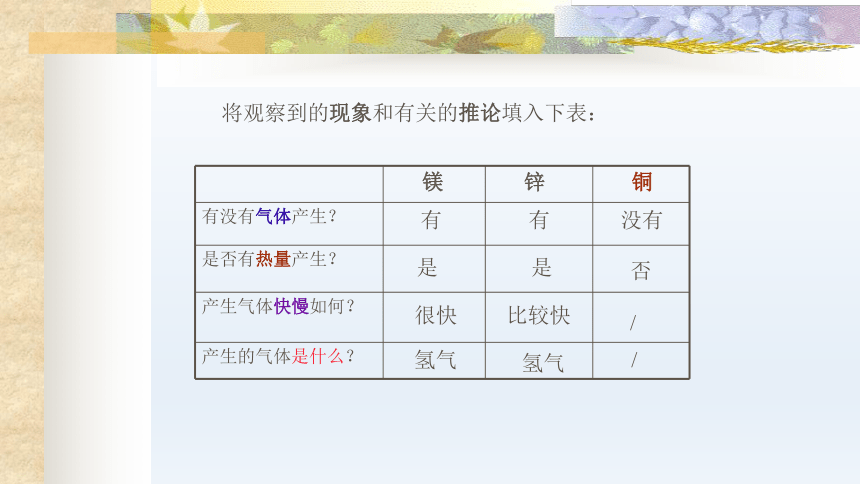
将观察到的现象和有关的推论填入下表:
有
有
没有
是
是
否
很快
比较快
/
氢气
氢气
/
镁
锌
铜
有没有气体产生?
是否有热量产生?
产生气体快慢如何?
产生的气体是什么?
从上述实验的结果,我们可以得出哪些结论?哪个金属最活泼?哪个金属最不活泼?
三种金属的化学活动性顺序为:
Mg
>Zn
>Cu
单质
化合物
单质
化合物
Mg
+
2HCl
=
H2
+
MgCl2
Zn
+
2HCl
=
H2
+
ZnCl2
写出镁、锌和盐酸反应的化学方程式
置换反应:
一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应。
A+BC=B+AC
三种金属的化学活动性顺序为:
Mg
>Zn
>(H)
>Cu
是否所有的金属都能
被酸腐蚀?
怎样比较不能与酸反应的金属的活泼性?
如铜和银
在铜片表面滴一滴硝酸银溶液,观察现象.
铜片与硝酸银溶液反应
有银白色物质生成
有银生成
Cu+2AgNO3=Cu(NO3)2+2Ag
Fe+CuSO4=FeSO4+Cu
有铜生成
铁丝表面有红色物质出现
铁与硫酸铜
Cu>Ag
Fe>Cu
铜与硝酸银
现象
结论
化学
方程式
金属
活动性
金属活动性顺序:
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb(H)
Cu
Hg
Ag
Pt
Au
金属活动性顺序表的意义
1、排在氢前面金属能与稀盐酸或稀硫酸反应,产生氢气,排在氢后面的金属不能跟酸反应放出氢气。
2、在前面的金属能把排在后面金属从它的盐溶液中置换出来
注意:K、Ca、Na等三种活泼金属除外
1.
根据金属活动性顺序表判断
能否用铁壶装稀硫酸?为
什么?
2.
能否用铁制的容器配制波尔
多液(含硫酸铜)?为什么?
练习
1.下列反应能发生反应吗?若能,写出
化学方程式,若不能,说明理由。
(1)铜(Cu)与稀硫酸(H2SO4)
(2)铝(Al)与稀盐酸(HCl)
(3)铁(Fe)与氯化银(AgCl)
(4)铁(Fe)与硝酸银(AgNO3)
(5)银(Ag)与硫酸铜(CuSO4)
2.怎样设计实验来比较镁、铁、铜三种金属
的化学活动性顺序?
实验设计题
实验器材:试管、镊子
实验药品:除镁、铁、铜外,还需等体积,
等浓度的
实验现象:
实验结论:
涉及的化学方程式:
稀盐酸
(或稀硫酸)
铜片上无气泡,镁产生气泡的速度比铁快
金属活泼顺序:镁>铁>铜
Mg+2HCl=MgCl2+H2
Fe+2HCl=FeCl2+H2
现象:
有轻微的爆鸣声
检验产生的气体
证明:
产生的气体为氢气
置换反应:
一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应。
注:化合物是金属盐的话,
一定是可溶性盐。
金
铁
铜
用实验来比较金属的活泼性的方法
1、比较金属与酸反应的情况
2、金属与盐溶液的反应情况
3、金属与金属化合物的反应情况
4、金属与水的反应情况
如何比较镁、锌、铜的活泼性呢?
镁条、锌粒、铜片分别
放入稀盐酸中
镁
锌
铜
将观察到的现象和有关的推论填入下表:
有
有
没有
是
是
否
很快
比较快
/
氢气
氢气
/
镁
锌
铜
有没有气体产生?
是否有热量产生?
产生气体快慢如何?
产生的气体是什么?
从上述实验的结果,我们可以得出哪些结论?哪个金属最活泼?哪个金属最不活泼?
三种金属的化学活动性顺序为:
Mg
>Zn
>Cu
单质
化合物
单质
化合物
Mg
+
2HCl
=
H2
+
MgCl2
Zn
+
2HCl
=
H2
+
ZnCl2
写出镁、锌和盐酸反应的化学方程式
置换反应:
一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应。
A+BC=B+AC
三种金属的化学活动性顺序为:
Mg
>Zn
>(H)
>Cu
是否所有的金属都能
被酸腐蚀?
怎样比较不能与酸反应的金属的活泼性?
如铜和银
在铜片表面滴一滴硝酸银溶液,观察现象.
铜片与硝酸银溶液反应
有银白色物质生成
有银生成
Cu+2AgNO3=Cu(NO3)2+2Ag
Fe+CuSO4=FeSO4+Cu
有铜生成
铁丝表面有红色物质出现
铁与硫酸铜
Cu>Ag
Fe>Cu
铜与硝酸银
现象
结论
化学
方程式
金属
活动性
金属活动性顺序:
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb(H)
Cu
Hg
Ag
Pt
Au
金属活动性顺序表的意义
1、排在氢前面金属能与稀盐酸或稀硫酸反应,产生氢气,排在氢后面的金属不能跟酸反应放出氢气。
2、在前面的金属能把排在后面金属从它的盐溶液中置换出来
注意:K、Ca、Na等三种活泼金属除外
1.
根据金属活动性顺序表判断
能否用铁壶装稀硫酸?为
什么?
2.
能否用铁制的容器配制波尔
多液(含硫酸铜)?为什么?
练习
1.下列反应能发生反应吗?若能,写出
化学方程式,若不能,说明理由。
(1)铜(Cu)与稀硫酸(H2SO4)
(2)铝(Al)与稀盐酸(HCl)
(3)铁(Fe)与氯化银(AgCl)
(4)铁(Fe)与硝酸银(AgNO3)
(5)银(Ag)与硫酸铜(CuSO4)
2.怎样设计实验来比较镁、铁、铜三种金属
的化学活动性顺序?
实验设计题
实验器材:试管、镊子
实验药品:除镁、铁、铜外,还需等体积,
等浓度的
实验现象:
实验结论:
涉及的化学方程式:
稀盐酸
(或稀硫酸)
铜片上无气泡,镁产生气泡的速度比铁快
金属活泼顺序:镁>铁>铜
Mg+2HCl=MgCl2+H2
Fe+2HCl=FeCl2+H2
现象:
有轻微的爆鸣声
检验产生的气体
证明:
产生的气体为氢气
置换反应:
一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应。
注:化合物是金属盐的话,
一定是可溶性盐。
