科粤版九年级化学下册7.1-溶解与乳化(共24张PPT)
文档属性
| 名称 | 科粤版九年级化学下册7.1-溶解与乳化(共24张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-08 22:03:57 | ||
图片预览






文档简介
(共24张PPT)
7.1
溶解与乳化
溶解现象,溶液,影响溶解的因素
第七章
溶液
化学反应需要的溶液
生长在营养液中的无土栽培的植物
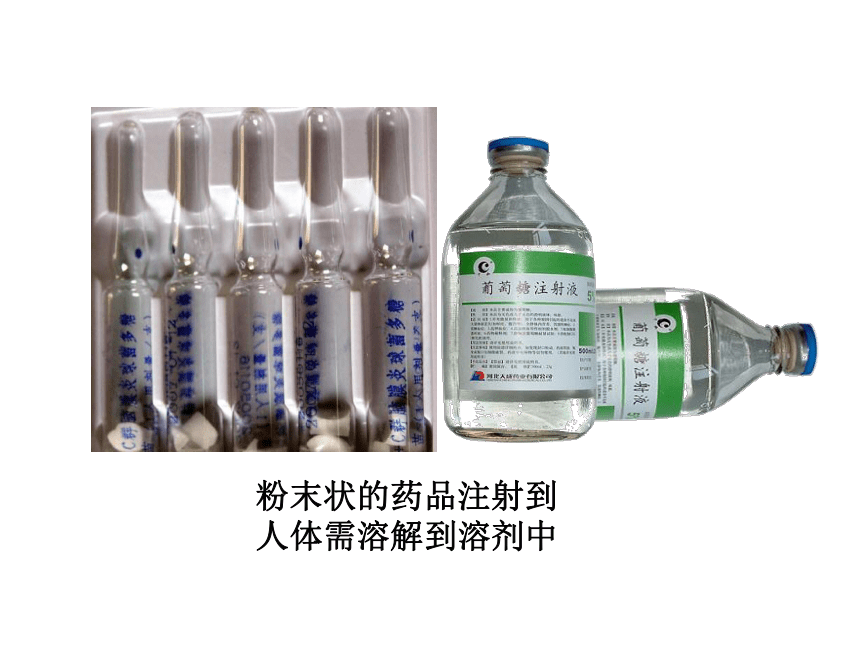
粉末状的药品注射到人体需溶解到溶剂中
【观察活动】
泥土
蔗糖
植物油
食盐
硫酸铜
酒精
振荡前
振荡后
【实验7—1】悬浊液、乳浊液、溶液
√
√
√
√
√
√
√
√
√
√
√
√
√
√
√
√
√
√
√
√
√
√
√
√
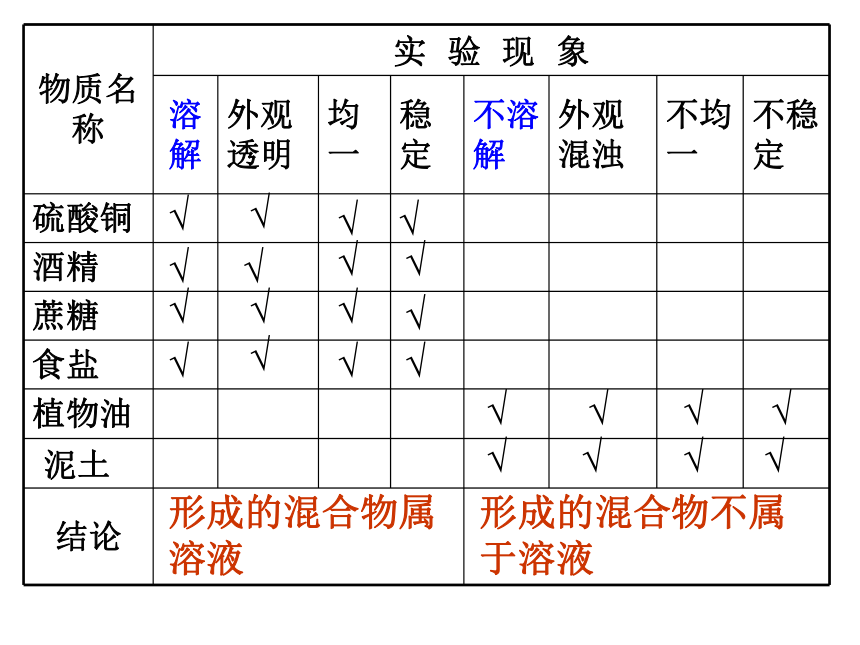
形成的混合物属溶液
形成的混合物不属于溶液
物质名称
实?
验?
现?
象
溶解
外观透明
均一
稳定
不溶解
外观混浊
不均一
不稳定
硫酸铜
酒精
蔗糖
食盐
植物油
泥土
结论
在硫酸铜、酒精、蔗糖和食盐等物质中加入水以后,它们逐渐溶解分散,好像“消失”了一样,最后形成一种透明、均一而稳定的混合物。硫酸铜、酒精、蔗糖和食盐可以在水中溶解,称为“能溶物质”。泥沙和油在水中难溶解,称为“不溶物质”。
蔗糖与氯化钠两种物质溶解后有什么区别与联系?
怎样解释食盐、蔗糖在水中的变化呢?
蔗糖放进水中后,很快就“消失”了,它到哪里去了呢?原来,蔗糖表面的分子在水分子的作用下,向水里扩散,并均一地分散在水分子中间,形成一种稳定的混合物——蔗糖溶液。如果把食盐(主要成分是氯化钠)放到水中,氯化钠在水分子的作用下,向水里扩散,最终均一的分散到水分子中间,也形成稳定的溶液,只不过氯化钠在水溶液中是以钠离子和氯离子的形式存在。只要水分不蒸发,温度不变化,蔗糖与水或氯化钠与水不会分离,取其中任意的一部分进行比较,发现它们的组成完全相同。
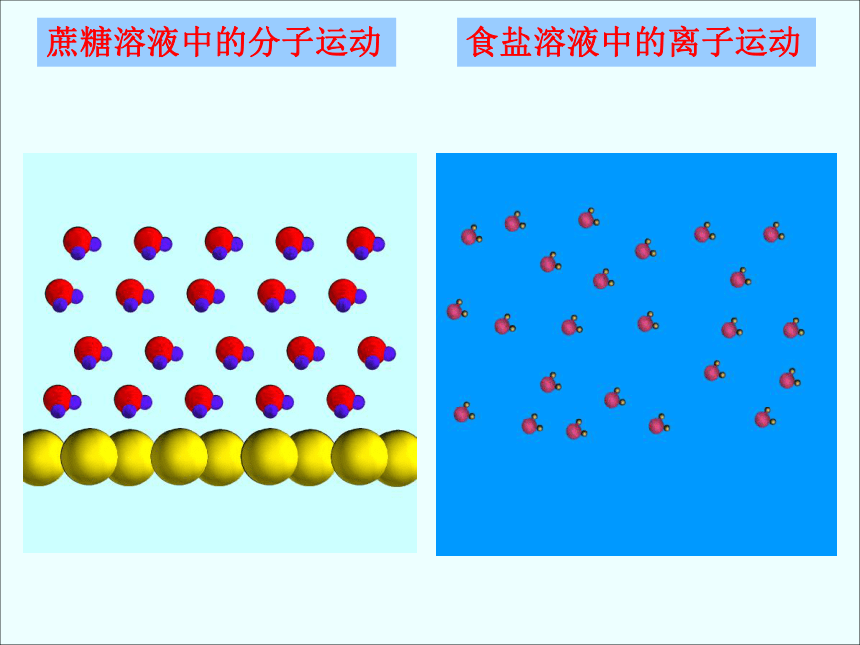
蔗糖溶液中的分子运动
食盐溶液中的离子运动
区别:蔗糖、酒精在水中是以分子形式存在,而氯化钠、硫酸铜则是以离子形式存在。
联系:蔗糖、酒精、硫酸铜和氯化钠溶解后,只要水分不被蒸发,温度不发生变化,蔗糖、酒精、硫酸铜或氯化钠与水不会分离,取出其中任意一部分进行比较,它们的组成完全相同。
一、溶解
1、溶液:由一种或几种物质分散到另一种物质
里,形成均一的、稳定的混合物。
如蔗糖溶液、酒精溶液、硫酸铜溶液、氯化钠溶液等。
2、悬浊液:由不溶性固体小颗粒(如泥沙)分散到水里形成的混浊液。如黄泥水
3、乳浊液:由不溶性液体小液滴(如油滴)分散到水中形成的混浊液。如牛奶、豆浆等。
悬浊液、乳浊液都是不均一、不稳定的。
1、溶液
⑴.定义:
一种或几种物质分散到另一种物质
里,形成均一的、稳定的混合物。
⑵.组成:
溶剂:
溶质:
能溶解其它物质的物质。
被溶解的物质。
⑶.特征:
均一性、稳定性、透明混合物。
溶液质量=溶质质量+溶剂质量
溶液体积≠溶质体积+溶剂体积
①.均一性:溶液形成以后,溶液任一部分的组成和性质完全相同(指密度、浓度、性质等)。
②.稳定性:在外界条件不变的情况下溶液长期放置,溶液中的各组成不会发生变化,溶质不会从溶液里分离出来。
③.透明混合物:凡是溶液都是透明的混合物。
溶质溶解“消失”了,能透光。
透明的混合物,并不是说溶液为无色液体,有的溶液是有颜色的。如硫酸铜溶液为蓝色;氯化亚铁溶液为浅绿色;氯化铁溶液为黄色;高锰酸钾溶液为紫红色。但大多数的溶液为无色液体。
均一、透明、稳定的液体不一定是溶液。如水就不是溶液,酒精也不是溶液。
讨论与交流
1.
溶质:硫酸铜、酒精。溶剂:水
2.
透明:溶质溶解“消失”了,能透光
均一:溶液各处的浓稀相同
稳定:条件不变时,溶质与溶剂长期不会分离出来
透明不一定是无色的。例如:硫酸铜溶液是蓝色的,高锰酸钾溶液是紫红色的,氯化铁溶液是黄色的。
在工农业生产、实验室和日常生活中经常使用各种溶液。请指出下列溶液的溶质和溶剂。
氯化氢(HCl)
水(H2O)
硫酸(H2SO4)
水(H2O)
水(H2O)
水(H2O)
水(H2O)
水(H2O)
酒精(C2H5OH)
酒精(C2H5OH)
氨气(NH3)
氯化钠(NaCl)
葡萄糖(C6H12O6)
碘(I2)
溶液
溶质
溶剂
盐酸
稀硫酸
氨水
生理盐水
葡萄糖注射液
碘酒
医用酒精
水(H2O)
水(H2O)
酒精(C2H5OH)
醋酸(CH3COOH)
糖
水(H2O)
水(H2O)
水(H2O)
食盐(NaCl)
氢氧化钙【Ca(OH)2】
溶液
溶质
溶剂
白酒
白醋
糖水
盐水
石灰水
溶液中溶质和溶剂的确定
气体
液体
固体
液体
量少
量多
非水物
水
无论水的多少
哪些物质可以作溶质?举例说明。
溶质可以是固体、液体和气体。
通常没有指明溶剂的溶液,一般是指水溶液。
体
系
溶
质
溶
剂
气+液
固+液
液+液
没有水
有水
水是最常用的溶剂,那么只能水做溶剂吗?
思考:
水是最重要的溶剂,但却不是唯一的溶剂。日常生活中还有许多其他液体溶剂,如酒精、汽油等。
[交流与讨论]
在许多情况下,人们希望能较快地溶解某些固体物质。怎样才能达到上述目的?
办法1:
水的温度越高,物质就越快溶解。
办法2:
办法3:
固体越细,就越快溶解。
搅拌可以使物质更快溶解。
【实验7-2】比较等量硫酸铜在水中溶解的快慢
<
>
>
一般情况下,溶剂温度越高,溶质溶解速率越快;反之,越慢。
一般情况下,溶质颗粒越小,溶质溶解速率越快;反之,越慢。
在搅拌溶剂的情况下,溶质在溶剂中的溶解速率加快。
现象
结论
溶解速率
A1___B1
溶解速率
A2___B2
溶解速率
A3___B3
通过对比实验可知:①____________、②_______________、③_______能加快溶质在溶剂里溶解。
升高溶剂温度
减小溶质颗粒
搅拌
检查站
1.
2.a.
b.
c.
d.
溶解
√
√
√
×
3.A________________
或
食盐__
B__________
或
味精_____
C______________
或
细沙_____
NaNO3或NH4NO3
KNO3
CaCO3或MnO2
1、溶液、溶质、溶剂的概念。
2、溶液的基本特征——均匀、稳定、
透明混合物。
3、组成溶液的质量等于其中的溶质质量与溶剂质量之和。
4、
溶解速度与溶剂温度高低、溶质
颗粒大小以及是否搅拌等因素有关
。
【实验】碘或高锰酸钾分别放入水或汽油中
水
汽油
水
汽油
碘
高锰酸钾
高锰酸钾
碘
碘几乎不溶,溶液呈浅棕黄色
高锰酸钾溶解,溶液呈紫色
碘溶解,溶液呈棕红色
高锰酸钾几乎不溶,溶液呈无色
溶质在溶剂中溶解性的比较:
不同溶质在同一溶剂中溶解能力是不同的;同一溶质在不同溶剂中溶解能力是不同的。
阅读:课本第192页知识视窗常见的有机溶剂。
溶剂
溶质
现
象
水
碘
水
高锰酸钾
汽油
碘
汽油
高锰酸钾
7.1
溶解与乳化
溶解现象,溶液,影响溶解的因素
第七章
溶液
化学反应需要的溶液
生长在营养液中的无土栽培的植物
粉末状的药品注射到人体需溶解到溶剂中
【观察活动】
泥土
蔗糖
植物油
食盐
硫酸铜
酒精
振荡前
振荡后
【实验7—1】悬浊液、乳浊液、溶液
√
√
√
√
√
√
√
√
√
√
√
√
√
√
√
√
√
√
√
√
√
√
√
√
形成的混合物属溶液
形成的混合物不属于溶液
物质名称
实?
验?
现?
象
溶解
外观透明
均一
稳定
不溶解
外观混浊
不均一
不稳定
硫酸铜
酒精
蔗糖
食盐
植物油
泥土
结论
在硫酸铜、酒精、蔗糖和食盐等物质中加入水以后,它们逐渐溶解分散,好像“消失”了一样,最后形成一种透明、均一而稳定的混合物。硫酸铜、酒精、蔗糖和食盐可以在水中溶解,称为“能溶物质”。泥沙和油在水中难溶解,称为“不溶物质”。
蔗糖与氯化钠两种物质溶解后有什么区别与联系?
怎样解释食盐、蔗糖在水中的变化呢?
蔗糖放进水中后,很快就“消失”了,它到哪里去了呢?原来,蔗糖表面的分子在水分子的作用下,向水里扩散,并均一地分散在水分子中间,形成一种稳定的混合物——蔗糖溶液。如果把食盐(主要成分是氯化钠)放到水中,氯化钠在水分子的作用下,向水里扩散,最终均一的分散到水分子中间,也形成稳定的溶液,只不过氯化钠在水溶液中是以钠离子和氯离子的形式存在。只要水分不蒸发,温度不变化,蔗糖与水或氯化钠与水不会分离,取其中任意的一部分进行比较,发现它们的组成完全相同。
蔗糖溶液中的分子运动
食盐溶液中的离子运动
区别:蔗糖、酒精在水中是以分子形式存在,而氯化钠、硫酸铜则是以离子形式存在。
联系:蔗糖、酒精、硫酸铜和氯化钠溶解后,只要水分不被蒸发,温度不发生变化,蔗糖、酒精、硫酸铜或氯化钠与水不会分离,取出其中任意一部分进行比较,它们的组成完全相同。
一、溶解
1、溶液:由一种或几种物质分散到另一种物质
里,形成均一的、稳定的混合物。
如蔗糖溶液、酒精溶液、硫酸铜溶液、氯化钠溶液等。
2、悬浊液:由不溶性固体小颗粒(如泥沙)分散到水里形成的混浊液。如黄泥水
3、乳浊液:由不溶性液体小液滴(如油滴)分散到水中形成的混浊液。如牛奶、豆浆等。
悬浊液、乳浊液都是不均一、不稳定的。
1、溶液
⑴.定义:
一种或几种物质分散到另一种物质
里,形成均一的、稳定的混合物。
⑵.组成:
溶剂:
溶质:
能溶解其它物质的物质。
被溶解的物质。
⑶.特征:
均一性、稳定性、透明混合物。
溶液质量=溶质质量+溶剂质量
溶液体积≠溶质体积+溶剂体积
①.均一性:溶液形成以后,溶液任一部分的组成和性质完全相同(指密度、浓度、性质等)。
②.稳定性:在外界条件不变的情况下溶液长期放置,溶液中的各组成不会发生变化,溶质不会从溶液里分离出来。
③.透明混合物:凡是溶液都是透明的混合物。
溶质溶解“消失”了,能透光。
透明的混合物,并不是说溶液为无色液体,有的溶液是有颜色的。如硫酸铜溶液为蓝色;氯化亚铁溶液为浅绿色;氯化铁溶液为黄色;高锰酸钾溶液为紫红色。但大多数的溶液为无色液体。
均一、透明、稳定的液体不一定是溶液。如水就不是溶液,酒精也不是溶液。
讨论与交流
1.
溶质:硫酸铜、酒精。溶剂:水
2.
透明:溶质溶解“消失”了,能透光
均一:溶液各处的浓稀相同
稳定:条件不变时,溶质与溶剂长期不会分离出来
透明不一定是无色的。例如:硫酸铜溶液是蓝色的,高锰酸钾溶液是紫红色的,氯化铁溶液是黄色的。
在工农业生产、实验室和日常生活中经常使用各种溶液。请指出下列溶液的溶质和溶剂。
氯化氢(HCl)
水(H2O)
硫酸(H2SO4)
水(H2O)
水(H2O)
水(H2O)
水(H2O)
水(H2O)
酒精(C2H5OH)
酒精(C2H5OH)
氨气(NH3)
氯化钠(NaCl)
葡萄糖(C6H12O6)
碘(I2)
溶液
溶质
溶剂
盐酸
稀硫酸
氨水
生理盐水
葡萄糖注射液
碘酒
医用酒精
水(H2O)
水(H2O)
酒精(C2H5OH)
醋酸(CH3COOH)
糖
水(H2O)
水(H2O)
水(H2O)
食盐(NaCl)
氢氧化钙【Ca(OH)2】
溶液
溶质
溶剂
白酒
白醋
糖水
盐水
石灰水
溶液中溶质和溶剂的确定
气体
液体
固体
液体
量少
量多
非水物
水
无论水的多少
哪些物质可以作溶质?举例说明。
溶质可以是固体、液体和气体。
通常没有指明溶剂的溶液,一般是指水溶液。
体
系
溶
质
溶
剂
气+液
固+液
液+液
没有水
有水
水是最常用的溶剂,那么只能水做溶剂吗?
思考:
水是最重要的溶剂,但却不是唯一的溶剂。日常生活中还有许多其他液体溶剂,如酒精、汽油等。
[交流与讨论]
在许多情况下,人们希望能较快地溶解某些固体物质。怎样才能达到上述目的?
办法1:
水的温度越高,物质就越快溶解。
办法2:
办法3:
固体越细,就越快溶解。
搅拌可以使物质更快溶解。
【实验7-2】比较等量硫酸铜在水中溶解的快慢
<
>
>
一般情况下,溶剂温度越高,溶质溶解速率越快;反之,越慢。
一般情况下,溶质颗粒越小,溶质溶解速率越快;反之,越慢。
在搅拌溶剂的情况下,溶质在溶剂中的溶解速率加快。
现象
结论
溶解速率
A1___B1
溶解速率
A2___B2
溶解速率
A3___B3
通过对比实验可知:①____________、②_______________、③_______能加快溶质在溶剂里溶解。
升高溶剂温度
减小溶质颗粒
搅拌
检查站
1.
2.a.
b.
c.
d.
溶解
√
√
√
×
3.A________________
或
食盐__
B__________
或
味精_____
C______________
或
细沙_____
NaNO3或NH4NO3
KNO3
CaCO3或MnO2
1、溶液、溶质、溶剂的概念。
2、溶液的基本特征——均匀、稳定、
透明混合物。
3、组成溶液的质量等于其中的溶质质量与溶剂质量之和。
4、
溶解速度与溶剂温度高低、溶质
颗粒大小以及是否搅拌等因素有关
。
【实验】碘或高锰酸钾分别放入水或汽油中
水
汽油
水
汽油
碘
高锰酸钾
高锰酸钾
碘
碘几乎不溶,溶液呈浅棕黄色
高锰酸钾溶解,溶液呈紫色
碘溶解,溶液呈棕红色
高锰酸钾几乎不溶,溶液呈无色
溶质在溶剂中溶解性的比较:
不同溶质在同一溶剂中溶解能力是不同的;同一溶质在不同溶剂中溶解能力是不同的。
阅读:课本第192页知识视窗常见的有机溶剂。
溶剂
溶质
现
象
水
碘
水
高锰酸钾
汽油
碘
汽油
高锰酸钾
