人教版高二化学选修4第四章 第一节 原电池(共16张PPT)
文档属性
| 名称 | 人教版高二化学选修4第四章 第一节 原电池(共16张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-08 21:57:25 | ||
图片预览




文档简介
(共16张PPT)
原理
改进
概念
练习
设计
电极
条件
三维目标
【知识与技能】
(1)了解原电池工作原理,判断电极,书写简单电极反应,掌握形成条件。
(2)
能设计原电池,学习实验研究的方法。
【过程与方法】
(1)
学习科学探究的基本方法,提高科学探究能力
(2)
学会运用观察、实验等多种手段获取信息,并对信息进行加工。
【情感、态度与价值观】
(1)
体验探究的快乐,感受化学的奇妙;增强将化学应用于生活的意识。
(2)关注社会热点和科技前沿问题,增强环保意识,形成可持续发展思想。
【教学重点】1、工作原理
2、形成条件
3、判断电极
4、设计电池
【教学难点】工作原理、形成条件、判断电极、设计电池、培养探究能力
原理
改进
概念
练习
设计
电极
条件
【自主学习】回顾原电池装置及原理
电流表指针偏转
铜片上有气泡
锌片上有气泡
溶液的温度升高
实验现象
原理
改进
概念
练习
设计
电极
条件
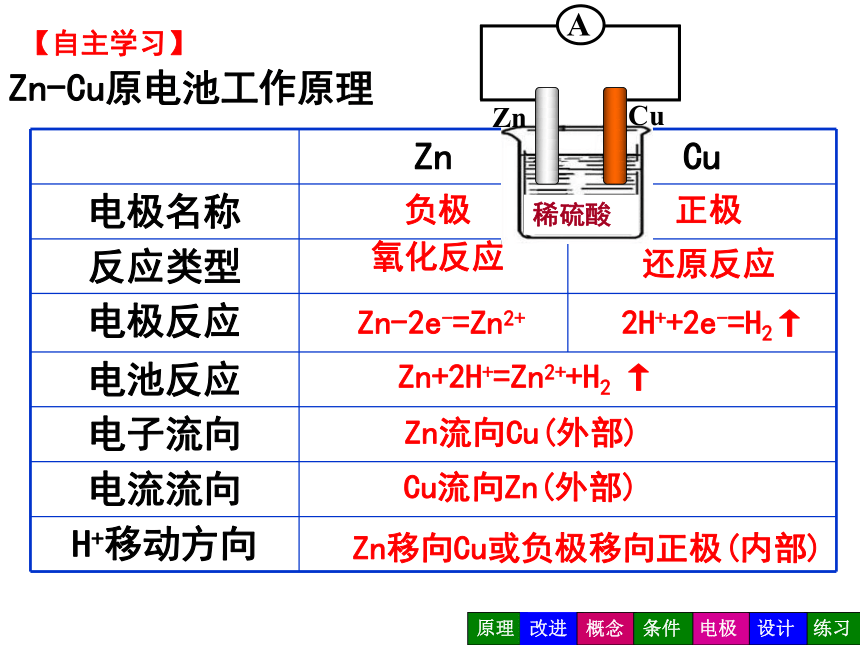
Zn-Cu原电池工作原理
负极
正极
氧化反应
还原反应
Zn-2e-=Zn2+
2H++2e-=H2↑
Zn+2H+=Zn2++H2
↑
Zn流向Cu(外部)
Cu流向Zn(外部)
Zn移向Cu或负极移向正极(内部)
原理
改进
概念
练习
设计
电极
条件
【自主学习】
Zn
Cu
电极名称
反应类型
电极反应
电池反应
电子流向
电流流向
H+移动方向
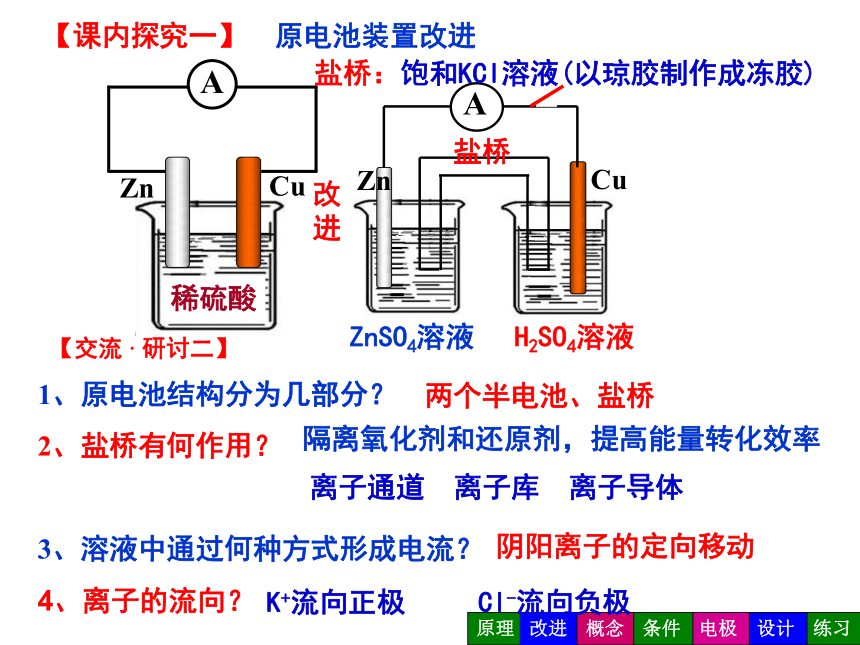
【课内探究一】
原电池装置改进
【交流
·
研讨一】
1、反应停止了吗?
2、能量转变成何种形式?
3、如何改进原电池装置?
H2SO4溶液
?
ZnSO4溶液
盐桥
原理
改进
概念
练习
设计
电极
条件
原理
改进
概念
练习
设计
电极
条件
【交流
·
研讨二】
1、原电池结构分为几部分?
2、盐桥有何作用?
3、溶液中通过何种方式形成电流?
4、离子的流向?
两个半电池、盐桥
隔离氧化剂和还原剂,提高能量转化效率
离子通道 离子库 离子导体
盐桥:饱和KCl溶液(以琼胶制作成冻胶)
阴阳离子的定向移动
K+流向正极
Cl-流向负极
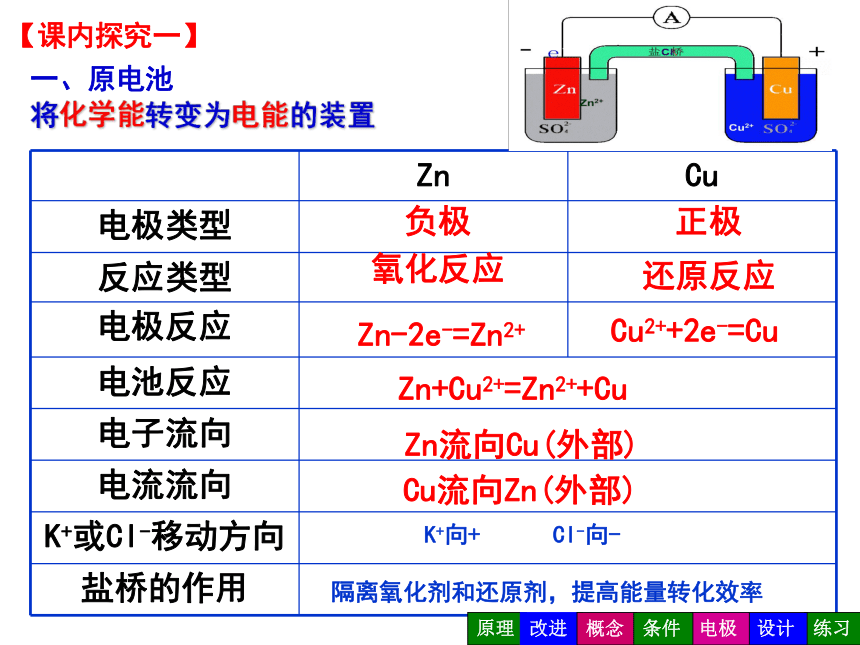
【课内探究一】
原电池装置改进
负极
正极
氧化反应
还原反应
Zn-2e-=Zn2+
Cu2++2e-=Cu
Zn+Cu2+=Zn2++Cu
Zn流向Cu(外部)
Cu流向Zn(外部)
将化学能转变为电能的装置
一、原电池
隔离氧化剂和还原剂,提高能量转化效率
K+向+
Cl-向-
原理
改进
概念
练习
设计
电极
条件
【课内探究一】
Zn
Cu
电极类型
反应类型
电极反应
电池反应
电子流向
电流流向
K+或Cl-移动方向
盐桥的作用
条件二:活泼性不同的两个电极
负极:较活泼的金属
正极:较不活泼的金属、石墨等
条件三:有电解质溶液
条件四:必须形成闭合回路
例1.在理论上不能用于设计原电池的化学反应是( )
A.H2SO4+BaCl2===BaSO4↓+2HCl
B.2CH3OH+3O2===2CO2+4H2O
C.4Fe(OH)2+2H2O+O2==4Fe(OH)3
D.3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O
A
条件一:有自发进行的氧化还原反应
原理
改进
概念
练习
设计
电极
条件
【课内探究二】
构成原电池的条件
巩固练习
1、下列装置可以组成原电池的是
二.构成原电池的条件:
(1)、有两种活动性不同的金属或一种是非
金属导体如碳棒构成的电极。
(2)、电解质溶液(酸.碱.盐)
(3)、有自发进行的氧化还原反应。
(4)、正极、负极、电解质溶液构成闭合回路
原理
改进
概念
练习
设计
电极
条件
【课内探究二】
①
正极
:Al
负极:Mg
②
正极
:Mg
负极:Al
③
正极
:Fe
负极:Cu
④
正极
:Cu
负极:Fe
原理
改进
概念
练习
设计
电极
条件
【课内探究三】原电池的正负极判断
三、原电池的正负极判断
电极材料
活泼金属
较不活泼金属或非金属
负
极
正
极
电极反应
电子流向
反应现象
离子迁移
氧化反应
电子流出
溶解减质
阴离子流入
还原反应
电子流入
产气增重
阳离子流入
原理
改进
概念
练习
设计
电极
条件
【课内探究三】
巩固练习2、某电池中有以下材料,判断正负极材料及其各电极上主要反应物。
(1)Pb、PbO2、稀H2SO4溶液、PbSO4
(2)Cd、NiO(OH)、KOH溶液、Cd(OH)2、Ni(OH)2
(3)MnO2、Ag、NaCl、Na2Mn5O10、AgCl
(4)Mg、H2O2、稀H2SO4、MgSO4、Pt
(5)Fe3+、I-、Fe2+、I2
、石墨
(6)MnO4-、
H+
、Fe2+
、Mn2+、Fe3+、H2O、石墨
原理
改进
概念
练习
设计
电极
条件
【课堂拓展】
四、原电池设计思路:
1.找出反应
2.判定电极
3.确定溶液
4.设计装置
例3、请根据反应:2Fe3++Fe=3Fe2+,设计原电池,你有哪些可行方案?画出装置图。
原理
改进
概念
练习
设计
电极
条件
【课内探究四】
四、原电池设计思路:
1.找出反应
2.判定电极
3.确定溶液
4.设计装置
巩固练习3、利用以下反应,能否设计原电池?若能设计成原电池,画出装置图。
(1)Zn+2Fe3+=Zn2++2Fe2+
(2)2H++SO32-
=SO2↑+H2O
(3)Zn+Ag2O+H2O
=Zn(OH)2
+2Ag
(KOH溶液中)
(4)2Al+2OH-
+2H2O
=
2AlO2-
+
3H2↑
原理
改进
概念
练习
设计
电极
条件
【课堂拓展】
原理
改进
概念
练习
设计
电极
条件
原电池设计思路:
1.找出反应
2.判定电极
3.确定溶液
4.设计装置
练习3、利用以下反应,设计原电池,画出装置图。
(1)Mg+H2O2+2H+=Mg2++2H2O
(2)2Fe3++2I-=2Fe2++I2
(3)MnO4-+5
Fe2+
+8H+
=Mn2++5
Fe3++4H2O
【课后练习】
再见
原理
改进
概念
练习
设计
电极
条件
三维目标
【知识与技能】
(1)了解原电池工作原理,判断电极,书写简单电极反应,掌握形成条件。
(2)
能设计原电池,学习实验研究的方法。
【过程与方法】
(1)
学习科学探究的基本方法,提高科学探究能力
(2)
学会运用观察、实验等多种手段获取信息,并对信息进行加工。
【情感、态度与价值观】
(1)
体验探究的快乐,感受化学的奇妙;增强将化学应用于生活的意识。
(2)关注社会热点和科技前沿问题,增强环保意识,形成可持续发展思想。
【教学重点】1、工作原理
2、形成条件
3、判断电极
4、设计电池
【教学难点】工作原理、形成条件、判断电极、设计电池、培养探究能力
原理
改进
概念
练习
设计
电极
条件
【自主学习】回顾原电池装置及原理
电流表指针偏转
铜片上有气泡
锌片上有气泡
溶液的温度升高
实验现象
原理
改进
概念
练习
设计
电极
条件
Zn-Cu原电池工作原理
负极
正极
氧化反应
还原反应
Zn-2e-=Zn2+
2H++2e-=H2↑
Zn+2H+=Zn2++H2
↑
Zn流向Cu(外部)
Cu流向Zn(外部)
Zn移向Cu或负极移向正极(内部)
原理
改进
概念
练习
设计
电极
条件
【自主学习】
Zn
Cu
电极名称
反应类型
电极反应
电池反应
电子流向
电流流向
H+移动方向
【课内探究一】
原电池装置改进
【交流
·
研讨一】
1、反应停止了吗?
2、能量转变成何种形式?
3、如何改进原电池装置?
H2SO4溶液
?
ZnSO4溶液
盐桥
原理
改进
概念
练习
设计
电极
条件
原理
改进
概念
练习
设计
电极
条件
【交流
·
研讨二】
1、原电池结构分为几部分?
2、盐桥有何作用?
3、溶液中通过何种方式形成电流?
4、离子的流向?
两个半电池、盐桥
隔离氧化剂和还原剂,提高能量转化效率
离子通道 离子库 离子导体
盐桥:饱和KCl溶液(以琼胶制作成冻胶)
阴阳离子的定向移动
K+流向正极
Cl-流向负极
【课内探究一】
原电池装置改进
负极
正极
氧化反应
还原反应
Zn-2e-=Zn2+
Cu2++2e-=Cu
Zn+Cu2+=Zn2++Cu
Zn流向Cu(外部)
Cu流向Zn(外部)
将化学能转变为电能的装置
一、原电池
隔离氧化剂和还原剂,提高能量转化效率
K+向+
Cl-向-
原理
改进
概念
练习
设计
电极
条件
【课内探究一】
Zn
Cu
电极类型
反应类型
电极反应
电池反应
电子流向
电流流向
K+或Cl-移动方向
盐桥的作用
条件二:活泼性不同的两个电极
负极:较活泼的金属
正极:较不活泼的金属、石墨等
条件三:有电解质溶液
条件四:必须形成闭合回路
例1.在理论上不能用于设计原电池的化学反应是( )
A.H2SO4+BaCl2===BaSO4↓+2HCl
B.2CH3OH+3O2===2CO2+4H2O
C.4Fe(OH)2+2H2O+O2==4Fe(OH)3
D.3Cu+8HNO3===3Cu(NO3)2+2NO↑+4H2O
A
条件一:有自发进行的氧化还原反应
原理
改进
概念
练习
设计
电极
条件
【课内探究二】
构成原电池的条件
巩固练习
1、下列装置可以组成原电池的是
二.构成原电池的条件:
(1)、有两种活动性不同的金属或一种是非
金属导体如碳棒构成的电极。
(2)、电解质溶液(酸.碱.盐)
(3)、有自发进行的氧化还原反应。
(4)、正极、负极、电解质溶液构成闭合回路
原理
改进
概念
练习
设计
电极
条件
【课内探究二】
①
正极
:Al
负极:Mg
②
正极
:Mg
负极:Al
③
正极
:Fe
负极:Cu
④
正极
:Cu
负极:Fe
原理
改进
概念
练习
设计
电极
条件
【课内探究三】原电池的正负极判断
三、原电池的正负极判断
电极材料
活泼金属
较不活泼金属或非金属
负
极
正
极
电极反应
电子流向
反应现象
离子迁移
氧化反应
电子流出
溶解减质
阴离子流入
还原反应
电子流入
产气增重
阳离子流入
原理
改进
概念
练习
设计
电极
条件
【课内探究三】
巩固练习2、某电池中有以下材料,判断正负极材料及其各电极上主要反应物。
(1)Pb、PbO2、稀H2SO4溶液、PbSO4
(2)Cd、NiO(OH)、KOH溶液、Cd(OH)2、Ni(OH)2
(3)MnO2、Ag、NaCl、Na2Mn5O10、AgCl
(4)Mg、H2O2、稀H2SO4、MgSO4、Pt
(5)Fe3+、I-、Fe2+、I2
、石墨
(6)MnO4-、
H+
、Fe2+
、Mn2+、Fe3+、H2O、石墨
原理
改进
概念
练习
设计
电极
条件
【课堂拓展】
四、原电池设计思路:
1.找出反应
2.判定电极
3.确定溶液
4.设计装置
例3、请根据反应:2Fe3++Fe=3Fe2+,设计原电池,你有哪些可行方案?画出装置图。
原理
改进
概念
练习
设计
电极
条件
【课内探究四】
四、原电池设计思路:
1.找出反应
2.判定电极
3.确定溶液
4.设计装置
巩固练习3、利用以下反应,能否设计原电池?若能设计成原电池,画出装置图。
(1)Zn+2Fe3+=Zn2++2Fe2+
(2)2H++SO32-
=SO2↑+H2O
(3)Zn+Ag2O+H2O
=Zn(OH)2
+2Ag
(KOH溶液中)
(4)2Al+2OH-
+2H2O
=
2AlO2-
+
3H2↑
原理
改进
概念
练习
设计
电极
条件
【课堂拓展】
原理
改进
概念
练习
设计
电极
条件
原电池设计思路:
1.找出反应
2.判定电极
3.确定溶液
4.设计装置
练习3、利用以下反应,设计原电池,画出装置图。
(1)Mg+H2O2+2H+=Mg2++2H2O
(2)2Fe3++2I-=2Fe2++I2
(3)MnO4-+5
Fe2+
+8H+
=Mn2++5
Fe3++4H2O
【课后练习】
再见
