苏教版高中化学必修二2.3.4《电解的应用》(共17张PPT)
文档属性
| 名称 | 苏教版高中化学必修二2.3.4《电解的应用》(共17张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 723.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-08 22:00:30 | ||
图片预览



文档简介
(共17张PPT)
第4课时
电解的应用
第三单元
化学能与电能的转化
专题2
化学反应与能量转化
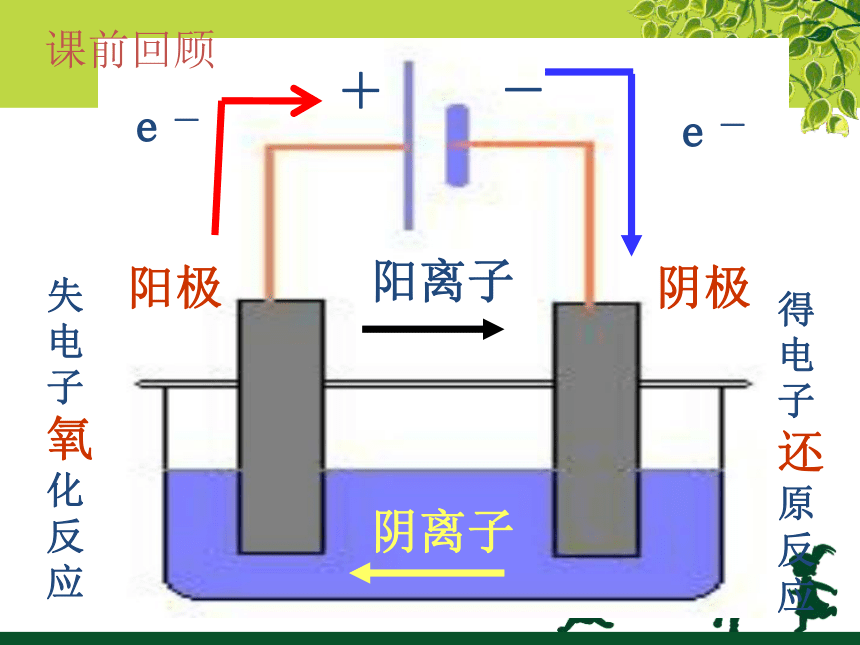
+
-
阴极
阳极
e-
阳离子
阴离子
得电子还原反应
失电子氧化反应
e-
课前回顾
原电池、电解池的比较
原电池
电解池
定义
化学能转变成电能的装置。自发的氧化还原反应
将电能转变成化学能的装置。非自发的氧化还原反应
形成
条件
①自发的氧化还原反应
②两电极
③电解质溶液
④形成闭合回路
①直流电源
②两电极
③电解质溶液
④形成闭合回路
电极
名称
负极:电子流出
正极:电子流入
阳极:与电源正极相连
阴极:与电源负极相连
电极
反应
负极:氧化反应
正极:还原反应
阳极:氧化反应
阴极:还原反应
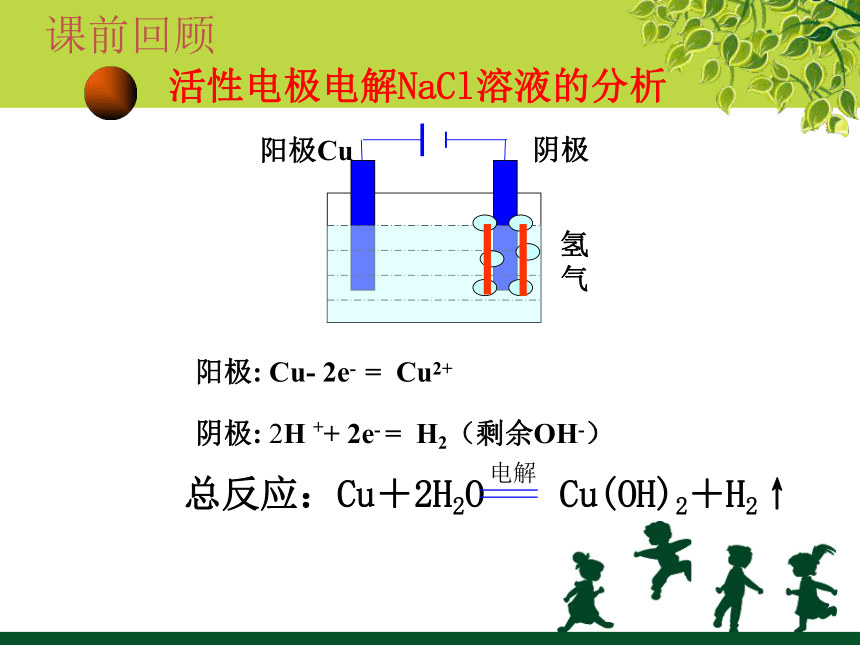
活性电极电解NaCl溶液的分析
阴极
阳极Cu
氢
气
阳极:
Cu-
2e-
=
Cu2+
总反应:Cu+2H2O
Cu(OH)2+H2↑
阴极:
2H
++
2e-
=
H2(剩余OH-)
课前回顾
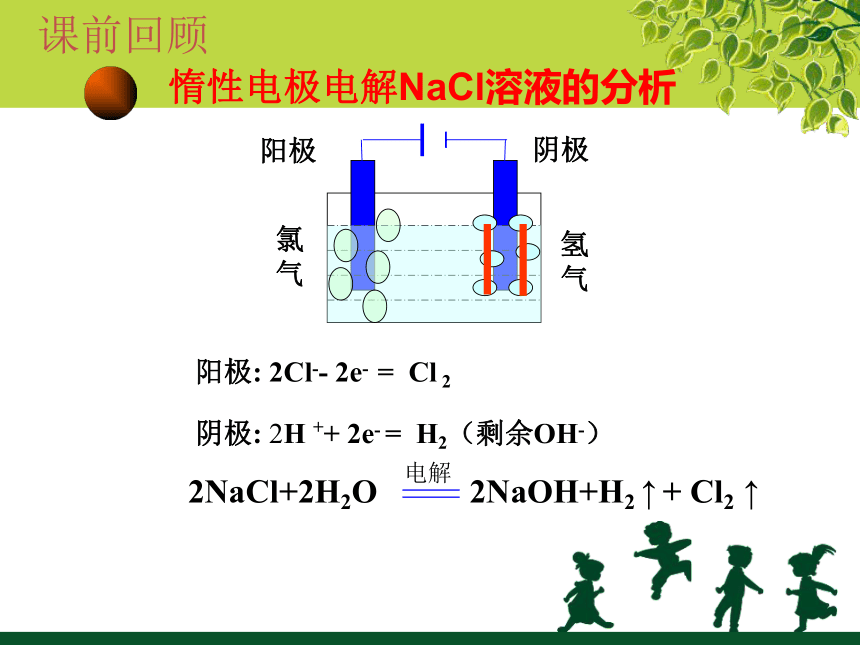
惰性电极电解NaCl溶液的分析
阴极
阳极
氢
气
氯气
阳极:
2Cl--
2e-
=
Cl
2
阴极:
2H
++
2e-
=
H2(剩余OH-)
2NaCl+2H2O
2NaOH+H2
↑
+
Cl2
↑
课前回顾
关闭S2和S3
,
打开S1时,该装置为
原电池
负极:Zn-2e-=Zn2+
正极:2H++2e-=H2
关闭S1和S3
,
打开S2时,该装置为
电解池
阳极:Zn-2e-=Zn2+
阴极:2H++2e-=H2
关闭S1和S2,
打开S3时,该装置为
电解池
阳极:Cu-2e-=Cu2+
阴极:2H++2e-=H2
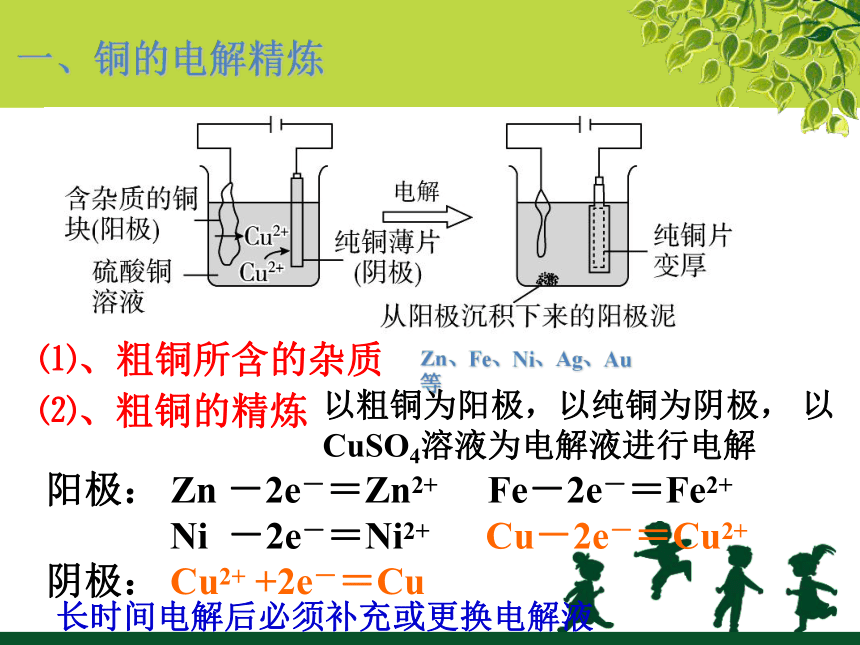
一、铜的电解精炼
⑴、粗铜所含的杂质
Zn、Fe、Ni、Ag、Au等
⑵、粗铜的精炼
以粗铜为阳极,以纯铜为阴极,
以CuSO4溶液为电解液进行电解
阳极:
Zn
-2e-=Zn2+
Fe-2e-=Fe2+
Ni
-2e-=Ni2+
Cu-2e-=Cu2+
阴极:
Cu2+
+2e-=Cu
长时间电解后必须补充或更换电解液
【练习】1.以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是( )
①电能全部转化为化学能
②粗铜接电源正极,发生氧化反应
③溶液中Cu2+向阳极移动
④利用阳极泥可回收Ag、Pt、Au等金属
A.①②
B.②③
C.①③
D.②④
D
二、电镀
(1)
电镀是利用电解原理在某些镀件上镀上一层其他金属或合金的过程,是电解的一个重要应用。
(2)
电镀池的形成条件
阴极:待镀金属制品(镀件)
阳极:镀层金属
电镀液:含有镀层金属阳离子的可溶性盐溶液
实验现象
阳极:
阴极:
铜变细变小
有红色固体产生
电极反应式
Cu-2e-=
Cu2+
Cu2++2e-=Cu
电镀液的组成及酸碱性不会变化
【练习】2.在铁制品上镀上一定厚度的铜层,以下设计方案正确的是( )
A.铜作阳极,镀件作阴极,溶液中含有铜离子科+
B.铁作阴极,镀件作阳极,溶液中含有铜离子
C.铁作阳极,镀件作阴极,溶液中含有亚铁离子
D.铜作阴极,镀件作阳极,溶液中含有锌离子
A
三、氯碱工业——电解饱和食盐水
【练习】3.关于电解NaCl水溶液,下列叙述正确的是( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞溶液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后,溶液呈中性
B
钠的制取
镁的制取
铝的制取
四、活泼金属的冶炼
【练习】4.下列物质的制备,不符合工业生产实际的是( )
A.工业上用电解熔融无水氯化镁制单质镁
B.工业上用二氧化硅在高温下与焦炭反应制得粗硅
C.工业上用电解饱和食盐水制金属钠
D.工业上制硫酸的设备有沸腾炉、接触室、吸收塔
C
我来解决
思考:铅蓄电池充电时,Pb与PbO2分别在哪个电极上生成。
谢谢!
第4课时
电解的应用
第三单元
化学能与电能的转化
专题2
化学反应与能量转化
+
-
阴极
阳极
e-
阳离子
阴离子
得电子还原反应
失电子氧化反应
e-
课前回顾
原电池、电解池的比较
原电池
电解池
定义
化学能转变成电能的装置。自发的氧化还原反应
将电能转变成化学能的装置。非自发的氧化还原反应
形成
条件
①自发的氧化还原反应
②两电极
③电解质溶液
④形成闭合回路
①直流电源
②两电极
③电解质溶液
④形成闭合回路
电极
名称
负极:电子流出
正极:电子流入
阳极:与电源正极相连
阴极:与电源负极相连
电极
反应
负极:氧化反应
正极:还原反应
阳极:氧化反应
阴极:还原反应
活性电极电解NaCl溶液的分析
阴极
阳极Cu
氢
气
阳极:
Cu-
2e-
=
Cu2+
总反应:Cu+2H2O
Cu(OH)2+H2↑
阴极:
2H
++
2e-
=
H2(剩余OH-)
课前回顾
惰性电极电解NaCl溶液的分析
阴极
阳极
氢
气
氯气
阳极:
2Cl--
2e-
=
Cl
2
阴极:
2H
++
2e-
=
H2(剩余OH-)
2NaCl+2H2O
2NaOH+H2
↑
+
Cl2
↑
课前回顾
关闭S2和S3
,
打开S1时,该装置为
原电池
负极:Zn-2e-=Zn2+
正极:2H++2e-=H2
关闭S1和S3
,
打开S2时,该装置为
电解池
阳极:Zn-2e-=Zn2+
阴极:2H++2e-=H2
关闭S1和S2,
打开S3时,该装置为
电解池
阳极:Cu-2e-=Cu2+
阴极:2H++2e-=H2
一、铜的电解精炼
⑴、粗铜所含的杂质
Zn、Fe、Ni、Ag、Au等
⑵、粗铜的精炼
以粗铜为阳极,以纯铜为阴极,
以CuSO4溶液为电解液进行电解
阳极:
Zn
-2e-=Zn2+
Fe-2e-=Fe2+
Ni
-2e-=Ni2+
Cu-2e-=Cu2+
阴极:
Cu2+
+2e-=Cu
长时间电解后必须补充或更换电解液
【练习】1.以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是( )
①电能全部转化为化学能
②粗铜接电源正极,发生氧化反应
③溶液中Cu2+向阳极移动
④利用阳极泥可回收Ag、Pt、Au等金属
A.①②
B.②③
C.①③
D.②④
D
二、电镀
(1)
电镀是利用电解原理在某些镀件上镀上一层其他金属或合金的过程,是电解的一个重要应用。
(2)
电镀池的形成条件
阴极:待镀金属制品(镀件)
阳极:镀层金属
电镀液:含有镀层金属阳离子的可溶性盐溶液
实验现象
阳极:
阴极:
铜变细变小
有红色固体产生
电极反应式
Cu-2e-=
Cu2+
Cu2++2e-=Cu
电镀液的组成及酸碱性不会变化
【练习】2.在铁制品上镀上一定厚度的铜层,以下设计方案正确的是( )
A.铜作阳极,镀件作阴极,溶液中含有铜离子科+
B.铁作阴极,镀件作阳极,溶液中含有铜离子
C.铁作阳极,镀件作阴极,溶液中含有亚铁离子
D.铜作阴极,镀件作阳极,溶液中含有锌离子
A
三、氯碱工业——电解饱和食盐水
【练习】3.关于电解NaCl水溶液,下列叙述正确的是( )
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞溶液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后,溶液呈中性
B
钠的制取
镁的制取
铝的制取
四、活泼金属的冶炼
【练习】4.下列物质的制备,不符合工业生产实际的是( )
A.工业上用电解熔融无水氯化镁制单质镁
B.工业上用二氧化硅在高温下与焦炭反应制得粗硅
C.工业上用电解饱和食盐水制金属钠
D.工业上制硫酸的设备有沸腾炉、接触室、吸收塔
C
我来解决
思考:铅蓄电池充电时,Pb与PbO2分别在哪个电极上生成。
谢谢!
