人教化学选修4第四章 第一节 原电池 (2)(共24张PPT)
文档属性
| 名称 | 人教化学选修4第四章 第一节 原电池 (2)(共24张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-09 08:23:15 | ||
图片预览




文档简介
(共24张PPT)
第四章
电化学基础
电化学:研究化学能与电能相互转换的装置、过程和效率的科学。
1.原电池原理?
2.原电池形成条件有哪些?
3.原电池正、负极的选择及判断
复习回顾:
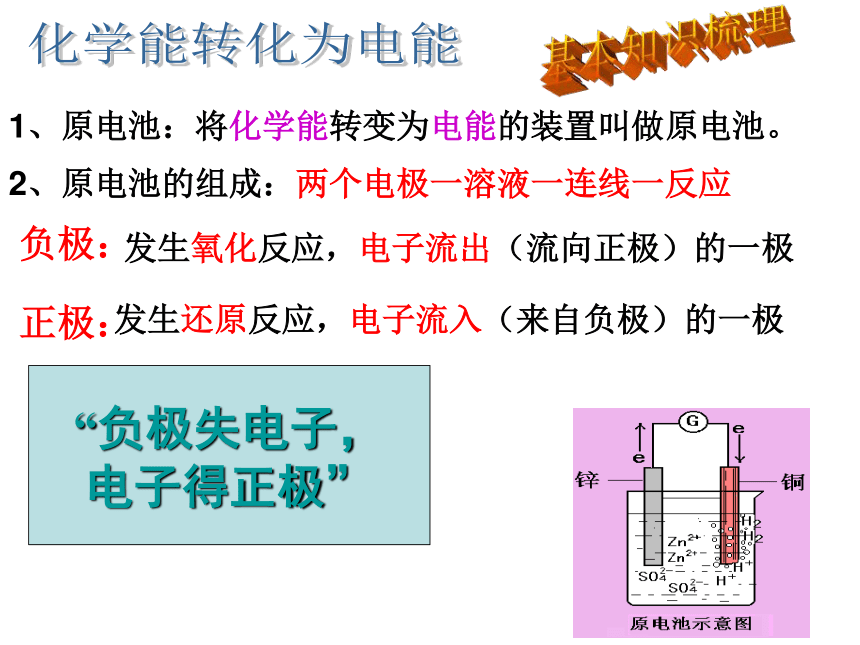
1、原电池:将化学能转变为电能的装置叫做原电池。
2、原电池的组成:两个电极一溶液一连线一反应
负极:
发生氧化反应,电子流出(流向正极)的一极
正极:
发生还原反应,电子流入(来自负极)的一极
“负极失电子,
电子得正极”
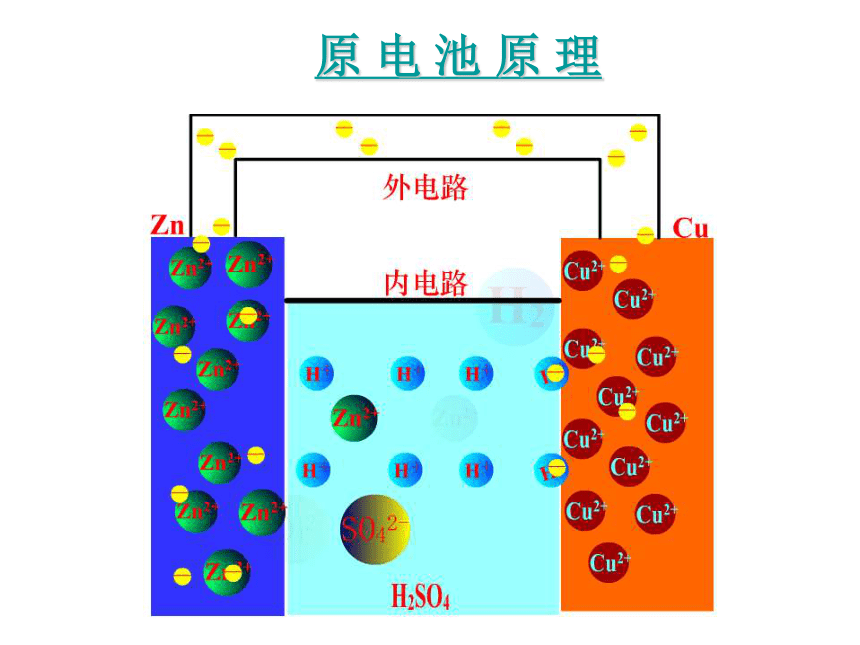
原
电
池
原
理
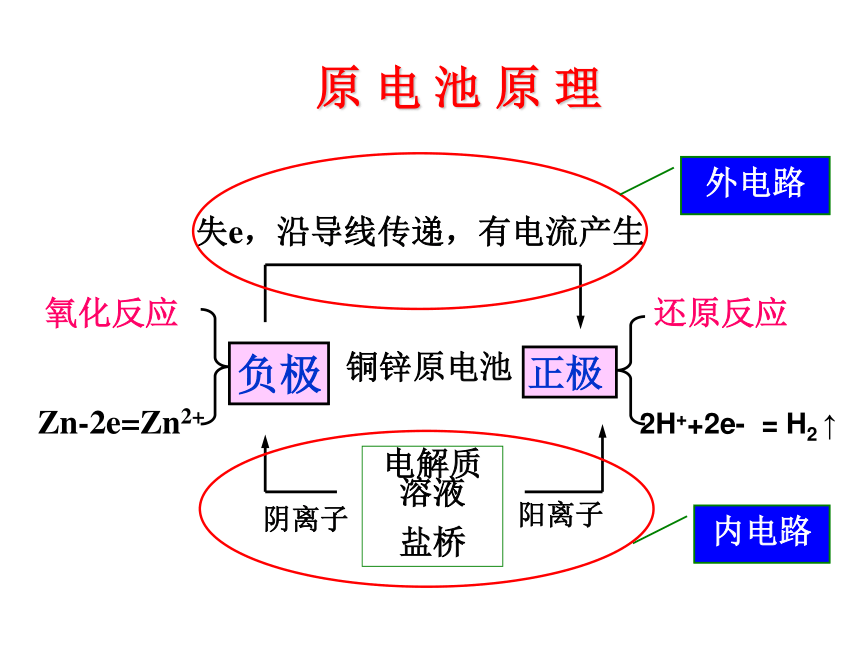
氧化反应
Zn-2e=Zn2+
铜锌原电池
电解质溶液
盐桥
失e,沿导线传递,有电流产生
还原反应
2H++2e-
=
H2
↑
阴离子
阳离子
负极
正极
原
电
池
原
理
外电路
内电路
原电池分两极,
负极氧化正还原;
电子由负流向正,
离子阳正阴向负。
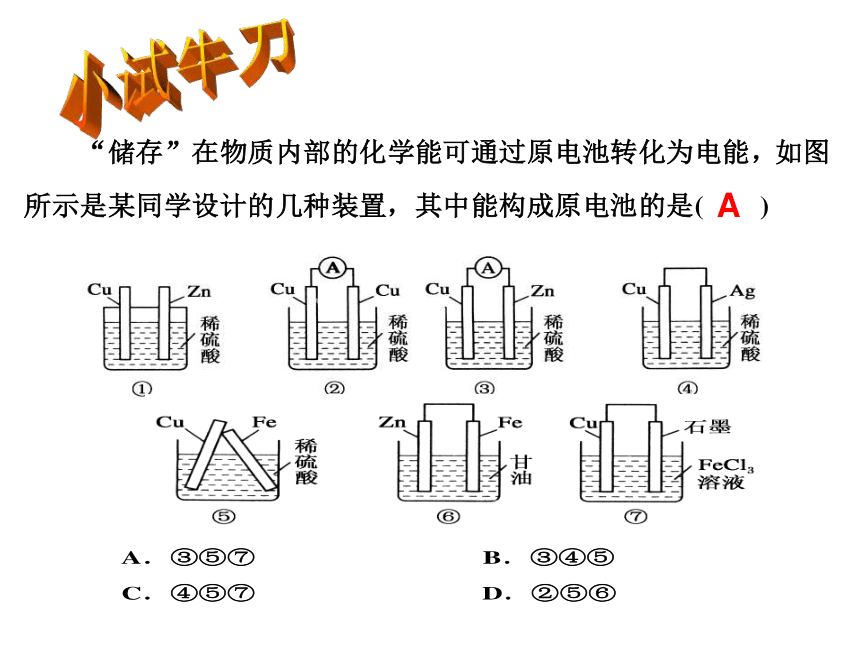
A
构成原电池的条件
1.两种活性不同的电极
2.电解质溶液
3.闭合回路
4.自发的氧化还原反应
记忆技巧:两极---液---连线---反应
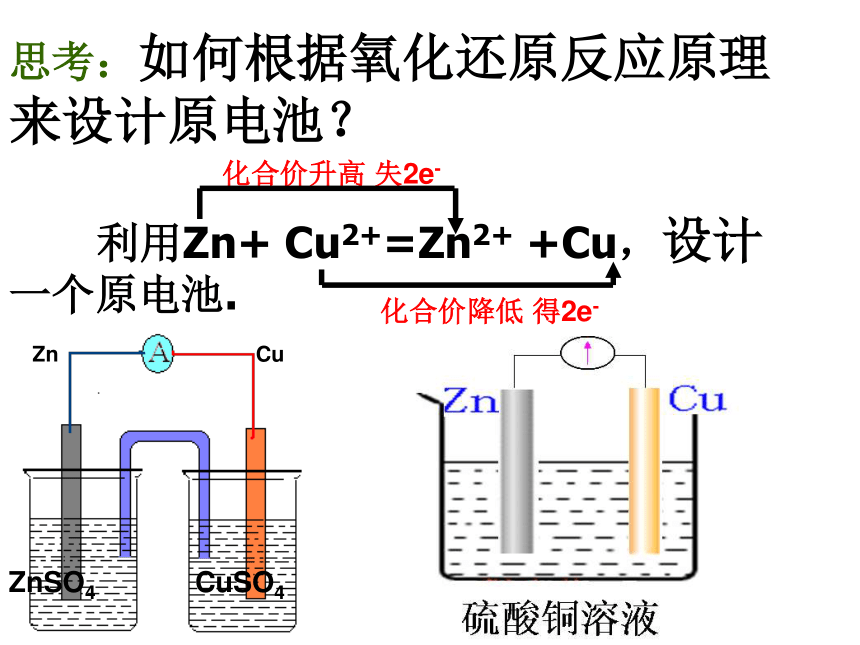
思考:如何根据氧化还原反应原理来设计原电池?
利用Zn+
Cu2+=Zn2+
+Cu,设计一个原电池.
Cu
Zn
CuSO4
ZnSO4
化合价升高
失2e-
化合价降低
得2e-
对锌铜原电
池工作原理的进一步探究
左图原电池的缺点:效率低,而且时间稍长电流就很快减弱。
思考:这是什么原因造成的呢?
有没有什么改进措施?
造成的主要原因:由于锌片与硫酸铜溶液直
接接触,在反应一段时间后,难以避免溶液
中有铜离子在锌片表面直接还原,一旦有少
量的铜在锌片表面析出,即在负极(锌)表
面也构成了原电池,进一步加速铜在负极锌
表面析出,致使向外输出的电流强度减弱。
当锌片表面完全被铜覆盖后,不再构成原
电池了,也就没有电流在产生。
改进措施?
将锌片与硫酸铜溶液隔离
硫酸锌溶液
硫酸铜溶液
改进为所示的原电池装置---盐桥式原电池
盐桥中通常装有含琼胶的KCl饱和溶液
此装置优点:能稳定长时间放电
盐桥的作用是什么?改进后的装置为什么能够持续、稳定的产生电流?
阅读教材72页
盐桥的作用:
(1)使整个装置构成通路,代替两溶液直接接触。
(2)平衡电荷,保持溶液电中性。
盐桥中电解质的选择?
若电解质溶液与KCl溶液反应产生沉淀,可用饱KNO3溶液等代替KCl作盐桥。
指出电池的正负极,并分别写出负极和正极的电极反应式以及该电池的总反应方程式。
负极(锌片):
Zn
-2e
-
=
Zn
2+
(氧化反应)
正极(铜片):
Cu2+
+
2e
-
=
Cu
(还原反应)
电池反应(总化学方程式):Zn
+
Cu2+
=
Zn
2+
+
Cu
电池符号:
Zn
︱
ZnSO4‖
CuSO4
︱
Cu
负极
盐桥
正极
一、由两个半电池组成原电池(盐桥式原电池)的工作原理
①用还原性较强的物质作为负极,负极向外电路提供电子;
用氧化性较强的物质作为正极,正极从外电路得到电子。
②原电池的内部及盐桥,通过阴阳离子的定向运动而形成内电路。
二、原电池的正负极的判断方法
电子流出的极
电子流入的极
——负极
——正极
较活泼的电极材料
较不活泼的电极材料
——负极
——正极
宏观判断:
①根据电极材料
②根据原电池电极
发生的反应
——负极
——正极
发生氧化反应的极
发生还原反应的极
③根据电极增重还是减重
④根据电极有气泡冒出:
质量增加的电极
工作后
质量减少的电极
——正极
——负极
工作后,有气泡冒出的电极为正极
1、根据氧化还原反应电子转移判断电极反应。
2、根据电极反应确定合适的电极材料和电解质溶液
三、原电池的设计
利用
设计一个原电池.
化合价升高
失2e-
化合价降低
得2e-
Cu+
2
Fe3+
=
Cu2+
+
2Fe2+
电解质溶液一般要能够与负极发生反应。但若是两个半反应分别在两个烧杯中进行,则左右两个烧杯中的电解质溶液应与电极材料具有相同的阳离子。
Cu
C
CuCl2
FeCl3
装置图
离子方程式Cu+
2
Fe3+
=
Cu2+
+
2Fe2+
知识拓展--原电池的应用
①加快反应速率:
(形成原电池反应,反应速率加快)
例如,实验室制H2时,由于锌太纯,反应一般较慢,可加入少量CuSO4以加快反应速率。
②揭示钢铁腐蚀的原因及防止钢铁的腐蚀。
钢铁中含有碳,可与Fe组成原电池,发生原电池反应而使钢铁遭到腐蚀
[例]
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y是电池的负极。X、Y、Z三种金属的活动性顺序为(
)
A.X>Y>Z B.X>Z>Y
C.Y>X>Z D.Y>Z>X
C
因为X置换出Z,所以金属性X>Z
负极的金属较活泼,所以Y>X
③判断金属活动性的强弱
一般说来:
活泼金属作负极,较不活泼的金属作正极
Cu+
2
AgNO3
=
Cu(NO3)2
+
2Ag
化合价升高失2e-
化合价降低得2e-
电极:负极是Cu,正极可以是Ag或C等。
电极反应式:
负极:Cu
–
2e-
=
Cu2+
正极:2Ag+
+
2e-
=
2
Ag
电解液:
Cu(NO3)2
、AgNO3
利用下面反应设计原电池选择电极材料和电解质溶液,写出电极方程式;并画出原电池简意图。
④制作化学电源
第四章
电化学基础
电化学:研究化学能与电能相互转换的装置、过程和效率的科学。
1.原电池原理?
2.原电池形成条件有哪些?
3.原电池正、负极的选择及判断
复习回顾:
1、原电池:将化学能转变为电能的装置叫做原电池。
2、原电池的组成:两个电极一溶液一连线一反应
负极:
发生氧化反应,电子流出(流向正极)的一极
正极:
发生还原反应,电子流入(来自负极)的一极
“负极失电子,
电子得正极”
原
电
池
原
理
氧化反应
Zn-2e=Zn2+
铜锌原电池
电解质溶液
盐桥
失e,沿导线传递,有电流产生
还原反应
2H++2e-
=
H2
↑
阴离子
阳离子
负极
正极
原
电
池
原
理
外电路
内电路
原电池分两极,
负极氧化正还原;
电子由负流向正,
离子阳正阴向负。
A
构成原电池的条件
1.两种活性不同的电极
2.电解质溶液
3.闭合回路
4.自发的氧化还原反应
记忆技巧:两极---液---连线---反应
思考:如何根据氧化还原反应原理来设计原电池?
利用Zn+
Cu2+=Zn2+
+Cu,设计一个原电池.
Cu
Zn
CuSO4
ZnSO4
化合价升高
失2e-
化合价降低
得2e-
对锌铜原电
池工作原理的进一步探究
左图原电池的缺点:效率低,而且时间稍长电流就很快减弱。
思考:这是什么原因造成的呢?
有没有什么改进措施?
造成的主要原因:由于锌片与硫酸铜溶液直
接接触,在反应一段时间后,难以避免溶液
中有铜离子在锌片表面直接还原,一旦有少
量的铜在锌片表面析出,即在负极(锌)表
面也构成了原电池,进一步加速铜在负极锌
表面析出,致使向外输出的电流强度减弱。
当锌片表面完全被铜覆盖后,不再构成原
电池了,也就没有电流在产生。
改进措施?
将锌片与硫酸铜溶液隔离
硫酸锌溶液
硫酸铜溶液
改进为所示的原电池装置---盐桥式原电池
盐桥中通常装有含琼胶的KCl饱和溶液
此装置优点:能稳定长时间放电
盐桥的作用是什么?改进后的装置为什么能够持续、稳定的产生电流?
阅读教材72页
盐桥的作用:
(1)使整个装置构成通路,代替两溶液直接接触。
(2)平衡电荷,保持溶液电中性。
盐桥中电解质的选择?
若电解质溶液与KCl溶液反应产生沉淀,可用饱KNO3溶液等代替KCl作盐桥。
指出电池的正负极,并分别写出负极和正极的电极反应式以及该电池的总反应方程式。
负极(锌片):
Zn
-2e
-
=
Zn
2+
(氧化反应)
正极(铜片):
Cu2+
+
2e
-
=
Cu
(还原反应)
电池反应(总化学方程式):Zn
+
Cu2+
=
Zn
2+
+
Cu
电池符号:
Zn
︱
ZnSO4‖
CuSO4
︱
Cu
负极
盐桥
正极
一、由两个半电池组成原电池(盐桥式原电池)的工作原理
①用还原性较强的物质作为负极,负极向外电路提供电子;
用氧化性较强的物质作为正极,正极从外电路得到电子。
②原电池的内部及盐桥,通过阴阳离子的定向运动而形成内电路。
二、原电池的正负极的判断方法
电子流出的极
电子流入的极
——负极
——正极
较活泼的电极材料
较不活泼的电极材料
——负极
——正极
宏观判断:
①根据电极材料
②根据原电池电极
发生的反应
——负极
——正极
发生氧化反应的极
发生还原反应的极
③根据电极增重还是减重
④根据电极有气泡冒出:
质量增加的电极
工作后
质量减少的电极
——正极
——负极
工作后,有气泡冒出的电极为正极
1、根据氧化还原反应电子转移判断电极反应。
2、根据电极反应确定合适的电极材料和电解质溶液
三、原电池的设计
利用
设计一个原电池.
化合价升高
失2e-
化合价降低
得2e-
Cu+
2
Fe3+
=
Cu2+
+
2Fe2+
电解质溶液一般要能够与负极发生反应。但若是两个半反应分别在两个烧杯中进行,则左右两个烧杯中的电解质溶液应与电极材料具有相同的阳离子。
Cu
C
CuCl2
FeCl3
装置图
离子方程式Cu+
2
Fe3+
=
Cu2+
+
2Fe2+
知识拓展--原电池的应用
①加快反应速率:
(形成原电池反应,反应速率加快)
例如,实验室制H2时,由于锌太纯,反应一般较慢,可加入少量CuSO4以加快反应速率。
②揭示钢铁腐蚀的原因及防止钢铁的腐蚀。
钢铁中含有碳,可与Fe组成原电池,发生原电池反应而使钢铁遭到腐蚀
[例]
X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X与Y组成原电池时,Y是电池的负极。X、Y、Z三种金属的活动性顺序为(
)
A.X>Y>Z B.X>Z>Y
C.Y>X>Z D.Y>Z>X
C
因为X置换出Z,所以金属性X>Z
负极的金属较活泼,所以Y>X
③判断金属活动性的强弱
一般说来:
活泼金属作负极,较不活泼的金属作正极
Cu+
2
AgNO3
=
Cu(NO3)2
+
2Ag
化合价升高失2e-
化合价降低得2e-
电极:负极是Cu,正极可以是Ag或C等。
电极反应式:
负极:Cu
–
2e-
=
Cu2+
正极:2Ag+
+
2e-
=
2
Ag
电解液:
Cu(NO3)2
、AgNO3
利用下面反应设计原电池选择电极材料和电解质溶液,写出电极方程式;并画出原电池简意图。
④制作化学电源
