人教版高二化学选修4 第三章第一节 弱电解质的电离(35张PPT)
文档属性
| 名称 | 人教版高二化学选修4 第三章第一节 弱电解质的电离(35张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-09 00:00:00 | ||
图片预览









文档简介
(共35张PPT)
第一节
弱电解质的电离
第三章
水溶液中的离子平衡
人教版选修四《化学反应原理》
思考:1、什么叫电解质?非电解质?强电解质?弱电解质?
自主预习
2、如何表示电解质的电离?举例说明。
3、联系化学平衡的特点总结:
弱电解质的电离有何特点?
影响电离平衡的因素有哪些?
4、电离平衡常数表达式如何?受什么影响?
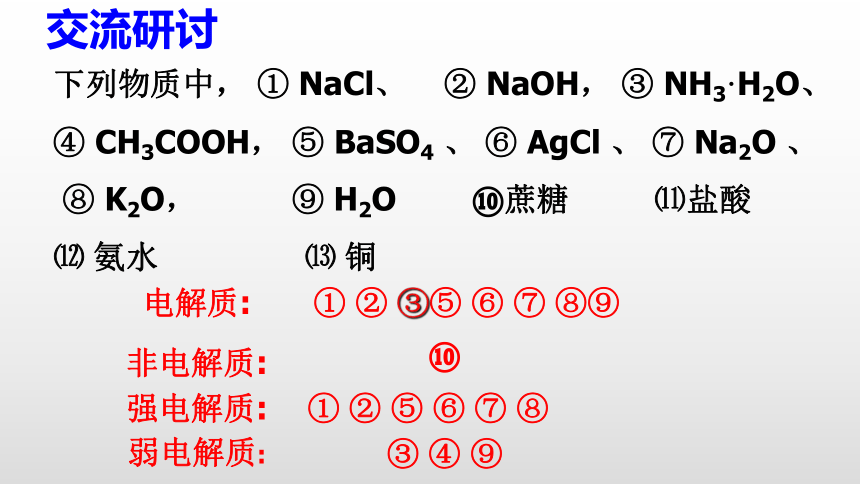
下列物质中,
①
NaCl、
②
NaOH,
③
NH3·H2O、
④
CH3COOH,
⑤
BaSO4
、
⑥
AgCl
、
⑦
Na2O
、
⑧
K2O,
⑨
H2O
⑩蔗糖
⑾盐酸
⑿
氨水
⒀
铜
强电解质:
①
②
⑤
⑥
⑦
⑧
弱电解质:
③
④
⑨
交流研讨
电解质:
非电解质:
①
②
③⑤
⑥
⑦
⑧⑨
⑩
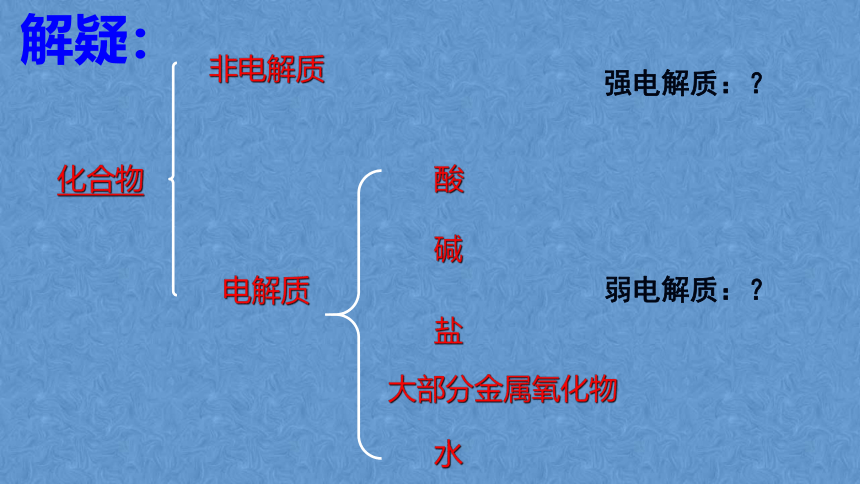
电解质
非电解质
化合物
强电解质:?
弱电解质:?
酸
碱
大部分金属氧化物
盐
水
解疑:
强酸:H2SO4、HNO3、HCl、HBr、
HI、HClO4等;
弱酸:CH3COOH、H2SO3、H2CO3、
H3PO4、HCN、HClO、HF、
H2S、H2SiO3(难溶)等;
强碱:NaOH、KOH、Ba(OH)2、
Ca(OH)2等;
弱碱:NH3·H2O(可溶)、Mg(OH)2、
Fe(OH)3、Cu(OH)2等等
常见的酸与碱
上述物质属于强电解质的是______
属于弱电解质的是_______________
(A).
H2S
(B)
H2SO4
(C)
HCl
(D)
HClO
(E).
Ba(OH)2
(F).
NH3?H2O
(G).
NaCl
(H).
H2O
(I)
C2H5OH(酒精)
B、C、E、G
A、D、F、H
练习:
书写电离方程式应注意哪些问题?
H3PO4
Cu(OH)2
NaHSO3
NaHSO4
H2SO4
Ba(OH)2
(c)
NaHSO3
(d)
NaHSO4
强酸的酸式盐完全电离
弱酸的酸式盐第一步完全电离
NaHSO3=Na++HSO3-
(a)多元弱酸的电离分步写
H3PO4
H+
+
H2PO4-
(1)
H2PO4-
H+
+
HPO42-
(2)
HPO42-
H+
+
PO43-
(3)
(b)多元弱碱一步书写
如:Cu(OH)2
Cu2+
+
2OH-
解疑:
弱用“可逆”强用“等”;多元弱酸分步写,多元弱碱一步“逆”
习题1
学以致用
B
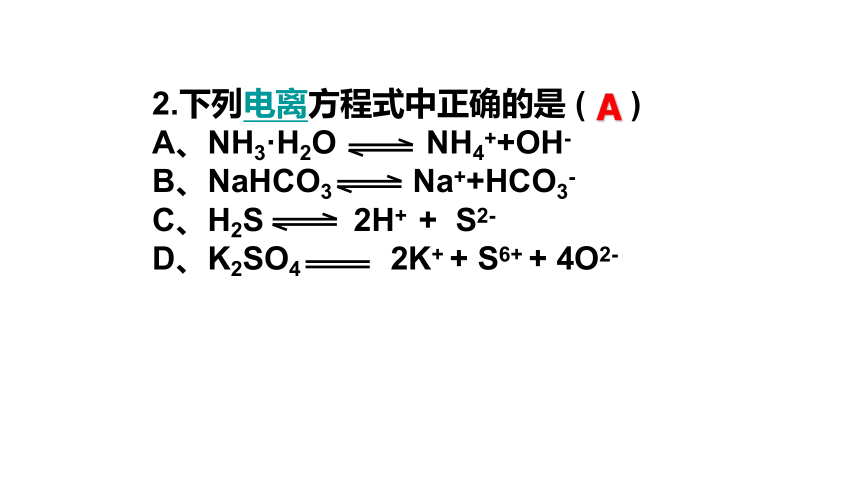
2.下列电离方程式中正确的是
(
)
A、NH3·H2O
NH4++OH-
B、NaHCO3
Na++HCO3-
C、H2S
2H+
+
S2-
D、K2SO4
2K+
+
S6+
+
4O2-
A
反应速率
弱电解质电离平衡状态建立示意图
时间
合作讨论:弱电解质的电离有何特点?
2.特征:
1.定义:
成果展示:弱电解质的电离平衡
3.影响电离平衡因素:
(1)内因:
(2)外界条件
弱电解质本身的性质
浓度
温度
稀释有利于电离
升温有利于电离
符合平衡移动原理
?
逆
等
动
定
变
下列几种情况能否引起电离平衡移动?
向哪个方向移动?
①加水
②通入氨气
③加NH4Cl固体
④加NaOH固体
⑤加CH3COOH溶液
⑥加MgCl2粉末
⑦
加热(不考虑氨气挥发)
⑧加压
在氨水中存在下列电离平衡:
NH3·H2O
NH4
+
+
OH
-
△H
>
0
[考考大家]
归纳总结、影响电离平衡的外界条件:
浓
度
①改变弱电解质浓度
②同离子效应:
减小生成的离子的浓度
a.加水稀释:正向移动,电离程度增大。
b.增大浓度:正向移动,电离程度减小
逆向移动
正向移动
温度:
电离吸热,升高温度,平衡正向移动
增大生成的离子的浓度
1、填表:0.1mol/L的CH3COOH溶液
CH3COOH
CH3COO-+H+
正
正
逆
正
正
学以致用
项目
平衡移动方向
加NaOH
加CH3COONa
加CH3COOH
加水
升温(电离吸热)
0.1mol/L的CH3COOH溶液中
CH3COOH
CH3COO-
+
H+对于该平衡,下列叙述正确的是(
)
A.加水时,平衡向逆反应方向移动
B.加少量NaOH固体,平衡向正反应方向移动
C.加少量0.1mol/L盐酸,溶液中c(H+)减小
D.加少量CH3COONa固体,平衡向正反应方向移动
练习2
B
?
催化剂
高温
△H<0
CH3COOH
CH3COO
-
+
H+
NH3·H2O
NH4+
+
OH
-
知识迁移
电离常数
对于一元弱酸
HA
H++A-
对于一元弱碱
BOH
B++OH-
注意:K值只随温度变化。
解疑:
思考:多元弱酸,分步电离,第一步电离大于第二步电离,第二步电离远大于第三步电离……,为什么?
多元弱酸是分步电离的,K1》K2(一般要相差105)。
多元弱酸的酸性由第一步电离决定。第二步和第三步的电离分别受到第一步和第二步、第三步的抑制。
[实验3-2]向1mol/LCH3COOH、饱和硼酸溶液中分别加入等浓度的碳酸钠溶液,观察现象,并比较三种酸(CH3COOH、硼酸、碳酸)的酸性强弱。
实验探究
25℃
1.75×10-5
>
4.4×10-7
>
5.8×10-10
电离平衡常数的意义
表示电离程度的相对大小,一般K值越大,
电离程度越大,相应酸
(碱)的酸(碱)性越强
试根据课本P43中“一些弱酸和弱碱的电离平衡常数”比较它们的相对强弱。
草酸>磷酸>柠檬酸>碳酸
学以致用
知识网络
弱电解质的电离
弱电解质
电离平衡
电离
特点
举例:弱酸、弱碱、水
特点:逆、等、动、定、变
影响因素
温度
浓度
同离子效应
平衡常数K只与温度有关
实验3-1:体积相同,浓度相同的盐酸和醋酸与等量镁条反应,并测量溶液的pH值
0
2
反应激烈
反应缓慢
分享成果
1mol/L
HCl
1mol/L
CH3COOH
溶液的pH值
与镁条反应现象
实验结果:
相同浓度的盐酸与醋酸,其溶液中
C(
H+盐酸)>
C(
H+醋酸)
。
说明:HCl和CH3COOH的电离程度不同。
A
1.下物质分类组合正确的是
(
)
A
B
C
D
强电解质:
HCl
FeCl3
H3PO4
Ca(OH)2
弱电解质:
HF
H2SO3
BaSO4
HNO3
非电解质:
CCl4
Cu
H2O
C2H5OH
2.化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂:
HIn(溶液红色)
H++In—(溶液无色)
浓度为0.02mol/L的下列溶液:①盐酸
②石灰水
③NaCl溶液
④NaHSO4溶液
⑤NaHCO3溶液
⑥氨水
其中能使指示剂显红色的是
(
)
A
①④⑤
B
②⑤⑥
C
①④
D
②③⑥
C
3.在RNH2·H2O
RNH3++OH-的平衡中,要使RNH2·H2O的电离程度及c(OH-)都增大,可采取的措施(
)
A.通入氯化氢
B.加少量氢氧化钠固体
C.加水
D.升温
D
有关电离常数的简单计算:
课本p44第4题
解析:设电离平衡时H+物质的量浓度为x
因醋酸的电离程度很小,
故0.010-x≈0.010
0.010
0
0
0.010-x
x
x
即
x2/0.010=1.75×10-5
x=4.2×10-4mol/L
K=
=1.75×10-5
=
5.已知三种酸HA、HB、HC的电离常数分别为a、b、c,且a>b>c,则对相同浓度的酸溶液叙述正确的是( )
A.HC的溶液c(H+)最大
B.HA溶液酸性最强
C.HC溶液的pH最小
D.三种溶液中酸的电离程度:HA6.醋酸的下列性质中,可以证明它是弱电解质的是( )
①1
mol·L-1的CH3COOH溶液中c(H+)=10-2mol·L-1 ②CH3COOH以任意比与H2O互溶 ③在相同条件下,CH3COOH溶液的导电性比盐酸弱 ④10
mL
1
mol·L-1的CH3COOH溶液恰好与10
mL
1
mol·L-1的NaOH溶液完全反应 ⑤同浓度同体积的CH3COOH溶液和HCl溶液与Fe反应时,CH3COOH溶液中放出H2的速率慢 ⑥CH3COOH溶液中CH3COOH、CH3COO-、H+同时存在
A.①③⑤⑥
B.②③④⑤
C.①④⑤⑥
D.③⑤⑥
7.根据下表数据(均在同温、同压下测定)
可得出弱电解质强弱顺序正确的是( )
A.HX>HY>HZ
B.HZ>HY>HX
C.HY>HZ>HX
D.HZ>HX>HY
酸
HX
HY
HZ
物质的量浓度
(mol·L-1)
0.1
0.2
0.3
电离平衡常数
7.2×10-4
1.8×10-4
1.8×10-5
8.已知下面三个数据:7.2×10-4、4.6×10-4、
4.9×10-10分别是三种酸的电离平衡常数,若已知这些酸可发生如下反应:
①NaCN+HNO2
HCN+NaNO2,
②NaNO2+HF
由此可判断下列叙述中,不正确的是( )
A.HF的电离平衡常数为7.2×10-4
B.HNO2的电离平衡常数为4.9×10-10
C.根据两个反应即可知三种酸的相对强弱
D.HNO2的电离平衡常数比HCN大,比HF小
HNO2+NaF。
9.欲使醋酸溶液中的c(CH3COO-)增大,且不放出气体,可向醋酸中加入少量下列中的哪种固体( )
A.NaCl
B.NaHCO3
C.CH3COOK
D.Mg
10、将6
g
CH3COOH溶于水制成1
L溶液,此溶液的物质的量浓度为________,经测定溶液中c(CH3COO-)为1.4×10-3
mol·L-1,此温度下醋酸的电离常数Ka=________,温度升高,Ka将__________________________________
(填“变大”、“不变”或“变小”,下同),加入少量CH3COONa后c(H+)
_________,Ka________。
第一节
弱电解质的电离
第三章
水溶液中的离子平衡
人教版选修四《化学反应原理》
思考:1、什么叫电解质?非电解质?强电解质?弱电解质?
自主预习
2、如何表示电解质的电离?举例说明。
3、联系化学平衡的特点总结:
弱电解质的电离有何特点?
影响电离平衡的因素有哪些?
4、电离平衡常数表达式如何?受什么影响?
下列物质中,
①
NaCl、
②
NaOH,
③
NH3·H2O、
④
CH3COOH,
⑤
BaSO4
、
⑥
AgCl
、
⑦
Na2O
、
⑧
K2O,
⑨
H2O
⑩蔗糖
⑾盐酸
⑿
氨水
⒀
铜
强电解质:
①
②
⑤
⑥
⑦
⑧
弱电解质:
③
④
⑨
交流研讨
电解质:
非电解质:
①
②
③⑤
⑥
⑦
⑧⑨
⑩
电解质
非电解质
化合物
强电解质:?
弱电解质:?
酸
碱
大部分金属氧化物
盐
水
解疑:
强酸:H2SO4、HNO3、HCl、HBr、
HI、HClO4等;
弱酸:CH3COOH、H2SO3、H2CO3、
H3PO4、HCN、HClO、HF、
H2S、H2SiO3(难溶)等;
强碱:NaOH、KOH、Ba(OH)2、
Ca(OH)2等;
弱碱:NH3·H2O(可溶)、Mg(OH)2、
Fe(OH)3、Cu(OH)2等等
常见的酸与碱
上述物质属于强电解质的是______
属于弱电解质的是_______________
(A).
H2S
(B)
H2SO4
(C)
HCl
(D)
HClO
(E).
Ba(OH)2
(F).
NH3?H2O
(G).
NaCl
(H).
H2O
(I)
C2H5OH(酒精)
B、C、E、G
A、D、F、H
练习:
书写电离方程式应注意哪些问题?
H3PO4
Cu(OH)2
NaHSO3
NaHSO4
H2SO4
Ba(OH)2
(c)
NaHSO3
(d)
NaHSO4
强酸的酸式盐完全电离
弱酸的酸式盐第一步完全电离
NaHSO3=Na++HSO3-
(a)多元弱酸的电离分步写
H3PO4
H+
+
H2PO4-
(1)
H2PO4-
H+
+
HPO42-
(2)
HPO42-
H+
+
PO43-
(3)
(b)多元弱碱一步书写
如:Cu(OH)2
Cu2+
+
2OH-
解疑:
弱用“可逆”强用“等”;多元弱酸分步写,多元弱碱一步“逆”
习题1
学以致用
B
2.下列电离方程式中正确的是
(
)
A、NH3·H2O
NH4++OH-
B、NaHCO3
Na++HCO3-
C、H2S
2H+
+
S2-
D、K2SO4
2K+
+
S6+
+
4O2-
A
反应速率
弱电解质电离平衡状态建立示意图
时间
合作讨论:弱电解质的电离有何特点?
2.特征:
1.定义:
成果展示:弱电解质的电离平衡
3.影响电离平衡因素:
(1)内因:
(2)外界条件
弱电解质本身的性质
浓度
温度
稀释有利于电离
升温有利于电离
符合平衡移动原理
?
逆
等
动
定
变
下列几种情况能否引起电离平衡移动?
向哪个方向移动?
①加水
②通入氨气
③加NH4Cl固体
④加NaOH固体
⑤加CH3COOH溶液
⑥加MgCl2粉末
⑦
加热(不考虑氨气挥发)
⑧加压
在氨水中存在下列电离平衡:
NH3·H2O
NH4
+
+
OH
-
△H
>
0
[考考大家]
归纳总结、影响电离平衡的外界条件:
浓
度
①改变弱电解质浓度
②同离子效应:
减小生成的离子的浓度
a.加水稀释:正向移动,电离程度增大。
b.增大浓度:正向移动,电离程度减小
逆向移动
正向移动
温度:
电离吸热,升高温度,平衡正向移动
增大生成的离子的浓度
1、填表:0.1mol/L的CH3COOH溶液
CH3COOH
CH3COO-+H+
正
正
逆
正
正
学以致用
项目
平衡移动方向
加NaOH
加CH3COONa
加CH3COOH
加水
升温(电离吸热)
0.1mol/L的CH3COOH溶液中
CH3COOH
CH3COO-
+
H+对于该平衡,下列叙述正确的是(
)
A.加水时,平衡向逆反应方向移动
B.加少量NaOH固体,平衡向正反应方向移动
C.加少量0.1mol/L盐酸,溶液中c(H+)减小
D.加少量CH3COONa固体,平衡向正反应方向移动
练习2
B
?
催化剂
高温
△H<0
CH3COOH
CH3COO
-
+
H+
NH3·H2O
NH4+
+
OH
-
知识迁移
电离常数
对于一元弱酸
HA
H++A-
对于一元弱碱
BOH
B++OH-
注意:K值只随温度变化。
解疑:
思考:多元弱酸,分步电离,第一步电离大于第二步电离,第二步电离远大于第三步电离……,为什么?
多元弱酸是分步电离的,K1》K2(一般要相差105)。
多元弱酸的酸性由第一步电离决定。第二步和第三步的电离分别受到第一步和第二步、第三步的抑制。
[实验3-2]向1mol/LCH3COOH、饱和硼酸溶液中分别加入等浓度的碳酸钠溶液,观察现象,并比较三种酸(CH3COOH、硼酸、碳酸)的酸性强弱。
实验探究
25℃
1.75×10-5
>
4.4×10-7
>
5.8×10-10
电离平衡常数的意义
表示电离程度的相对大小,一般K值越大,
电离程度越大,相应酸
(碱)的酸(碱)性越强
试根据课本P43中“一些弱酸和弱碱的电离平衡常数”比较它们的相对强弱。
草酸>磷酸>柠檬酸>碳酸
学以致用
知识网络
弱电解质的电离
弱电解质
电离平衡
电离
特点
举例:弱酸、弱碱、水
特点:逆、等、动、定、变
影响因素
温度
浓度
同离子效应
平衡常数K只与温度有关
实验3-1:体积相同,浓度相同的盐酸和醋酸与等量镁条反应,并测量溶液的pH值
0
2
反应激烈
反应缓慢
分享成果
1mol/L
HCl
1mol/L
CH3COOH
溶液的pH值
与镁条反应现象
实验结果:
相同浓度的盐酸与醋酸,其溶液中
C(
H+盐酸)>
C(
H+醋酸)
。
说明:HCl和CH3COOH的电离程度不同。
A
1.下物质分类组合正确的是
(
)
A
B
C
D
强电解质:
HCl
FeCl3
H3PO4
Ca(OH)2
弱电解质:
HF
H2SO3
BaSO4
HNO3
非电解质:
CCl4
Cu
H2O
C2H5OH
2.化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂:
HIn(溶液红色)
H++In—(溶液无色)
浓度为0.02mol/L的下列溶液:①盐酸
②石灰水
③NaCl溶液
④NaHSO4溶液
⑤NaHCO3溶液
⑥氨水
其中能使指示剂显红色的是
(
)
A
①④⑤
B
②⑤⑥
C
①④
D
②③⑥
C
3.在RNH2·H2O
RNH3++OH-的平衡中,要使RNH2·H2O的电离程度及c(OH-)都增大,可采取的措施(
)
A.通入氯化氢
B.加少量氢氧化钠固体
C.加水
D.升温
D
有关电离常数的简单计算:
课本p44第4题
解析:设电离平衡时H+物质的量浓度为x
因醋酸的电离程度很小,
故0.010-x≈0.010
0.010
0
0
0.010-x
x
x
即
x2/0.010=1.75×10-5
x=4.2×10-4mol/L
K=
=1.75×10-5
=
5.已知三种酸HA、HB、HC的电离常数分别为a、b、c,且a>b>c,则对相同浓度的酸溶液叙述正确的是( )
A.HC的溶液c(H+)最大
B.HA溶液酸性最强
C.HC溶液的pH最小
D.三种溶液中酸的电离程度:HA
①1
mol·L-1的CH3COOH溶液中c(H+)=10-2mol·L-1 ②CH3COOH以任意比与H2O互溶 ③在相同条件下,CH3COOH溶液的导电性比盐酸弱 ④10
mL
1
mol·L-1的CH3COOH溶液恰好与10
mL
1
mol·L-1的NaOH溶液完全反应 ⑤同浓度同体积的CH3COOH溶液和HCl溶液与Fe反应时,CH3COOH溶液中放出H2的速率慢 ⑥CH3COOH溶液中CH3COOH、CH3COO-、H+同时存在
A.①③⑤⑥
B.②③④⑤
C.①④⑤⑥
D.③⑤⑥
7.根据下表数据(均在同温、同压下测定)
可得出弱电解质强弱顺序正确的是( )
A.HX>HY>HZ
B.HZ>HY>HX
C.HY>HZ>HX
D.HZ>HX>HY
酸
HX
HY
HZ
物质的量浓度
(mol·L-1)
0.1
0.2
0.3
电离平衡常数
7.2×10-4
1.8×10-4
1.8×10-5
8.已知下面三个数据:7.2×10-4、4.6×10-4、
4.9×10-10分别是三种酸的电离平衡常数,若已知这些酸可发生如下反应:
①NaCN+HNO2
HCN+NaNO2,
②NaNO2+HF
由此可判断下列叙述中,不正确的是( )
A.HF的电离平衡常数为7.2×10-4
B.HNO2的电离平衡常数为4.9×10-10
C.根据两个反应即可知三种酸的相对强弱
D.HNO2的电离平衡常数比HCN大,比HF小
HNO2+NaF。
9.欲使醋酸溶液中的c(CH3COO-)增大,且不放出气体,可向醋酸中加入少量下列中的哪种固体( )
A.NaCl
B.NaHCO3
C.CH3COOK
D.Mg
10、将6
g
CH3COOH溶于水制成1
L溶液,此溶液的物质的量浓度为________,经测定溶液中c(CH3COO-)为1.4×10-3
mol·L-1,此温度下醋酸的电离常数Ka=________,温度升高,Ka将__________________________________
(填“变大”、“不变”或“变小”,下同),加入少量CH3COONa后c(H+)
_________,Ka________。
