江苏省镇江中学2006-2007学年度第一学期12月高一第三次月考化学试卷(苏教版金属铝、铁、铜及非金属碳、硅
文档属性
| 名称 | 江苏省镇江中学2006-2007学年度第一学期12月高一第三次月考化学试卷(苏教版金属铝、铁、铜及非金属碳、硅 |  | |
| 格式 | zip | ||
| 文件大小 | 66.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2006-12-26 20:45:00 | ||
图片预览



文档简介
江苏省镇江中学2006-2007学年度第一学期第三次月考
高一年级化学试卷 2006.12
命题:吴建国 审核:陈如松
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。考试时间120分钟。
第Ⅰ卷(选择题 共75分)
相对原子质量:Zn:65 Fe:56 Mg:24 Al:27 O:16 H:1 S:32 Cu:64
一、单项选择题(本题包括15小题,每小题3分,共45分。每小题只有一个正确选项)
1、下列物质中,不属于合金的是
A. 硬铝 B.黄铜 C. 钢铁 D.金箔
2、下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al
A.③④ B.②③④ C.①③④ D.全部
3、工业盐酸常呈黄色,其原因是B
A.Cl-被空气中的O2氧化 B.混有可溶性杂质如Fe3+
C.溶有Cl2 D.HCl在溶液中呈黄色
4、只用一种试剂区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液, 这种试剂
是 A.Ba(OH)2 B.H2SO4 C.NaOH D.AgNO3
5、下列离子方程式书写正确的是
A.铝粉投入到NaOH溶液中:2Al+2OH-══ 2AlO2-+H2↑
B.AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
C.三氯化铁溶液中加入铁粉:Fe3+ + Fe == 2Fe2+
D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
6、向MgSO4和Al2(SO4)3的混合溶液中, 逐滴加入NaOH溶液。下列图象中, 能正确表示上
述反应的是(横坐标表示加入NaOH溶液的体积, 纵坐标表示反应生成沉淀的质量)
7、能证明硅酸的酸性弱于碳酸酸性的实验事实是
A.CO2溶于水形成碳酸,SiO2难溶于水
B.CO2通入可溶性硅酸盐中析出硅酸沉淀
C.高温下SiO2与碳酸盐反应生成CO2
D.HCl通入可溶性碳酸盐溶液中放出气体,氯化氢通入可溶性硅酸盐溶液中生成沉淀
8、光纤通信70年代后期发展起来的一种新型通信技术,目前长距离光纤通信系统已投入使用,光纤通信的光学纤维是由下列哪种物质经特殊工艺制成的
A.碳 B.石英 C.锗 D.硅
9、用一种试剂证明生石灰中含有石灰石和石英,下列试剂适宜的是
A.盐酸 B.硫酸 C.NaOH溶液 D.氯化钠溶液
10、取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相
同体积的气体,则两份铝片的质量之比为A
A.1:1 B.2:3 C.3:2 D.1:6
11、下列试剂能贮存在磨口玻璃塞的试剂瓶里的是
A.HF溶液 B.KOH溶液 C.盐酸 D.水玻璃
12、下列物质能使品红溶液褪色的是
①活性炭 ②过氧化钠 ③氯水 ④二氧化硫 ⑤臭氧
A.①③④ B.②④⑤ C.①②③④ D.①②③④⑤
13、飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降。它与空气中的SO2和O2
接触时,SO2会部分转化为SO3,使空气的酸度增加,环境污染更为严重。其中飘尘所起的
作用可能是
A.氧化剂 B.还原剂 C.催化剂 D.载体
14、SO2和Cl2都具有漂白性,若将等物质的量的这两种气体同时作用于潮湿的有色物质,
可观察到有色物质D
A.立刻褪色 B.慢慢褪色 C.先褪色,后复原 D.颜色不褪
15、硅酸铜钡是当今用最新科学技术才能合成的一种物质。然而现在发现,我国秦朝兵马俑
用的一种颜料竟是硅酸铜钡。下列关于硅酸铜钡的学说错误的是
A.易溶于水 B.难溶于水 C.属于硅酸盐 D.属于复盐
二、不定项选择题(本题包括10小题,每小题3分,共30分。每小题有一个或两个正确选项。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的得1分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
16、下列各组离子中可能在某无色溶液中大量共存的是,AB
A.MnO4-、K+、Na+、SO42- B.K+, H+, CO32-, Cl-
C.Mg2+、NH4+、Cl-、NO3- D.Ba2+、K+、HCO3-、OH-
17、镁、铝、铜三种金属粉末混合物, 加入过量盐酸充分反应, 过滤后向滤液中加入过量烧碱溶液, 再过滤, 滤液中存在的离子有
A.AlO2- B.Cu2+ C.Al3+ D.Mg2+
18、在下列溶液中通入CO2至过量,原溶液一直保持澄清的是
A.硅酸钠溶液 B.氯化钡溶液 C.石灰水 D.漂白粉溶液
19、向盐酸中加入浓硫酸时产生白雾,下列叙述不属于产生该现象的原因是
A.浓硫酸具有脱水性 B.浓硫酸具有吸水性
C.盐酸具有挥发性 D.气体的溶解度的随温度升高而降低
20、下列关于SO2的叙述,正确的是A
A.SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物
B.SO2是亚硫酸的酸酐
C.大气中SO2的主要来源是汽车排出的尾气
D.SO2具有漂白性,因而可以使石蕊试液褪色
21、某冶炼厂利用炼铜产生的SO2生产硫酸,变废为宝,化害为利。其原理是
A.利用了SO2的水溶性,将SO2直接通入水中
B.利用了SO2的氧化性,将SO2直接通入水中
C.利用了SO2的氧化性,使其与O2反应而转化为SO3,再与水反应
D.利用了SO2的还原性,使其与O2反应而转化为SO3,再与水反应
22、全社会都在倡导诚信,然而总是有一部分不法商贩却在背道而驰。如有些商贩为了使银耳增白,就用硫磺(燃烧硫磺)对银耳进行熏制,用这种方法制取的洁白的银耳对人体是有害的。这些不法商贩所制取银耳利用的是
A.S的漂白性 B.S的还原性 C.SO2的漂白性 D.SO2的还原性
23、向50mL18mol·L-的硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量为
A.等于0.9mol B.大于0.45mol,小于0.9mol
C.等于0.45mol D.小于0.45mol
24、由Zn,Fe,Al,Mg四种金属中的两种组成的混合物10g,与足量的盐酸反应产生的氢气在标况下为11.2升,则混合物中一定含有的金属是C
A.Zn B.Fe C. Al D.Mg
25、CS2(常温下为液态)能够在氧气中完全燃烧生成SO2和CO2。若将0.304gCS2在448mLO2
(标准状况下)中充分燃烧后,所得混合气体在标准状况下的体积为
A.112mL B.224mL C.336mL D.448mL
第Ⅱ卷(非选择题 共75分)
三、(本题包括2小题,共23分。26题15分,27题8分)
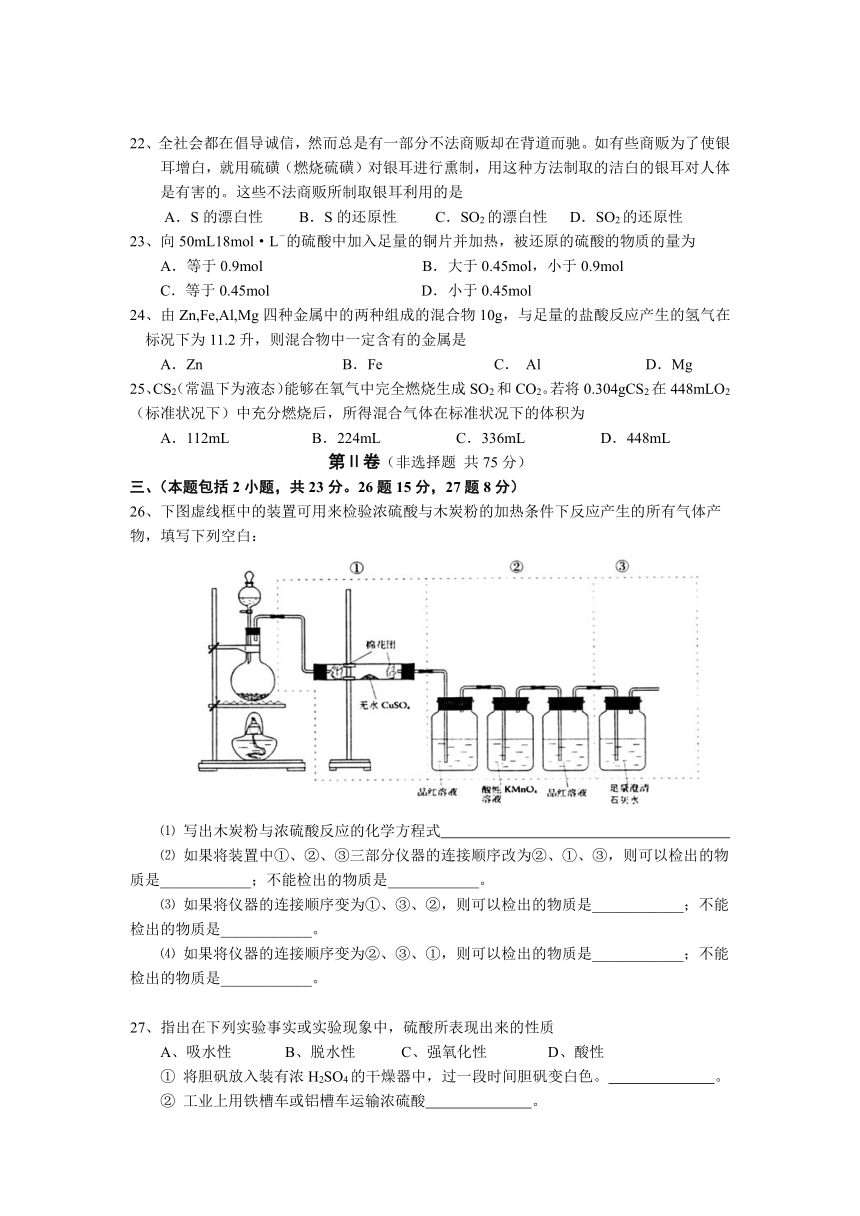
26、下图虚线框中的装置可用来检验浓硫酸与木炭粉的加热条件下反应产生的所有气体产物,填写下列空白:
⑴ 写出木炭粉与浓硫酸反应的化学方程式
⑵ 如果将装置中①、②、③三部分仪器的连接顺序改为②、①、③,则可以检出的物质是____________;不能检出的物质是____________。
⑶ 如果将仪器的连接顺序变为①、③、②,则可以检出的物质是____________;不能检出的物质是____________。
⑷ 如果将仪器的连接顺序变为②、③、①,则可以检出的物质是____________;不能检出的物质是____________。
27、指出在下列实验事实或实验现象中,硫酸所表现出来的性质
A、吸水性 B、脱水性 C、强氧化性 D、酸性
① 将胆矾放入装有浓H2SO4的干燥器中,过一段时间胆矾变白色。 。
② 工业上用铁槽车或铝槽车运输浓硫酸 。
③ 在烧杯中放入蔗糖,滴入浓H2SO4变黑,并产生大量气体。 。
④ 铜与浓硫酸反应制取硫酸铜。 。
⑤ 浓H2SO4敞口久置会增重。 。
⑥ 用稀硫酸清洗金属表面的氧化物。 。
四、(本题包括2小题,共24分。28题12分,29题12分)
28、Fe是地壳中含量很丰富的元素,也是生物体所必需的元素。自然界中铁矿石主要有赤铁矿和磁铁矿,金属铁是在高炉中冶炼的,高炉炼铁除了加入铁矿石外,还需加入焦炭和石灰石。请填空:
① 写出磁铁矿主要成分的化学式: 。
② 写出赤铁矿被还原成铁的化学方程式: 。
③ 写出焦炭在高炉中参与反应的两个化学方程式: , 。
④ 写出CaCO3所参与反应的两个化学方程式: , 。
29、⑴ 用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现
代物质文明的重要作用。例如:
① 计算机芯片的主要成分是 ;
② 目前应用最多的太阳能电池的光电转化材料是 ;
③ 用作吸附剂、干燥剂、催化剂或催化剂载体的人造分子筛大多是一类称为 的
化合物;
⑵ 写出工业上制备该元素的单质及提纯的有关化学方程式:
① , ② , ③ 。
五、(本题包括1小题,共13分。)
30、已知有以下物质相互转化
试回答:⑴ 写出B的化学式 D的化学式 。
⑵ 写出由E转变成F的化学方程式 。
⑶ 写出用KSCN鉴别G溶液的离子方程式 ;向G溶液加入A的有关离子反应方程式 。
六、(本题包括2小题,共15分)31、32见答卷纸
江苏省镇江中学2006-2007学年度第一学期第三次月考
高一年级化学答卷纸
相对原子质量:Zn:65 Fe:56 Mg:24 Al:27 O:16 H:1 S:32 Cu:64
一、单项选择题(本题包括15小题,每小题3分,共45分。每小题只有一个正确选项)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
二、不定项选择题(本题包括10小题,每小题3分,共30分。每小题有一个或两个正确选项。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的得1分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
16 17 18 19 20 21 22 23 24 25
三、(本题包括2小题,共23分。26题15分,27题8分)
26、⑴
⑵ , 。
⑶ , 。
⑷ , 。
27、① ② ③
④ ⑤ ⑥
四、(本题包括2小题,共24分。28题12分,29题12分)
28、① ;② ;
③ , ;
④ , 。
29、⑴ ① , ② , ③ 。
⑵ ① ;
② ;
③ 。
五、(本题包括1小题,共13分。)
30、⑴ , ;
⑵ 。
⑶ , 。
六、(本题包括2小题,共15分。31题7分,32题8分)
31、某化学课外小组的同学用含铜96%的废铜屑制取胆矾(五水合硫酸铜)。将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气作用下便生成硫酸铜。
⑴写出生成硫酸铜的化学方程式 。
⑵现用1kg这种废铜屑理论上能制取胆矾多少kg?
32、向40mL1mol·L-1的AlCl3溶液中加入100mLKOH溶液,充分反应得到0.78g沉淀,则KOH溶液的物质的量浓度是多少?
江苏省镇江中学2006-2007学年度第一学期第三次月考
高一年级化学答案
相对原子质量:Zn:65 Fe:56 Mg:24 Al:27 O:16 H:1 S:32 Cu:64
一、单项选择题(本题包括15小题,每小题3分,共45分。每小题只有一个正确选项)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
D D B C D D B B A A C D C D A
二、不定项选择题(本题包括10小题,每小题3分,共30分。每小题有一个或两个正确选项。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的得1分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
16 17 18 19 20 21 22 23 24 25
C A B A AB D C D C D
三、(本题包括2小题,共23分。26题15分,27题8分)
26、⑴ C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
⑵ SO2、CO2;H2O ⑶ H2O;SO2、CO2
⑷ SO2、CO2;H2O
27、① A ② C ③ BC ④ CD ⑤ A ⑥ D
四、(本题包括2小题,共24分。28题12分,29题12分)
28、① Fe3O4 ② Fe2O3 + 3CO2Fe + CO2
③ C + O2 CO2 CO2 + C2CO
④ CaCO3CaO+CO2↑ CaO + SiO2CaSiO3
29、⑴ ①硅, ②硅, ③铝硅酸盐。
⑵ ① SiO2 + 2CSi + 2CO↑; ② Si + 2Cl2SiCl4;
③ SiCl4 + 2H2Si + 4HCl。
五、(本题包括1小题,共13分。)
30、⑴ FeCl2, KCl;
⑵ 4 Fe(OH)2 + O2 + 2H2O == 4 Fe(OH)3。
⑶ Fe3+ +3SCN -== Fe(SCN)3,2Fe3+ +Fe == 3Fe2+。
六、(本题包括2小题,共15分。31题7分,32题8分)
31、某化学课外小组的同学用含铜96%的废铜屑制取胆矾(五水合硫酸铜)。将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气作用下便生成硫酸铜。
⑴写出生成硫酸铜的化学方程式: 2Cu + O2 + 2H2SO4 2CuO + 2H2O 。
⑵现用1kg这种废铜屑理论上能制取胆矾多少kg?
答案:3.75kg
32、向40mL1mol·L-1的AlCl3溶液中加入100mLKOH溶液,充分反应得到0.78g沉淀,则KOH溶液的物质的量浓度是多少?
答案:0.3 mol·L-1 1.5mol·L-1
高一年级化学试卷 2006.12
命题:吴建国 审核:陈如松
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。考试时间120分钟。
第Ⅰ卷(选择题 共75分)
相对原子质量:Zn:65 Fe:56 Mg:24 Al:27 O:16 H:1 S:32 Cu:64
一、单项选择题(本题包括15小题,每小题3分,共45分。每小题只有一个正确选项)
1、下列物质中,不属于合金的是
A. 硬铝 B.黄铜 C. 钢铁 D.金箔
2、下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al
A.③④ B.②③④ C.①③④ D.全部
3、工业盐酸常呈黄色,其原因是B
A.Cl-被空气中的O2氧化 B.混有可溶性杂质如Fe3+
C.溶有Cl2 D.HCl在溶液中呈黄色
4、只用一种试剂区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、(NH4)2SO4五种溶液, 这种试剂
是 A.Ba(OH)2 B.H2SO4 C.NaOH D.AgNO3
5、下列离子方程式书写正确的是
A.铝粉投入到NaOH溶液中:2Al+2OH-══ 2AlO2-+H2↑
B.AlCl3溶液中加入足量的氨水:Al3++ 3OH- ══ Al(OH)3↓
C.三氯化铁溶液中加入铁粉:Fe3+ + Fe == 2Fe2+
D.FeCl2溶液跟Cl2反应:2Fe2++Cl2=2Fe3++2Cl-
6、向MgSO4和Al2(SO4)3的混合溶液中, 逐滴加入NaOH溶液。下列图象中, 能正确表示上
述反应的是(横坐标表示加入NaOH溶液的体积, 纵坐标表示反应生成沉淀的质量)
7、能证明硅酸的酸性弱于碳酸酸性的实验事实是
A.CO2溶于水形成碳酸,SiO2难溶于水
B.CO2通入可溶性硅酸盐中析出硅酸沉淀
C.高温下SiO2与碳酸盐反应生成CO2
D.HCl通入可溶性碳酸盐溶液中放出气体,氯化氢通入可溶性硅酸盐溶液中生成沉淀
8、光纤通信70年代后期发展起来的一种新型通信技术,目前长距离光纤通信系统已投入使用,光纤通信的光学纤维是由下列哪种物质经特殊工艺制成的
A.碳 B.石英 C.锗 D.硅
9、用一种试剂证明生石灰中含有石灰石和石英,下列试剂适宜的是
A.盐酸 B.硫酸 C.NaOH溶液 D.氯化钠溶液
10、取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相
同体积的气体,则两份铝片的质量之比为A
A.1:1 B.2:3 C.3:2 D.1:6
11、下列试剂能贮存在磨口玻璃塞的试剂瓶里的是
A.HF溶液 B.KOH溶液 C.盐酸 D.水玻璃
12、下列物质能使品红溶液褪色的是
①活性炭 ②过氧化钠 ③氯水 ④二氧化硫 ⑤臭氧
A.①③④ B.②④⑤ C.①②③④ D.①②③④⑤
13、飘尘是物质燃烧时产生的粒状漂浮物,颗粒很小,不易沉降。它与空气中的SO2和O2
接触时,SO2会部分转化为SO3,使空气的酸度增加,环境污染更为严重。其中飘尘所起的
作用可能是
A.氧化剂 B.还原剂 C.催化剂 D.载体
14、SO2和Cl2都具有漂白性,若将等物质的量的这两种气体同时作用于潮湿的有色物质,
可观察到有色物质D
A.立刻褪色 B.慢慢褪色 C.先褪色,后复原 D.颜色不褪
15、硅酸铜钡是当今用最新科学技术才能合成的一种物质。然而现在发现,我国秦朝兵马俑
用的一种颜料竟是硅酸铜钡。下列关于硅酸铜钡的学说错误的是
A.易溶于水 B.难溶于水 C.属于硅酸盐 D.属于复盐
二、不定项选择题(本题包括10小题,每小题3分,共30分。每小题有一个或两个正确选项。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的得1分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
16、下列各组离子中可能在某无色溶液中大量共存的是,AB
A.MnO4-、K+、Na+、SO42- B.K+, H+, CO32-, Cl-
C.Mg2+、NH4+、Cl-、NO3- D.Ba2+、K+、HCO3-、OH-
17、镁、铝、铜三种金属粉末混合物, 加入过量盐酸充分反应, 过滤后向滤液中加入过量烧碱溶液, 再过滤, 滤液中存在的离子有
A.AlO2- B.Cu2+ C.Al3+ D.Mg2+
18、在下列溶液中通入CO2至过量,原溶液一直保持澄清的是
A.硅酸钠溶液 B.氯化钡溶液 C.石灰水 D.漂白粉溶液
19、向盐酸中加入浓硫酸时产生白雾,下列叙述不属于产生该现象的原因是
A.浓硫酸具有脱水性 B.浓硫酸具有吸水性
C.盐酸具有挥发性 D.气体的溶解度的随温度升高而降低
20、下列关于SO2的叙述,正确的是A
A.SO2既可以是含硫物质的氧化产物,又可以是含硫物质的还原产物
B.SO2是亚硫酸的酸酐
C.大气中SO2的主要来源是汽车排出的尾气
D.SO2具有漂白性,因而可以使石蕊试液褪色
21、某冶炼厂利用炼铜产生的SO2生产硫酸,变废为宝,化害为利。其原理是
A.利用了SO2的水溶性,将SO2直接通入水中
B.利用了SO2的氧化性,将SO2直接通入水中
C.利用了SO2的氧化性,使其与O2反应而转化为SO3,再与水反应
D.利用了SO2的还原性,使其与O2反应而转化为SO3,再与水反应
22、全社会都在倡导诚信,然而总是有一部分不法商贩却在背道而驰。如有些商贩为了使银耳增白,就用硫磺(燃烧硫磺)对银耳进行熏制,用这种方法制取的洁白的银耳对人体是有害的。这些不法商贩所制取银耳利用的是
A.S的漂白性 B.S的还原性 C.SO2的漂白性 D.SO2的还原性
23、向50mL18mol·L-的硫酸中加入足量的铜片并加热,被还原的硫酸的物质的量为
A.等于0.9mol B.大于0.45mol,小于0.9mol
C.等于0.45mol D.小于0.45mol
24、由Zn,Fe,Al,Mg四种金属中的两种组成的混合物10g,与足量的盐酸反应产生的氢气在标况下为11.2升,则混合物中一定含有的金属是C
A.Zn B.Fe C. Al D.Mg
25、CS2(常温下为液态)能够在氧气中完全燃烧生成SO2和CO2。若将0.304gCS2在448mLO2
(标准状况下)中充分燃烧后,所得混合气体在标准状况下的体积为
A.112mL B.224mL C.336mL D.448mL
第Ⅱ卷(非选择题 共75分)
三、(本题包括2小题,共23分。26题15分,27题8分)
26、下图虚线框中的装置可用来检验浓硫酸与木炭粉的加热条件下反应产生的所有气体产物,填写下列空白:
⑴ 写出木炭粉与浓硫酸反应的化学方程式
⑵ 如果将装置中①、②、③三部分仪器的连接顺序改为②、①、③,则可以检出的物质是____________;不能检出的物质是____________。
⑶ 如果将仪器的连接顺序变为①、③、②,则可以检出的物质是____________;不能检出的物质是____________。
⑷ 如果将仪器的连接顺序变为②、③、①,则可以检出的物质是____________;不能检出的物质是____________。
27、指出在下列实验事实或实验现象中,硫酸所表现出来的性质
A、吸水性 B、脱水性 C、强氧化性 D、酸性
① 将胆矾放入装有浓H2SO4的干燥器中,过一段时间胆矾变白色。 。
② 工业上用铁槽车或铝槽车运输浓硫酸 。
③ 在烧杯中放入蔗糖,滴入浓H2SO4变黑,并产生大量气体。 。
④ 铜与浓硫酸反应制取硫酸铜。 。
⑤ 浓H2SO4敞口久置会增重。 。
⑥ 用稀硫酸清洗金属表面的氧化物。 。
四、(本题包括2小题,共24分。28题12分,29题12分)
28、Fe是地壳中含量很丰富的元素,也是生物体所必需的元素。自然界中铁矿石主要有赤铁矿和磁铁矿,金属铁是在高炉中冶炼的,高炉炼铁除了加入铁矿石外,还需加入焦炭和石灰石。请填空:
① 写出磁铁矿主要成分的化学式: 。
② 写出赤铁矿被还原成铁的化学方程式: 。
③ 写出焦炭在高炉中参与反应的两个化学方程式: , 。
④ 写出CaCO3所参与反应的两个化学方程式: , 。
29、⑴ 用地壳中某主要元素生产的多种产品在现代高科技中占有重要位置,足见化学对现
代物质文明的重要作用。例如:
① 计算机芯片的主要成分是 ;
② 目前应用最多的太阳能电池的光电转化材料是 ;
③ 用作吸附剂、干燥剂、催化剂或催化剂载体的人造分子筛大多是一类称为 的
化合物;
⑵ 写出工业上制备该元素的单质及提纯的有关化学方程式:
① , ② , ③ 。
五、(本题包括1小题,共13分。)
30、已知有以下物质相互转化
试回答:⑴ 写出B的化学式 D的化学式 。
⑵ 写出由E转变成F的化学方程式 。
⑶ 写出用KSCN鉴别G溶液的离子方程式 ;向G溶液加入A的有关离子反应方程式 。
六、(本题包括2小题,共15分)31、32见答卷纸
江苏省镇江中学2006-2007学年度第一学期第三次月考
高一年级化学答卷纸
相对原子质量:Zn:65 Fe:56 Mg:24 Al:27 O:16 H:1 S:32 Cu:64
一、单项选择题(本题包括15小题,每小题3分,共45分。每小题只有一个正确选项)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
二、不定项选择题(本题包括10小题,每小题3分,共30分。每小题有一个或两个正确选项。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的得1分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
16 17 18 19 20 21 22 23 24 25
三、(本题包括2小题,共23分。26题15分,27题8分)
26、⑴
⑵ , 。
⑶ , 。
⑷ , 。
27、① ② ③
④ ⑤ ⑥
四、(本题包括2小题,共24分。28题12分,29题12分)
28、① ;② ;
③ , ;
④ , 。
29、⑴ ① , ② , ③ 。
⑵ ① ;
② ;
③ 。
五、(本题包括1小题,共13分。)
30、⑴ , ;
⑵ 。
⑶ , 。
六、(本题包括2小题,共15分。31题7分,32题8分)
31、某化学课外小组的同学用含铜96%的废铜屑制取胆矾(五水合硫酸铜)。将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气作用下便生成硫酸铜。
⑴写出生成硫酸铜的化学方程式 。
⑵现用1kg这种废铜屑理论上能制取胆矾多少kg?
32、向40mL1mol·L-1的AlCl3溶液中加入100mLKOH溶液,充分反应得到0.78g沉淀,则KOH溶液的物质的量浓度是多少?
江苏省镇江中学2006-2007学年度第一学期第三次月考
高一年级化学答案
相对原子质量:Zn:65 Fe:56 Mg:24 Al:27 O:16 H:1 S:32 Cu:64
一、单项选择题(本题包括15小题,每小题3分,共45分。每小题只有一个正确选项)
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
D D B C D D B B A A C D C D A
二、不定项选择题(本题包括10小题,每小题3分,共30分。每小题有一个或两个正确选项。若正确答案只包括一个选项,多选时,该小题为0分;若正确答案包括两个选项,只选一个且正确的得1分,选两个且都正确的得满分,但只要选错一个,该小题就为0分)
16 17 18 19 20 21 22 23 24 25
C A B A AB D C D C D
三、(本题包括2小题,共23分。26题15分,27题8分)
26、⑴ C+2H2SO4(浓)CO2↑+2SO2↑+2H2O
⑵ SO2、CO2;H2O ⑶ H2O;SO2、CO2
⑷ SO2、CO2;H2O
27、① A ② C ③ BC ④ CD ⑤ A ⑥ D
四、(本题包括2小题,共24分。28题12分,29题12分)
28、① Fe3O4 ② Fe2O3 + 3CO2Fe + CO2
③ C + O2 CO2 CO2 + C2CO
④ CaCO3CaO+CO2↑ CaO + SiO2CaSiO3
29、⑴ ①硅, ②硅, ③铝硅酸盐。
⑵ ① SiO2 + 2CSi + 2CO↑; ② Si + 2Cl2SiCl4;
③ SiCl4 + 2H2Si + 4HCl。
五、(本题包括1小题,共13分。)
30、⑴ FeCl2, KCl;
⑵ 4 Fe(OH)2 + O2 + 2H2O == 4 Fe(OH)3。
⑶ Fe3+ +3SCN -== Fe(SCN)3,2Fe3+ +Fe == 3Fe2+。
六、(本题包括2小题,共15分。31题7分,32题8分)
31、某化学课外小组的同学用含铜96%的废铜屑制取胆矾(五水合硫酸铜)。将铜屑放入稀硫酸中,加热并不断鼓入空气,在氧气作用下便生成硫酸铜。
⑴写出生成硫酸铜的化学方程式: 2Cu + O2 + 2H2SO4 2CuO + 2H2O 。
⑵现用1kg这种废铜屑理论上能制取胆矾多少kg?
答案:3.75kg
32、向40mL1mol·L-1的AlCl3溶液中加入100mLKOH溶液,充分反应得到0.78g沉淀,则KOH溶液的物质的量浓度是多少?
答案:0.3 mol·L-1 1.5mol·L-1
