人教化学选修4第四章 第一节 原电池 课件 (共23张PPT)
文档属性
| 名称 | 人教化学选修4第四章 第一节 原电池 课件 (共23张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 67.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-10 17:33:01 | ||
图片预览




文档简介
(共23张PPT)
原电池
锂离子电池
南孚电池
纽扣电池
燃料电池
化学能转变为电能的装置
【实验一】:将锌片、铜片插入稀硫酸,有何现象?
Cu
Zn
稀硫酸
锌片上有气泡产生
原理:
Zn
+
2H+
=
Zn2+
+
H2↑
2e-
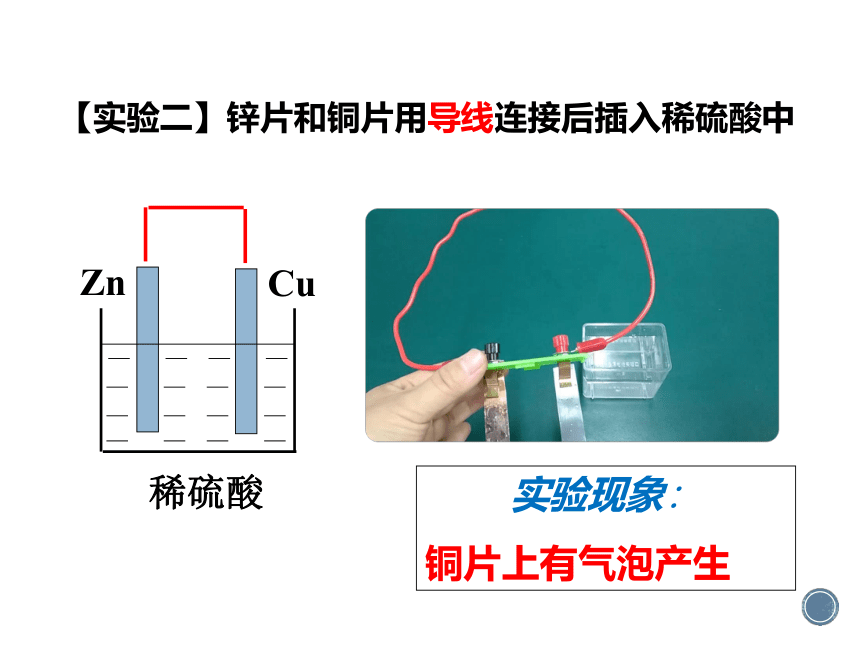
【实验二】锌片和铜片用导线连接后插入稀硫酸中
实验现象:
铜片上有气泡产生
Cu
Zn
稀硫酸
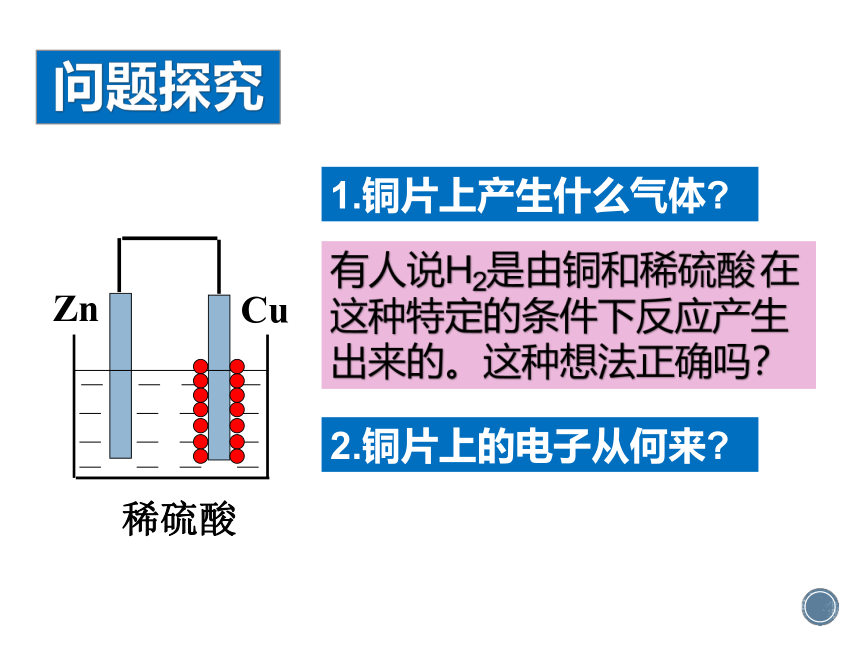
问题探究
Cu
Zn
稀硫酸
1.铜片上产生什么气体?
有人说H2是由铜和稀硫酸
在这种特定的条件下反应产生出来的。这种想法正确吗?
2.铜片上的电子从何来?
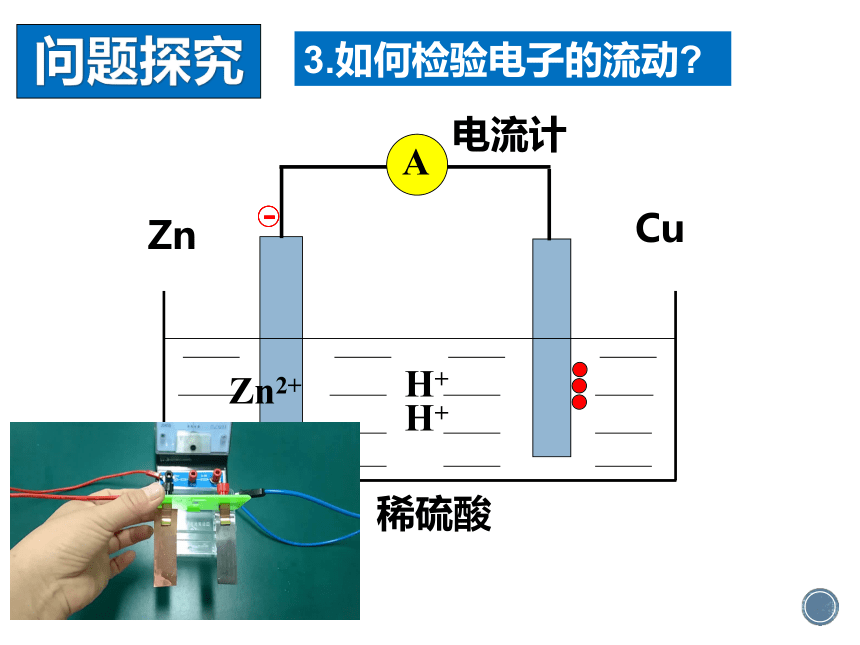
Cu
Zn
稀硫酸
-
-
-
Zn2+
H+
H+
电流计
A
3.如何检验电子的流动?
问题探究
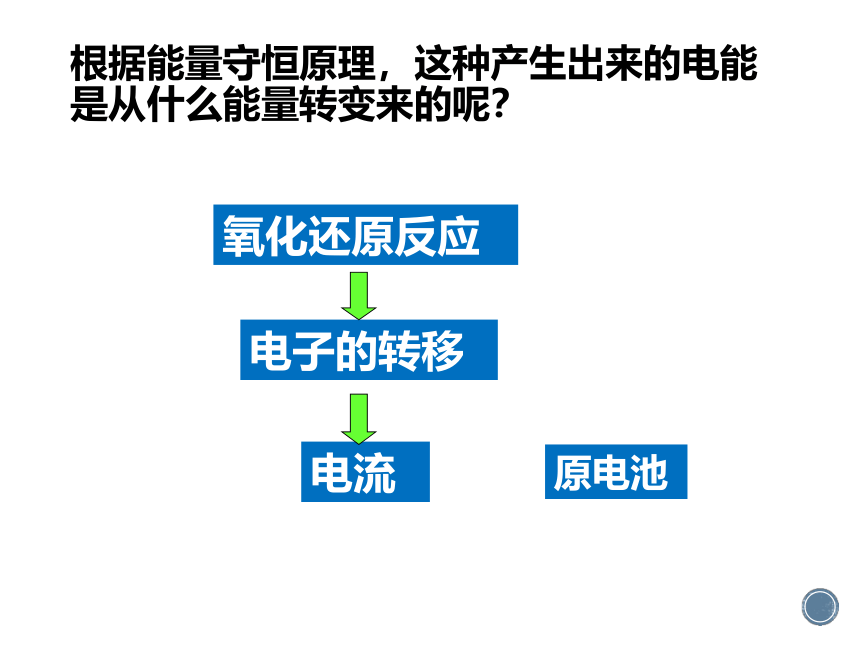
根据能量守恒原理,这种产生出来的电能是从什么能量转变来的呢?
原电池
电子的转移
氧化还原反应
电流
Cu
Zn
稀硫酸
-
-
-
Zn2+
H+
H+
灯泡
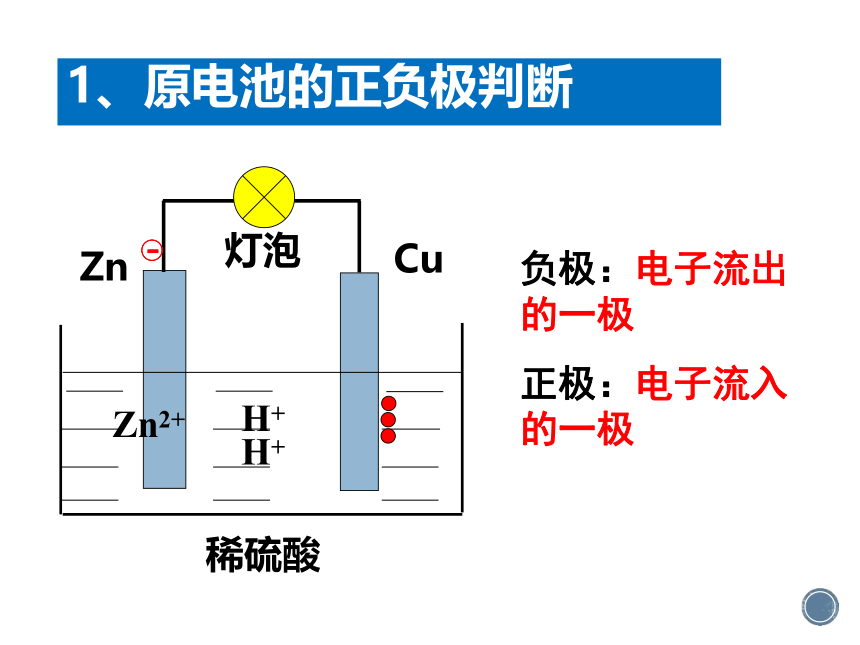
1、原电池的正负极判断
负极:电子流出的一极
正极:电子流入的一极
2、电极反应
2H++2e-=H2↑
负极:
Zn-2e-=Zn2+
正极:
原电池
氧化反应
还原反应
氧化还原反应
总反应:Zn
+
2H+
=
Zn2+
+
H2↑(离子方程式)
失去电子
得到电子
铜片的作用是什么?
可以用石墨代替吗?
【问题一】
Cu
Zn
稀硫酸
【问题二】
Cu
Zn
-
-
-
整个装置是如何形成电流的闭合回路的?
负极
正极
【问题三】
Cu
Zn
-
溶液中阴阳离子分别向哪一个电极运动?
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
-
-
-
-
-
-
-
-
-
-
Zn2+
H+
SO42-
负极
正极
【问题四】
Cu
Zn
-
有人说在铜锌原电池中,活泼金属失去电子,不活泼金属得到电子。这种说法正确吗?
-
-
-
-
-
-
-
-
-
-
Zn2+
H+
负极
正极
H+
【问题五】
Cu
Zn
-
为什么H+在铜片上得到电子?
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
-
-
-
-
-
-
-
-
-
-
Zn2+
H+
负极
正极
静电斥力
静电引力
Cu
Zn
-
-
-
Zn2+
H+
H+
SO42-
原电池工作原理小结
【实验探究】:将铁片、镁片插入稀硫酸溶液中,是否可以形成原电池?
Mg
Fe
稀硫酸
Mg
Fe
稀硫酸
(1)说明反应的现象;
(2)判断正负极;
(3)写出电极反应式;
(4)写出总反应的离子方程式和化学方程式。
巩固练习1
Cu
Zn
硫酸铜
【实验探究】:将锌片、铜片插入硫酸铜溶液中,是否可以形成原电池?
Cu
Zn
硫酸铜
(1)说明两个电极质量的变化情况;
(2)判断正负极;
(3)写出电极反应式;
(4)写出总反应的离子方程式和化学方程式。
巩固练习3
二、形成简单原电池的条件
两种不同的金属
(或一种金属与石墨)作电极
形成闭合回路(用导线相连插入电解质溶液里)
自发氧化还原反应
三、简单原电池的设计
(1)将反应:2FeCl3+Fe=3FeCl2设计成原电池。
(2)判断正负极并写出电极反应。
石墨
Fe
FeCl3溶液
负极(铁):
Fe-2e-=Fe2+
正极(石墨):
2Fe3+
+
2e-=3Fe2+
感谢各位聆听!
Thanks
for
Listening
原电池
锂离子电池
南孚电池
纽扣电池
燃料电池
化学能转变为电能的装置
【实验一】:将锌片、铜片插入稀硫酸,有何现象?
Cu
Zn
稀硫酸
锌片上有气泡产生
原理:
Zn
+
2H+
=
Zn2+
+
H2↑
2e-
【实验二】锌片和铜片用导线连接后插入稀硫酸中
实验现象:
铜片上有气泡产生
Cu
Zn
稀硫酸
问题探究
Cu
Zn
稀硫酸
1.铜片上产生什么气体?
有人说H2是由铜和稀硫酸
在这种特定的条件下反应产生出来的。这种想法正确吗?
2.铜片上的电子从何来?
Cu
Zn
稀硫酸
-
-
-
Zn2+
H+
H+
电流计
A
3.如何检验电子的流动?
问题探究
根据能量守恒原理,这种产生出来的电能是从什么能量转变来的呢?
原电池
电子的转移
氧化还原反应
电流
Cu
Zn
稀硫酸
-
-
-
Zn2+
H+
H+
灯泡
1、原电池的正负极判断
负极:电子流出的一极
正极:电子流入的一极
2、电极反应
2H++2e-=H2↑
负极:
Zn-2e-=Zn2+
正极:
原电池
氧化反应
还原反应
氧化还原反应
总反应:Zn
+
2H+
=
Zn2+
+
H2↑(离子方程式)
失去电子
得到电子
铜片的作用是什么?
可以用石墨代替吗?
【问题一】
Cu
Zn
稀硫酸
【问题二】
Cu
Zn
-
-
-
整个装置是如何形成电流的闭合回路的?
负极
正极
【问题三】
Cu
Zn
-
溶液中阴阳离子分别向哪一个电极运动?
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
-
-
-
-
-
-
-
-
-
-
Zn2+
H+
SO42-
负极
正极
【问题四】
Cu
Zn
-
有人说在铜锌原电池中,活泼金属失去电子,不活泼金属得到电子。这种说法正确吗?
-
-
-
-
-
-
-
-
-
-
Zn2+
H+
负极
正极
H+
【问题五】
Cu
Zn
-
为什么H+在铜片上得到电子?
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
Zn2+
-
-
-
-
-
-
-
-
-
-
Zn2+
H+
负极
正极
静电斥力
静电引力
Cu
Zn
-
-
-
Zn2+
H+
H+
SO42-
原电池工作原理小结
【实验探究】:将铁片、镁片插入稀硫酸溶液中,是否可以形成原电池?
Mg
Fe
稀硫酸
Mg
Fe
稀硫酸
(1)说明反应的现象;
(2)判断正负极;
(3)写出电极反应式;
(4)写出总反应的离子方程式和化学方程式。
巩固练习1
Cu
Zn
硫酸铜
【实验探究】:将锌片、铜片插入硫酸铜溶液中,是否可以形成原电池?
Cu
Zn
硫酸铜
(1)说明两个电极质量的变化情况;
(2)判断正负极;
(3)写出电极反应式;
(4)写出总反应的离子方程式和化学方程式。
巩固练习3
二、形成简单原电池的条件
两种不同的金属
(或一种金属与石墨)作电极
形成闭合回路(用导线相连插入电解质溶液里)
自发氧化还原反应
三、简单原电池的设计
(1)将反应:2FeCl3+Fe=3FeCl2设计成原电池。
(2)判断正负极并写出电极反应。
石墨
Fe
FeCl3溶液
负极(铁):
Fe-2e-=Fe2+
正极(石墨):
2Fe3+
+
2e-=3Fe2+
感谢各位聆听!
Thanks
for
Listening
