第一章 认识化学科学》第三节 化学中常用的物理量-物质的量第三课时物质的量浓度溶液的配制课件(潍坊市教学
文档属性
| 名称 | 第一章 认识化学科学》第三节 化学中常用的物理量-物质的量第三课时物质的量浓度溶液的配制课件(潍坊市教学 |  | |
| 格式 | rar | ||
| 文件大小 | 550.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2009-11-16 16:07:00 | ||
图片预览







文档简介
(共24张PPT)
一、物质的量浓度
定义:以单位体积溶液里所含溶质B的物质的量来表
示溶液组成的物理量,叫做溶质B的物质的量浓度。
数学表达式:
符号:cB
常用单位:mol·L-1
cB====
说明:
1]、体积-----溶液
物质的量-----溶质B
2]、一定浓度的溶液,从中取出任意体积的溶液,
浓度不变,溶质B的物质的量随体积变化而变化。
3]、溶质为强电解质时-----离子浓度
弱电解质时-----分子、离子浓度
非电解质时-----分子浓度
4]、若是结晶水合物,溶质为除去结晶水的化合物
二、一定物质的量浓度溶液的配制
1.配制
计算
溶解
移液
振荡
称量
洗涤
定容
摇匀
溶解时不要加水太多;搅拌时玻璃棒不要碰烧杯底部和内壁;不要把玻璃棒放在实验台上,以免弄脏
如何配制250mL0.4mol/LNaCl溶液?
Help me!!!
容量瓶:用于配制一定体积的浓度准确的溶液
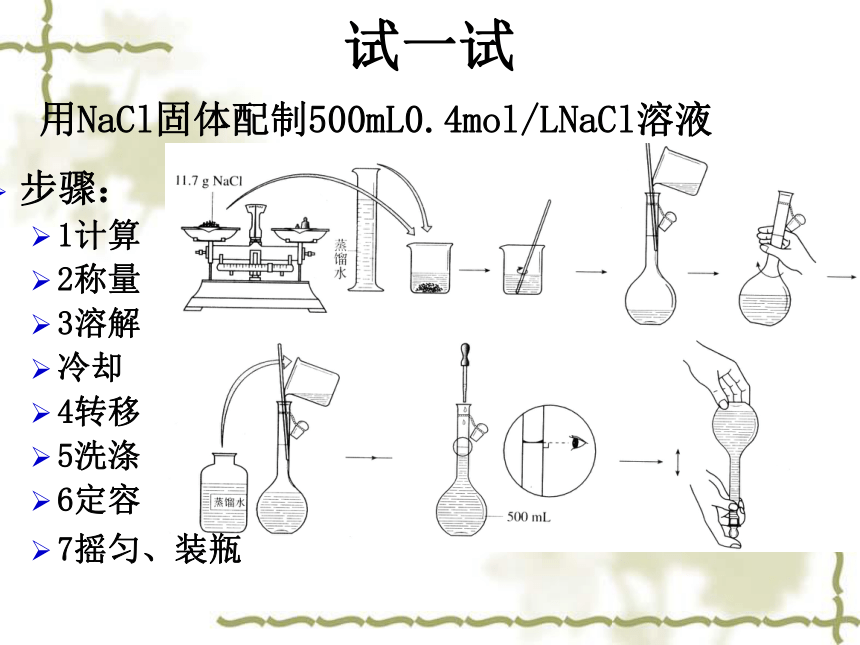
试一试
步骤:
1计算
2称量
3溶解
冷却
4转移
5洗涤
6定容
7摇匀、装瓶
用NaCl固体配制500mL0.4mol/LNaCl溶液
各步用到的主要仪器
1计算: - -
2称量:天平、药匙
3溶解:烧杯、玻璃棒
冷却:- -
4转移:烧杯、玻璃棒、容量瓶
5洗涤:玻璃棒
6定容:胶头滴管
7摇匀: - -
讨论
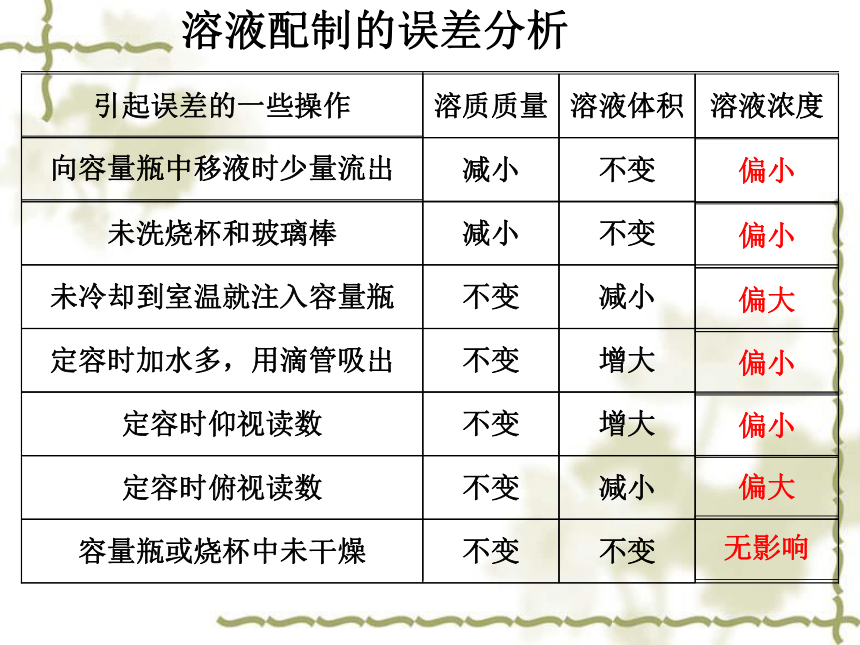
在配制溶液中哪些操作可能引起溶液浓度的误差?
溶液配制的误差分析
无影响
不变
不变
容量瓶或烧杯中未干燥
偏大
减小
不变
定容时俯视读数
偏小
增大
不变
定容时仰视读数
偏小
增大
不变
定容时加水多,用滴管吸出
偏大
减小
不变
未冷却到室温就注入容量瓶
偏小
不变
减小
未洗烧杯和玻璃棒
偏小
不变
减小
向容量瓶中移液时少量流出
溶液浓度
溶液体积
溶质质量
引起误差的一些操作
俯视或仰视刻度线对溶液浓度的影响
俯视
仰视
溶液配制的误差分析
无影响
不变
不变
定容后,经振荡、摇匀、静置、液面下降
偏大
减小
不变
定容时,俯视读刻度数
偏大
不变
增大
量筒量取液体时仰视读数
溶液浓度
溶液体积
溶质质量
引起误差的一些操作
小结:容量瓶的使用
一忌用容量瓶进行溶解(体积不准确)
二忌直接往容量瓶倒液
三忌加水超过刻度线
四忌读数仰视或俯视
五忌不洗涤玻璃棒和烧杯
六忌 (容量瓶是量器,不是容器)
三、物质的量浓度的计算
解题思想:吃透 结合
与
概念 单位
【例1】标准状况下,将448L NH3 溶于1L 水中,得
到密度为0.9 g/cm3 的氨水。求此氨水的物质的量浓度。
解: n (NH3) =
448L
22.4L/mol
= 20 mol
m (NH3) = 20 mol × 17g/mol = 340g
V(氨水) =
1340g
0. 9g/mL ×1000mL/L
= 1. 49 L
答: 此氨水的浓度是 13. 4 mol/L
m (氨水) = 340g + 1000g = 1340g
C(氨水) =
20 mol
1. 49L
=13. 4 mol/L
变题一、 标况下,1LNH3溶于1L水中,求
C氨水=?(测得氨水的密度为ρ g/ml)
解二、C= = =
n
V
1/22.4
1
解一、C= = =
n
V
1/22.4
1+1
变题二、充满HCl气体(标况)的烧瓶,
通过倒吸的方法使其充满水,求所得HCl溶液
的物质的量浓度。
解三、C= = =
×17+1000
ρ氨水
1/22.4
1/22.4
/1000
n
V
2、ω 与C的换算
已知某溶液溶质的摩尔质量为M g/mol,溶
液的密度为ρ g/ml,质量分数为ω,求CB=?
分析:1L (aq) nB(mol)
1000 ml (aq)
M g/mol
m (aq) = 1000ml·ρg/ml
mB = m(aq) × ω= 1000ml·ρg/ml ·ω
含有
有:CB= mol/L
1000 ·ρ·ω
M
例2、
已知:硫酸
ω =98%
ρ =1.84
MB=98g/mol
求:cB
例3、
已知:氢氧化钠
cB=2mol/L
m(aq)=80g
V=75ml
MB=40g/mol
求ω=
CB= mol/1L
1000 ·ρ·ω
M
【例4】要配制500mL 0.6mol/L 的NaOH溶液,需6 mol/L 的NaOH溶液多少毫升?
6 mol/L×V = 0.6mol/L ×500mL
V = 50 mL
答:需6 mol/L的NaOH溶液50mL 。
解:设需6 mol/L NaOH 溶液的体积为V
三、溶液稀释
四、溶液混合
例5:100mL 0.3mol/L Na2SO4溶液和50mL 0.2mol/L Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度约为( )。
A.0.20mol/L B.0.25mol/L C.0.40mol/L D.0.50mol/L
例6:用10mL 0.1mol/L BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐的物质的量浓度之比是(
A.3:2:2 B.1:2:3 C.1:3:3 D.3:1:1
五、与方程式有关的计算
7、(2002年春季)今有0.1mol/L Na2SO4溶液300mL、0.1mol/L MgSO4溶液200mL和0.1mol/L Al2(SO4)3溶液100mL,这三种溶液中硫酸根离子浓度之比是( )
A.1:1:1 B.3:2:2 C.3:2:3 D.1:1:3
8、将5mol / L的Mg(NO3)2溶液amL取出一半加水稀释至bmL,问稀释后的溶液中NO3-的物质的量浓度为____
9.用密度为ρ1g/cm3,质量分数是ω的浓盐酸,配制成体积比为1:4的稀盐酸,密度为ρ2g/cm3,则所配制稀盐酸的物质的量浓度为( )
A. B.
C. D.
C
一、物质的量浓度
定义:以单位体积溶液里所含溶质B的物质的量来表
示溶液组成的物理量,叫做溶质B的物质的量浓度。
数学表达式:
符号:cB
常用单位:mol·L-1
cB====
说明:
1]、体积-----溶液
物质的量-----溶质B
2]、一定浓度的溶液,从中取出任意体积的溶液,
浓度不变,溶质B的物质的量随体积变化而变化。
3]、溶质为强电解质时-----离子浓度
弱电解质时-----分子、离子浓度
非电解质时-----分子浓度
4]、若是结晶水合物,溶质为除去结晶水的化合物
二、一定物质的量浓度溶液的配制
1.配制
计算
溶解
移液
振荡
称量
洗涤
定容
摇匀
溶解时不要加水太多;搅拌时玻璃棒不要碰烧杯底部和内壁;不要把玻璃棒放在实验台上,以免弄脏
如何配制250mL0.4mol/LNaCl溶液?
Help me!!!
容量瓶:用于配制一定体积的浓度准确的溶液
试一试
步骤:
1计算
2称量
3溶解
冷却
4转移
5洗涤
6定容
7摇匀、装瓶
用NaCl固体配制500mL0.4mol/LNaCl溶液
各步用到的主要仪器
1计算: - -
2称量:天平、药匙
3溶解:烧杯、玻璃棒
冷却:- -
4转移:烧杯、玻璃棒、容量瓶
5洗涤:玻璃棒
6定容:胶头滴管
7摇匀: - -
讨论
在配制溶液中哪些操作可能引起溶液浓度的误差?
溶液配制的误差分析
无影响
不变
不变
容量瓶或烧杯中未干燥
偏大
减小
不变
定容时俯视读数
偏小
增大
不变
定容时仰视读数
偏小
增大
不变
定容时加水多,用滴管吸出
偏大
减小
不变
未冷却到室温就注入容量瓶
偏小
不变
减小
未洗烧杯和玻璃棒
偏小
不变
减小
向容量瓶中移液时少量流出
溶液浓度
溶液体积
溶质质量
引起误差的一些操作
俯视或仰视刻度线对溶液浓度的影响
俯视
仰视
溶液配制的误差分析
无影响
不变
不变
定容后,经振荡、摇匀、静置、液面下降
偏大
减小
不变
定容时,俯视读刻度数
偏大
不变
增大
量筒量取液体时仰视读数
溶液浓度
溶液体积
溶质质量
引起误差的一些操作
小结:容量瓶的使用
一忌用容量瓶进行溶解(体积不准确)
二忌直接往容量瓶倒液
三忌加水超过刻度线
四忌读数仰视或俯视
五忌不洗涤玻璃棒和烧杯
六忌 (容量瓶是量器,不是容器)
三、物质的量浓度的计算
解题思想:吃透 结合
与
概念 单位
【例1】标准状况下,将448L NH3 溶于1L 水中,得
到密度为0.9 g/cm3 的氨水。求此氨水的物质的量浓度。
解: n (NH3) =
448L
22.4L/mol
= 20 mol
m (NH3) = 20 mol × 17g/mol = 340g
V(氨水) =
1340g
0. 9g/mL ×1000mL/L
= 1. 49 L
答: 此氨水的浓度是 13. 4 mol/L
m (氨水) = 340g + 1000g = 1340g
C(氨水) =
20 mol
1. 49L
=13. 4 mol/L
变题一、 标况下,1LNH3溶于1L水中,求
C氨水=?(测得氨水的密度为ρ g/ml)
解二、C= = =
n
V
1/22.4
1
解一、C= = =
n
V
1/22.4
1+1
变题二、充满HCl气体(标况)的烧瓶,
通过倒吸的方法使其充满水,求所得HCl溶液
的物质的量浓度。
解三、C= = =
×17+1000
ρ氨水
1/22.4
1/22.4
/1000
n
V
2、ω 与C的换算
已知某溶液溶质的摩尔质量为M g/mol,溶
液的密度为ρ g/ml,质量分数为ω,求CB=?
分析:1L (aq) nB(mol)
1000 ml (aq)
M g/mol
m (aq) = 1000ml·ρg/ml
mB = m(aq) × ω= 1000ml·ρg/ml ·ω
含有
有:CB= mol/L
1000 ·ρ·ω
M
例2、
已知:硫酸
ω =98%
ρ =1.84
MB=98g/mol
求:cB
例3、
已知:氢氧化钠
cB=2mol/L
m(aq)=80g
V=75ml
MB=40g/mol
求ω=
CB= mol/1L
1000 ·ρ·ω
M
【例4】要配制500mL 0.6mol/L 的NaOH溶液,需6 mol/L 的NaOH溶液多少毫升?
6 mol/L×V = 0.6mol/L ×500mL
V = 50 mL
答:需6 mol/L的NaOH溶液50mL 。
解:设需6 mol/L NaOH 溶液的体积为V
三、溶液稀释
四、溶液混合
例5:100mL 0.3mol/L Na2SO4溶液和50mL 0.2mol/L Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度约为( )。
A.0.20mol/L B.0.25mol/L C.0.40mol/L D.0.50mol/L
例6:用10mL 0.1mol/L BaCl2溶液恰好可使相同体积的硫酸铁、硫酸锌和硫酸钾三种溶液中的硫酸根离子完全转化为硫酸钡沉淀,则三种硫酸盐的物质的量浓度之比是(
A.3:2:2 B.1:2:3 C.1:3:3 D.3:1:1
五、与方程式有关的计算
7、(2002年春季)今有0.1mol/L Na2SO4溶液300mL、0.1mol/L MgSO4溶液200mL和0.1mol/L Al2(SO4)3溶液100mL,这三种溶液中硫酸根离子浓度之比是( )
A.1:1:1 B.3:2:2 C.3:2:3 D.1:1:3
8、将5mol / L的Mg(NO3)2溶液amL取出一半加水稀释至bmL,问稀释后的溶液中NO3-的物质的量浓度为____
9.用密度为ρ1g/cm3,质量分数是ω的浓盐酸,配制成体积比为1:4的稀盐酸,密度为ρ2g/cm3,则所配制稀盐酸的物质的量浓度为( )
A. B.
C. D.
C
