人教化学选修4第四章 第一节 原电池(共29张PPT)
文档属性
| 名称 | 人教化学选修4第四章 第一节 原电池(共29张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-10 21:33:44 | ||
图片预览






文档简介
(共29张PPT)
请看图片
原电池
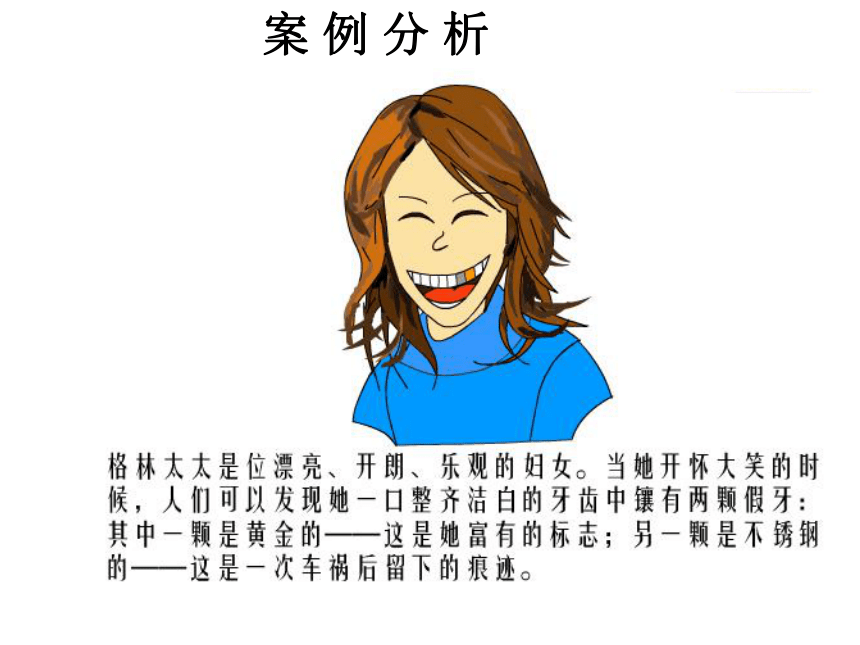
案
例
分
析
案
例
分
析
案
例
分
析
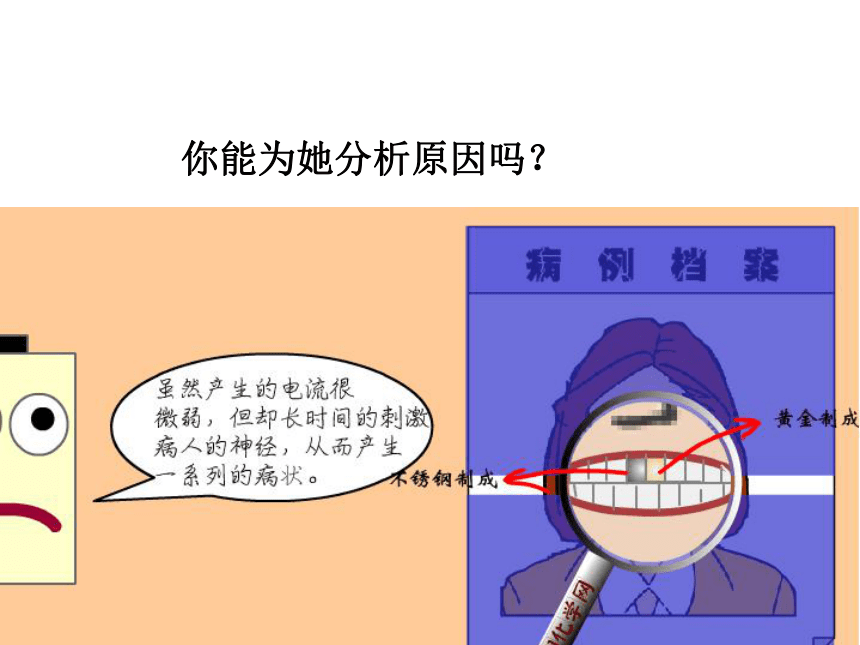
你能为她分析原因吗?
知识回顾
1、原电池定义:
将化学能转化为电能的装置
2、本质:
发生氧化还原反应
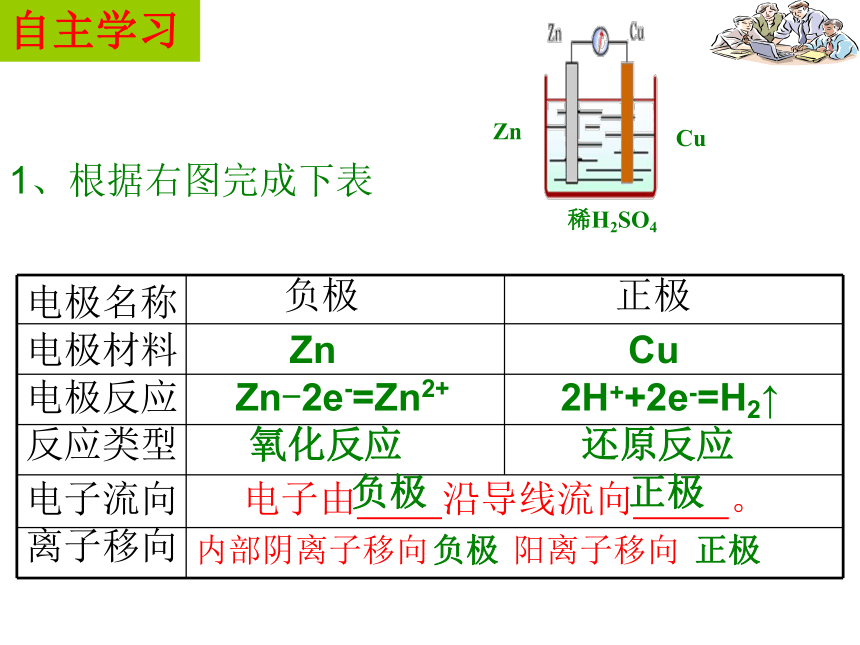
电极名称
电极材料
反应类型
电极反应
负极
正极
电子流向
离子移向
电子由
沿导线流向
。
还原反应
氧化反应
Cu
Zn
Zn-2e-=Zn2+
2H++2e-=H2↑
负极
正极
内部阴离子移向
阳离子移向
自主学习
1、根据右图完成下表
Zn
Cu
稀H2SO4
负极
正极
形成条件一:
负极:较活泼的金属
正极:较不活泼的金属、石墨等
2.判断下列哪些装置能构成原电池。为什么?
(
∨
)
(
∨
)
(
∨
)
(
×
)
活泼性不同的两个电极
形成条件二:
(
∨
)
(
×
)
电极需插进电解质溶液中
形成条件三:
(
∨
)
(
×
)
必须形成闭合回路
内部条件:
(
×
)
(
∨
)
能自发进行氧化还原反应。
活动性不同的金属或非金属导件。(燃料电池的电极一般为惰性电极)
两极插入电解质溶液中。
形成闭合电路。
能自发进行氧化还原反应。
电极
原电池构成条件
回路
溶液
本质
【合作学习】
利用下列药品和仪器:CuSO4溶液、
Cu片、锌片、导线、电流计,烧杯
1.画出你设计原电池示意图,标出正、负极并写出电极上发生的反应。
2.
描述原电池中电子的流动路线和溶液中阴阳离子的移动方向。
设计原电池
CuSO4溶液
负极:
正极:
总反应:
Zn-2e-=Zn2+
Cu2++2e-=Cu
Zn+Cu2+=Zn2++Cu
或
Zn+CuSO4=ZnSO4+Cu
电子由负极沿导线流向正极。
溶液中,
阳离子移向正极
阴离子移向负极
1.电流表指针偏转,电流逐渐变小
2.铜片表面有铜析出
3.锌片表面有铜析出
电流减小,电流不稳定
4.锌片表面会逐渐被铜全部覆盖
现象:
锌片表面为什么会有铜析出?
锌片被铜全部覆盖后会造成什么样的后果?你有什么好办法?
探究1、为什么锌片和铜片上都有红色的铜覆盖,且电流计指针逐渐指向零?
由于锌片与硫酸铜溶液直接接触,铜在锌片表面析出,锌表面也构成了原电池,致使向外输出的电流强度减弱。当锌片表面完全被铜覆盖后,不再构成原电池,也就没有电流产生。
探究2:为了避免Cu2+在锌片上直接还原析出铜,以延长电池放电时间提高供电效率。你有什么好办法?
分析
锌半电池
铜半电池
盐桥原电池构成:
盐桥
介绍盐桥
盐桥中一般装有饱和的KCl溶液和琼脂制成的胶冻;
胶冻的作用是防止管中溶液流出;
K+和Cl-能在胶冻内自由移动。
盐桥的作用:
(2)使两溶液保持电中性(平衡电荷)。
盐桥中的Cl-向Zn盐方向移动,K+向Cu盐方向移动,使Zn盐和Cu盐溶液一直保持电中性,从而使电子不断从Zn极流向Cu极
(1)使整个装置构成闭合回路。
导线传递电子,沟通外电路,而盐桥则传递阴阳离子,沟通内电路。盐桥保持溶液电中性,两个烧杯中的溶液连成一个通路。
负极:
正极:
总反应:
Zn-2e-=Zn2+
氧化反应
Cu2++2e-=Cu
还原反应
Zn+Cu2+=Zn2++Cu
或
Zn+CuSO4=ZnSO4+Cu
电子由负极沿导线流向正极。
溶液中,
阳离子移向正极
阴离子移向负极
盐桥原电池原理
ZnSO4
H2SO4
A
Zn
Cu
Cu
Zn
H2SO4
A
单液电池
双液电池
双液电池的优点:能产生持续、稳定的电流。
1、请利用:
Zn+2AgNO3=Zn(NO3)2+2Ag
的反应原理,设计一个能产生电流的原电池装置,画出装置图,并写出两个电极上的电极反应。
合作学习
负极:
Zn-2e-=Zn2+
正极:
2Ag++2e-=2Ag
AgNO3
Ag
Zn
小结:
一、原电池的构成条件:
二、盐桥的作用:
2、使两溶液保持电中性(平衡电荷)。
1、使整个装置构成闭合回路。
三、盐桥原电池原理
负极:还原性较强的物质,失电子,
发生氧化反应
正极;氧化性较强的物质,得电子,
发生还原反应
外电路;电子由负极流向正极,
内电路:阴离子移向负极,阳离子移向正极。
通过这节课你学到了什么?
A、移向Zn
极,阴离子移向Cu
极
B、移向Cu
极,阴离子移向Zn
极
C、和阴离子都移向Zn极
D、和阴离子都移向Cu
极
1、锌铜原电池产生电流时,阳离子
(
)
B
经典剖析
D
2、(高考全国理综卷II)在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是
(
)
(A)正极附近的SO42-离子浓度逐渐增大
(B)电子通过导线由铜片流向锌片
(C)正极有O2逸出
(D)铜片上有H2逸出
经典剖析
【考点】原电池原理
3、(高考海南化学卷)
(9分)依据氧化还原反应:2Ag+(aq)+Cu(s)
=
Cu2+(aq)+2Ag(s)设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是
;电解质溶液Y是
;
(2)银电极为电池的
极,发生的电极反应为
;X电极上发生的电极反为:
;
(3)外电路中的电子是从
电极流向_____电极。
铜(或Cu)
AgNO3溶液
Ag++e-
=
Ag
正
Cu-2e-
=
Cu2+
正(Ag)
负(Cu)
经典剖析
【考点】原电池原理
请看图片
原电池
案
例
分
析
案
例
分
析
案
例
分
析
你能为她分析原因吗?
知识回顾
1、原电池定义:
将化学能转化为电能的装置
2、本质:
发生氧化还原反应
电极名称
电极材料
反应类型
电极反应
负极
正极
电子流向
离子移向
电子由
沿导线流向
。
还原反应
氧化反应
Cu
Zn
Zn-2e-=Zn2+
2H++2e-=H2↑
负极
正极
内部阴离子移向
阳离子移向
自主学习
1、根据右图完成下表
Zn
Cu
稀H2SO4
负极
正极
形成条件一:
负极:较活泼的金属
正极:较不活泼的金属、石墨等
2.判断下列哪些装置能构成原电池。为什么?
(
∨
)
(
∨
)
(
∨
)
(
×
)
活泼性不同的两个电极
形成条件二:
(
∨
)
(
×
)
电极需插进电解质溶液中
形成条件三:
(
∨
)
(
×
)
必须形成闭合回路
内部条件:
(
×
)
(
∨
)
能自发进行氧化还原反应。
活动性不同的金属或非金属导件。(燃料电池的电极一般为惰性电极)
两极插入电解质溶液中。
形成闭合电路。
能自发进行氧化还原反应。
电极
原电池构成条件
回路
溶液
本质
【合作学习】
利用下列药品和仪器:CuSO4溶液、
Cu片、锌片、导线、电流计,烧杯
1.画出你设计原电池示意图,标出正、负极并写出电极上发生的反应。
2.
描述原电池中电子的流动路线和溶液中阴阳离子的移动方向。
设计原电池
CuSO4溶液
负极:
正极:
总反应:
Zn-2e-=Zn2+
Cu2++2e-=Cu
Zn+Cu2+=Zn2++Cu
或
Zn+CuSO4=ZnSO4+Cu
电子由负极沿导线流向正极。
溶液中,
阳离子移向正极
阴离子移向负极
1.电流表指针偏转,电流逐渐变小
2.铜片表面有铜析出
3.锌片表面有铜析出
电流减小,电流不稳定
4.锌片表面会逐渐被铜全部覆盖
现象:
锌片表面为什么会有铜析出?
锌片被铜全部覆盖后会造成什么样的后果?你有什么好办法?
探究1、为什么锌片和铜片上都有红色的铜覆盖,且电流计指针逐渐指向零?
由于锌片与硫酸铜溶液直接接触,铜在锌片表面析出,锌表面也构成了原电池,致使向外输出的电流强度减弱。当锌片表面完全被铜覆盖后,不再构成原电池,也就没有电流产生。
探究2:为了避免Cu2+在锌片上直接还原析出铜,以延长电池放电时间提高供电效率。你有什么好办法?
分析
锌半电池
铜半电池
盐桥原电池构成:
盐桥
介绍盐桥
盐桥中一般装有饱和的KCl溶液和琼脂制成的胶冻;
胶冻的作用是防止管中溶液流出;
K+和Cl-能在胶冻内自由移动。
盐桥的作用:
(2)使两溶液保持电中性(平衡电荷)。
盐桥中的Cl-向Zn盐方向移动,K+向Cu盐方向移动,使Zn盐和Cu盐溶液一直保持电中性,从而使电子不断从Zn极流向Cu极
(1)使整个装置构成闭合回路。
导线传递电子,沟通外电路,而盐桥则传递阴阳离子,沟通内电路。盐桥保持溶液电中性,两个烧杯中的溶液连成一个通路。
负极:
正极:
总反应:
Zn-2e-=Zn2+
氧化反应
Cu2++2e-=Cu
还原反应
Zn+Cu2+=Zn2++Cu
或
Zn+CuSO4=ZnSO4+Cu
电子由负极沿导线流向正极。
溶液中,
阳离子移向正极
阴离子移向负极
盐桥原电池原理
ZnSO4
H2SO4
A
Zn
Cu
Cu
Zn
H2SO4
A
单液电池
双液电池
双液电池的优点:能产生持续、稳定的电流。
1、请利用:
Zn+2AgNO3=Zn(NO3)2+2Ag
的反应原理,设计一个能产生电流的原电池装置,画出装置图,并写出两个电极上的电极反应。
合作学习
负极:
Zn-2e-=Zn2+
正极:
2Ag++2e-=2Ag
AgNO3
Ag
Zn
小结:
一、原电池的构成条件:
二、盐桥的作用:
2、使两溶液保持电中性(平衡电荷)。
1、使整个装置构成闭合回路。
三、盐桥原电池原理
负极:还原性较强的物质,失电子,
发生氧化反应
正极;氧化性较强的物质,得电子,
发生还原反应
外电路;电子由负极流向正极,
内电路:阴离子移向负极,阳离子移向正极。
通过这节课你学到了什么?
A、移向Zn
极,阴离子移向Cu
极
B、移向Cu
极,阴离子移向Zn
极
C、和阴离子都移向Zn极
D、和阴离子都移向Cu
极
1、锌铜原电池产生电流时,阳离子
(
)
B
经典剖析
D
2、(高考全国理综卷II)在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是
(
)
(A)正极附近的SO42-离子浓度逐渐增大
(B)电子通过导线由铜片流向锌片
(C)正极有O2逸出
(D)铜片上有H2逸出
经典剖析
【考点】原电池原理
3、(高考海南化学卷)
(9分)依据氧化还原反应:2Ag+(aq)+Cu(s)
=
Cu2+(aq)+2Ag(s)设计的原电池如图所示。
请回答下列问题:
(1)电极X的材料是
;电解质溶液Y是
;
(2)银电极为电池的
极,发生的电极反应为
;X电极上发生的电极反为:
;
(3)外电路中的电子是从
电极流向_____电极。
铜(或Cu)
AgNO3溶液
Ag++e-
=
Ag
正
Cu-2e-
=
Cu2+
正(Ag)
负(Cu)
经典剖析
【考点】原电池原理
