人教版化学(2019)必修二 真实情景工业流程问题的教学——高一复习课《物质转化与制备》课件(共27张PPT)
文档属性
| 名称 | 人教版化学(2019)必修二 真实情景工业流程问题的教学——高一复习课《物质转化与制备》课件(共27张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 205.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-10 00:00:00 | ||
图片预览





文档简介
(共27张PPT)
真实情景工业流程问题的教学
——高一复习课《物质转化与制备》
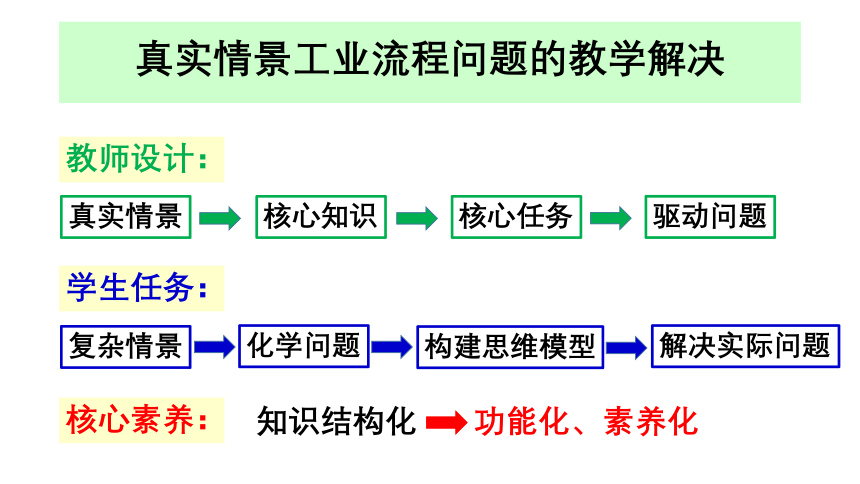
真实情景工业流程问题的教学解决
教师设计:
真实情景
核心知识
核心任务
驱动问题
学生任务:
复杂情景
化学问题
构建思维模型
解决实际问题
核心素养:
知识结构化
功能化、素养化
空气
海水
贝壳
矿石
N2、O2…
Na+、Cl-、Mg2+…
CaCO3
硫铁矿、铝土矿…
自然资源的利用
学生任务:以下列资源为原料,尽可能多的制备化学物质,绘制流程图,写出相关的反应方程式。
氧化物
金属
可制备
非金属
CaO、CO2、SO2
…
Fe、Al、Mg、Na…
O2、Cl2、Br2、I2、H2
…
酸
碱
盐
H2SO4、HNO3、HCl
NaCl、Na2CO3、NaClO
…
NaOH、Ca(OH)2、NH3·H2O
自然资源的利用
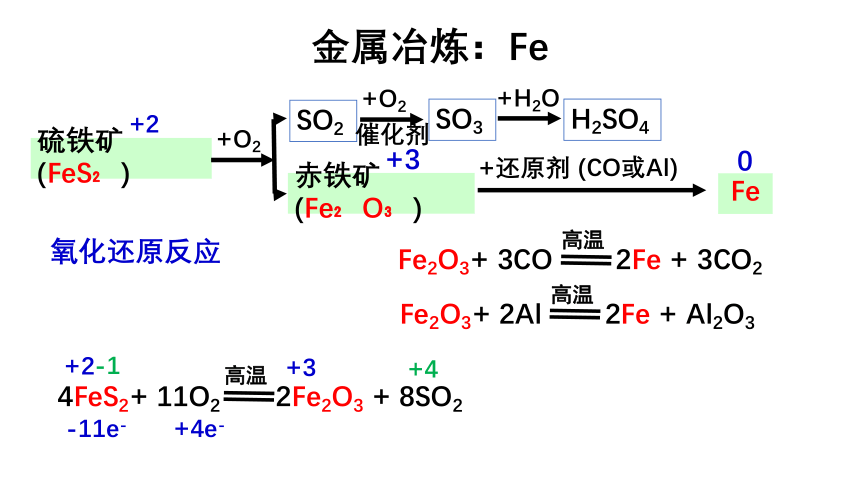
金属冶炼:Fe
赤铁矿(Fe?O?)
+3
0
Fe
+还原剂
(CO或Al)
硫铁矿(FeS?)
+2
+O2
-1
Fe2O3+
3CO
2Fe
+
3CO2
高温
Fe2O3+
2Al
2Fe
+
Al2O3
高温
4FeS2+
11O2
2Fe2O3
+
8SO2
高温
SO2
+O2
催化剂
SO3
+H2O
H2SO4
+3
+4
-11e-
+4e-
+2
氧化还原反应
金属冶炼:Al
Al?O?
+3
0
Al
Al2O3+2NaOH
2NaAlO2+H2O
2Al(OH)3
Al2O3
+
3H2O
△
通电
冰晶石
通电
2Al2O3(熔融)
4Al+3O2↑
冰晶石
铝土矿
(Al2O3
Fe2O3
SiO2)
足量NaOH
溶液,过滤
赤泥:Fe2O3
Na2O·Al2O3·1.7SiO2·nH2O
溶液:
NaAlO2
NaOH
过量CO2
Al(OH)3
溶液
NaHCO3
灼烧
NaAlO2+CO2+2H2O
Al(OH)3↓+NaHCO3
回收利用节约资源
氧化还原反应
复分解反应
金属冶炼:Mg
无水MgCl?
Mg
氯化物
金属单质
Mg2++2OH-
Mg(OH)2↓
通电
通电
MgCl2(熔融)
Mg+Cl2↑
浓缩
过量Ca(OH)2
溶液
Mg(OH)2
CaSO4
盐酸
MgCl2溶液
Mg(OH)2+2HCl
MgCl2+2H2O
CaSO4
海水
Na+
Cl-
Mg2+
Ca2+
SO42-
贝壳
煅烧
CaO
水
CaCO3
CaO+CO2↑
高温
CaO+H2O
Ca(OH)2
氧化还原反应
复分解反应
Ca2++SO42-
CaSO4↓
过量NaOH
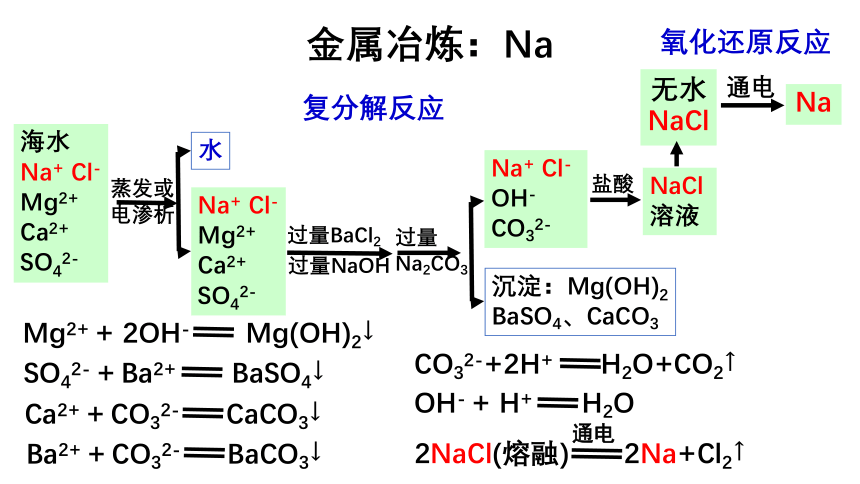
金属冶炼:Na
Mg2+
+
2OH-
Mg(OH)2↓
通电
2NaCl(熔融)
2Na+Cl2↑
海水
Na+
Cl-
Mg2+
Ca2+
SO42-
蒸发或
电渗析
水
Na+
Cl-
Mg2+
Ca2+
SO42-
盐酸
Na+
Cl-OH-
CO32-
CO32-+2H+
H2O+CO2↑
沉淀:Mg(OH)2
BaSO4、CaCO3
过量BaCl2
过量Na2CO3
NaCl
溶液
无水NaCl
Na
通电
SO42-
+
Ba2+
BaSO4↓
Ca2+
+
CO32-
CaCO3↓
Ba2+
+
CO32-
BaCO3↓
复分解反应
氧化还原反应
OH-
+
H+
H2O
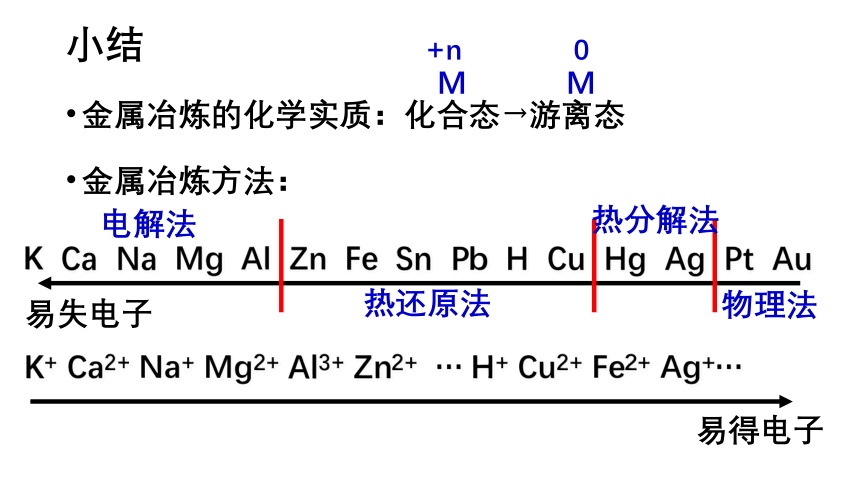
小结
金属冶炼的化学实质:化合态→游离态
+n
0
M
M
K+
Ca2+
Na+
Mg2+
Al3+
Zn2+
…
H+
Cu2+
Fe2+
Ag+…
金属冶炼方法:
易得电子
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
H
Cu
Hg
Ag
Pt
Au
易失电子
物理法
热分解法
热还原法
电解法
非金属制取:O2
O2
空气
(N2、O2)
低温
低压
2KMnO4
K2MnO4+MnO2+O2↑
△
2Na2O2+2CO2
2Na2CO3+O2
液态空气
(N2、O2)
低温
蒸发
N2
液O2
升温
工业
实验室
MnO2
2H2O2
2H2O+O2↑
MnO2
2KClO3
2KCl+3O2↑
△
通电
2H2O
2H2↑+O2↑
2Na2O2+2H2O
4NaOH+O2↑
2CaO2+2H2O
2Ca(OH)2+O2↑
NH3
HNO3
氮肥
实际应用
供给呼吸
作氧化剂
氨水
物理原理
氧化还原
反应
非金属制取:Cl2
Cl2
海水
(NaCl)
饱和NaCl
通电
H2
NaOH
工业
实验室
通电
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
通电
2NaCl(熔融)
2Na+Cl2↑
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
△
NaCl固体
实际应用
Cl2+2NaOH
NaCl+NaClO+H2O
漂白液
2Cl2+2Ca(OH)2
CaCl2+Ca(ClO)2+2H2O
漂白粉漂粉精
H2O
强氧化剂
氧化还原反应
Br2
海水
(Br-)
空气Br2
SO2
H2O
空气
Cl2
酸
空气
HBr
Cl2
H2O
蒸馏
2Br-+Cl2
Br2+2Cl-
Br2+SO2+H2O
4H++2Br-+SO42-
非金属制取:Br2
2Br-+Cl2
Br2+2Cl-
溴及其化合物在医药、农药、染料和阻燃剂等的生产中有广泛应用。
实际应用
第一次富集
第二次富集
氧化还原反应
I2
海带
溶液I2
CCl4
水溶液
灼烧
浸泡
I2
CCl4
蒸馏
2I-+H2O2+2H+
I2+2H2O
非金属制取:I2
海带灰
残渣
溶液I-
H2O2
稀硫酸
CCl4
碘元素是甲状腺激素的重要成分。
碘用于制造药物、染料、碘酒、试纸和碘化物等
实际应用
氧化还原反应
非金属制取:H2
Cl2
海水
(NaCl)
饱和NaCl
通电
H2
NaOH
工业
实验室
通电
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
Zn+H2SO4(稀)
ZnSO4+H2↑
NaCl固体
实际应用
点燃
H2+Cl2
2HCl
H2O
通电
2H2O
2H2↑+O2↑
氧化还原反应
小结
非金属单质冶炼:
物理方法
游离态:N2、O2、S等
化合态→游离态:Cl2、Br2、H2等
氧化还原反应
分离提纯
物态转化
工业制备酸:H2SO4
Fe?O?
Fe
硫磺(S)
O2
SO3+
H2O
H2SO4
4FeS2+
11O2
2Fe2O3
+
8SO2
高温
SO2
O2
催化剂
SO3
H2O
H2SO4
+4
+6
2SO2+O2
2SO3
催化剂
Δ
实际应用
重要的化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等。
干燥剂
硫铁矿(FeS?)
S
+
O2
SO2
点燃
-1
+6
氧化还原反应
复分解反应
工业制备酸:盐酸
Cl2
海水
(NaCl)
饱和NaCl
通电
H2
NaOH
通电
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
NaCl固体
实际应用
H2O
点燃
HCl
H2O
盐酸
点燃
H2+Cl2
2HCl
重要的化工产品,用于金属表面除锈,制造药物等。
氧化还原反应
工业制备酸:HNO3
2NO+
O2
2NO2
2N2+3H2
2NH3
催化剂
高温高压
实际应用
重要的化工原料。用于生产化肥、农药、炸药、染料等。
强氧化剂
O2
空气
(N2、O2)
分离
N2
NH3
HNO3
NO
H2
催化剂
高温、高压
O2催化剂
△
O2
NO2
H2O
4NH3+
5O2
4NO
+
6H2O
催化剂
△
3NO2+H2O
2HNO3+NO
氧化还原反应
工业制备碱:NaOH
Cl2
海水
(NaCl)
饱和NaCl
通电
H2
NaOH
通电
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
NaCl固体
实际应用
H2O
HCl
重要的化工原料,用于纺织、印染、制肥皂、造纸、石油等工业。
生活中的清洁剂——去油污。
Na2CO3+Ca(OH)2
CaCO3↓+2NaOH
复分解反应
工业制取碱:Ca(OH)2
CO2
贝壳
(CaCO3)
煅烧
CaO
CaCO3
CaO+CO2↑
高温
CaO+H2O
Ca(OH)2
实际应用
H2O
Ca(OH)2
NaHCO3
Na2CO3
CaO:干燥剂
Ca(OH)2:化工原料、建筑材料、配制波尔多液等
复分解反应
工业制备碱:NH3·H2O
2N2+3H2
2NH3
催化剂
高温高压
实际应用
常用弱碱
O2
空气
(N2、O2)
分离
N2
NH3
NH3·H2O
H2
催化剂
高温、高压
H2O
NH3+H2O
NH3·H2O
NH4+
+
OH-
氧化还原反应
复分解反应
过量NaOH
工业制备:NaCl
Mg2+
+
2OH-
Mg(OH)2↓
海水
Na+
Cl-
Mg2+
Ca2+
SO42-
蒸发或
电渗析
水
Na+
Cl-
Mg2+
Ca2+
SO42-
盐酸
Na+
Cl-OH-
CO32-
CO32-+2H+
H2O+CO2↑
沉淀:Mg(OH)2
BaSO4、CaCO3
过量BaCl2
过量Na2CO3
NaCl
溶液
NaCl固体
SO42-
+
Ba2+
BaSO4↓
Ca2+
+
CO32-
CaCO3↓
Ba2+
+
CO32-
BaCO3↓
实际应用
通电
2NaCl(熔融)
2Na+Cl2↑
通电
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
NaCl+
NH3+
H2O
+
CO2=
NaHCO3↓+
NH4Cl
复分解反应
OH-
+
H+
H2O
工业制取纯碱:Na2CO3
饱和
NaCl
2NaHCO3
Na2CO3+H2O+CO2↑
△
实际应用
NaHCO3
Na2CO3
NH3
CO2
溶液(NH4Cl、NaHCO3、NaCl)
母液(NaCl)
NH4Cl
煅烧
CO2、H2O
NaCl+
NH3+
H2O
+
CO2=
NaHCO3↓+
NH4Cl
用于食品、造纸、搪瓷、洗涤、冶金、纺织印染、医药、玻璃生产等领域
复分解反应
NH3
传递核心元素增减其他元素
投入少
产出多
环保
工业生产
1.物质转化
路径选择
2.基于原理
条件控制
与优化
(1)反应规律
(2)分离提纯
氧化还原
复分解
转换物态
c
(pH)
T
P
t
……
速率与平衡
工业制备的基本思路
O2
KMnO4
Cl2
HNO3
常见氧化剂
浓H2SO4
FeCl3
空气
NaCl
SO3
SO2
NO2
FeS?
NO
NH3
N2
氧还反应
强制弱
点燃
2Fe
+
3Cl2
3FeCl3
通电
?
Al
Na2SO3
Fe
H2
常见还原剂
C
SO2
Al2O3
Fe2O3
煤、有机物
SO2
Fe
氧还反应:强制弱
FeSO4
通电
FeS2
通电
饱和NaCl、H2O
S、FeS2
谢谢!
真实情景工业流程问题的教学
——高一复习课《物质转化与制备》
真实情景工业流程问题的教学解决
教师设计:
真实情景
核心知识
核心任务
驱动问题
学生任务:
复杂情景
化学问题
构建思维模型
解决实际问题
核心素养:
知识结构化
功能化、素养化
空气
海水
贝壳
矿石
N2、O2…
Na+、Cl-、Mg2+…
CaCO3
硫铁矿、铝土矿…
自然资源的利用
学生任务:以下列资源为原料,尽可能多的制备化学物质,绘制流程图,写出相关的反应方程式。
氧化物
金属
可制备
非金属
CaO、CO2、SO2
…
Fe、Al、Mg、Na…
O2、Cl2、Br2、I2、H2
…
酸
碱
盐
H2SO4、HNO3、HCl
NaCl、Na2CO3、NaClO
…
NaOH、Ca(OH)2、NH3·H2O
自然资源的利用
金属冶炼:Fe
赤铁矿(Fe?O?)
+3
0
Fe
+还原剂
(CO或Al)
硫铁矿(FeS?)
+2
+O2
-1
Fe2O3+
3CO
2Fe
+
3CO2
高温
Fe2O3+
2Al
2Fe
+
Al2O3
高温
4FeS2+
11O2
2Fe2O3
+
8SO2
高温
SO2
+O2
催化剂
SO3
+H2O
H2SO4
+3
+4
-11e-
+4e-
+2
氧化还原反应
金属冶炼:Al
Al?O?
+3
0
Al
Al2O3+2NaOH
2NaAlO2+H2O
2Al(OH)3
Al2O3
+
3H2O
△
通电
冰晶石
通电
2Al2O3(熔融)
4Al+3O2↑
冰晶石
铝土矿
(Al2O3
Fe2O3
SiO2)
足量NaOH
溶液,过滤
赤泥:Fe2O3
Na2O·Al2O3·1.7SiO2·nH2O
溶液:
NaAlO2
NaOH
过量CO2
Al(OH)3
溶液
NaHCO3
灼烧
NaAlO2+CO2+2H2O
Al(OH)3↓+NaHCO3
回收利用节约资源
氧化还原反应
复分解反应
金属冶炼:Mg
无水MgCl?
Mg
氯化物
金属单质
Mg2++2OH-
Mg(OH)2↓
通电
通电
MgCl2(熔融)
Mg+Cl2↑
浓缩
过量Ca(OH)2
溶液
Mg(OH)2
CaSO4
盐酸
MgCl2溶液
Mg(OH)2+2HCl
MgCl2+2H2O
CaSO4
海水
Na+
Cl-
Mg2+
Ca2+
SO42-
贝壳
煅烧
CaO
水
CaCO3
CaO+CO2↑
高温
CaO+H2O
Ca(OH)2
氧化还原反应
复分解反应
Ca2++SO42-
CaSO4↓
过量NaOH
金属冶炼:Na
Mg2+
+
2OH-
Mg(OH)2↓
通电
2NaCl(熔融)
2Na+Cl2↑
海水
Na+
Cl-
Mg2+
Ca2+
SO42-
蒸发或
电渗析
水
Na+
Cl-
Mg2+
Ca2+
SO42-
盐酸
Na+
Cl-OH-
CO32-
CO32-+2H+
H2O+CO2↑
沉淀:Mg(OH)2
BaSO4、CaCO3
过量BaCl2
过量Na2CO3
NaCl
溶液
无水NaCl
Na
通电
SO42-
+
Ba2+
BaSO4↓
Ca2+
+
CO32-
CaCO3↓
Ba2+
+
CO32-
BaCO3↓
复分解反应
氧化还原反应
OH-
+
H+
H2O
小结
金属冶炼的化学实质:化合态→游离态
+n
0
M
M
K+
Ca2+
Na+
Mg2+
Al3+
Zn2+
…
H+
Cu2+
Fe2+
Ag+…
金属冶炼方法:
易得电子
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
H
Cu
Hg
Ag
Pt
Au
易失电子
物理法
热分解法
热还原法
电解法
非金属制取:O2
O2
空气
(N2、O2)
低温
低压
2KMnO4
K2MnO4+MnO2+O2↑
△
2Na2O2+2CO2
2Na2CO3+O2
液态空气
(N2、O2)
低温
蒸发
N2
液O2
升温
工业
实验室
MnO2
2H2O2
2H2O+O2↑
MnO2
2KClO3
2KCl+3O2↑
△
通电
2H2O
2H2↑+O2↑
2Na2O2+2H2O
4NaOH+O2↑
2CaO2+2H2O
2Ca(OH)2+O2↑
NH3
HNO3
氮肥
实际应用
供给呼吸
作氧化剂
氨水
物理原理
氧化还原
反应
非金属制取:Cl2
Cl2
海水
(NaCl)
饱和NaCl
通电
H2
NaOH
工业
实验室
通电
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
通电
2NaCl(熔融)
2Na+Cl2↑
MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
△
NaCl固体
实际应用
Cl2+2NaOH
NaCl+NaClO+H2O
漂白液
2Cl2+2Ca(OH)2
CaCl2+Ca(ClO)2+2H2O
漂白粉漂粉精
H2O
强氧化剂
氧化还原反应
Br2
海水
(Br-)
空气Br2
SO2
H2O
空气
Cl2
酸
空气
HBr
Cl2
H2O
蒸馏
2Br-+Cl2
Br2+2Cl-
Br2+SO2+H2O
4H++2Br-+SO42-
非金属制取:Br2
2Br-+Cl2
Br2+2Cl-
溴及其化合物在医药、农药、染料和阻燃剂等的生产中有广泛应用。
实际应用
第一次富集
第二次富集
氧化还原反应
I2
海带
溶液I2
CCl4
水溶液
灼烧
浸泡
I2
CCl4
蒸馏
2I-+H2O2+2H+
I2+2H2O
非金属制取:I2
海带灰
残渣
溶液I-
H2O2
稀硫酸
CCl4
碘元素是甲状腺激素的重要成分。
碘用于制造药物、染料、碘酒、试纸和碘化物等
实际应用
氧化还原反应
非金属制取:H2
Cl2
海水
(NaCl)
饱和NaCl
通电
H2
NaOH
工业
实验室
通电
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
Zn+H2SO4(稀)
ZnSO4+H2↑
NaCl固体
实际应用
点燃
H2+Cl2
2HCl
H2O
通电
2H2O
2H2↑+O2↑
氧化还原反应
小结
非金属单质冶炼:
物理方法
游离态:N2、O2、S等
化合态→游离态:Cl2、Br2、H2等
氧化还原反应
分离提纯
物态转化
工业制备酸:H2SO4
Fe?O?
Fe
硫磺(S)
O2
SO3+
H2O
H2SO4
4FeS2+
11O2
2Fe2O3
+
8SO2
高温
SO2
O2
催化剂
SO3
H2O
H2SO4
+4
+6
2SO2+O2
2SO3
催化剂
Δ
实际应用
重要的化工原料。用于生产化肥、农药、火药、染料以及冶炼金属、精炼石油和金属除锈等。
干燥剂
硫铁矿(FeS?)
S
+
O2
SO2
点燃
-1
+6
氧化还原反应
复分解反应
工业制备酸:盐酸
Cl2
海水
(NaCl)
饱和NaCl
通电
H2
NaOH
通电
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
NaCl固体
实际应用
H2O
点燃
HCl
H2O
盐酸
点燃
H2+Cl2
2HCl
重要的化工产品,用于金属表面除锈,制造药物等。
氧化还原反应
工业制备酸:HNO3
2NO+
O2
2NO2
2N2+3H2
2NH3
催化剂
高温高压
实际应用
重要的化工原料。用于生产化肥、农药、炸药、染料等。
强氧化剂
O2
空气
(N2、O2)
分离
N2
NH3
HNO3
NO
H2
催化剂
高温、高压
O2催化剂
△
O2
NO2
H2O
4NH3+
5O2
4NO
+
6H2O
催化剂
△
3NO2+H2O
2HNO3+NO
氧化还原反应
工业制备碱:NaOH
Cl2
海水
(NaCl)
饱和NaCl
通电
H2
NaOH
通电
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
NaCl固体
实际应用
H2O
HCl
重要的化工原料,用于纺织、印染、制肥皂、造纸、石油等工业。
生活中的清洁剂——去油污。
Na2CO3+Ca(OH)2
CaCO3↓+2NaOH
复分解反应
工业制取碱:Ca(OH)2
CO2
贝壳
(CaCO3)
煅烧
CaO
CaCO3
CaO+CO2↑
高温
CaO+H2O
Ca(OH)2
实际应用
H2O
Ca(OH)2
NaHCO3
Na2CO3
CaO:干燥剂
Ca(OH)2:化工原料、建筑材料、配制波尔多液等
复分解反应
工业制备碱:NH3·H2O
2N2+3H2
2NH3
催化剂
高温高压
实际应用
常用弱碱
O2
空气
(N2、O2)
分离
N2
NH3
NH3·H2O
H2
催化剂
高温、高压
H2O
NH3+H2O
NH3·H2O
NH4+
+
OH-
氧化还原反应
复分解反应
过量NaOH
工业制备:NaCl
Mg2+
+
2OH-
Mg(OH)2↓
海水
Na+
Cl-
Mg2+
Ca2+
SO42-
蒸发或
电渗析
水
Na+
Cl-
Mg2+
Ca2+
SO42-
盐酸
Na+
Cl-OH-
CO32-
CO32-+2H+
H2O+CO2↑
沉淀:Mg(OH)2
BaSO4、CaCO3
过量BaCl2
过量Na2CO3
NaCl
溶液
NaCl固体
SO42-
+
Ba2+
BaSO4↓
Ca2+
+
CO32-
CaCO3↓
Ba2+
+
CO32-
BaCO3↓
实际应用
通电
2NaCl(熔融)
2Na+Cl2↑
通电
2NaCl+2H2O
2NaOH+H2↑+Cl2↑
NaCl+
NH3+
H2O
+
CO2=
NaHCO3↓+
NH4Cl
复分解反应
OH-
+
H+
H2O
工业制取纯碱:Na2CO3
饱和
NaCl
2NaHCO3
Na2CO3+H2O+CO2↑
△
实际应用
NaHCO3
Na2CO3
NH3
CO2
溶液(NH4Cl、NaHCO3、NaCl)
母液(NaCl)
NH4Cl
煅烧
CO2、H2O
NaCl+
NH3+
H2O
+
CO2=
NaHCO3↓+
NH4Cl
用于食品、造纸、搪瓷、洗涤、冶金、纺织印染、医药、玻璃生产等领域
复分解反应
NH3
传递核心元素增减其他元素
投入少
产出多
环保
工业生产
1.物质转化
路径选择
2.基于原理
条件控制
与优化
(1)反应规律
(2)分离提纯
氧化还原
复分解
转换物态
c
(pH)
T
P
t
……
速率与平衡
工业制备的基本思路
O2
KMnO4
Cl2
HNO3
常见氧化剂
浓H2SO4
FeCl3
空气
NaCl
SO3
SO2
NO2
FeS?
NO
NH3
N2
氧还反应
强制弱
点燃
2Fe
+
3Cl2
3FeCl3
通电
?
Al
Na2SO3
Fe
H2
常见还原剂
C
SO2
Al2O3
Fe2O3
煤、有机物
SO2
Fe
氧还反应:强制弱
FeSO4
通电
FeS2
通电
饱和NaCl、H2O
S、FeS2
谢谢!
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
