人教化学选修4第四章 第一节 原电池(共20张PPT)
文档属性
| 名称 | 人教化学选修4第四章 第一节 原电池(共20张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-09 00:00:00 | ||
图片预览








文档简介
(共20张PPT)
第一节 原电池
第四章 电化学基础
教学目标
1、知识目标:
①了解原电池形成条件
。
②理解原电池原理。
2、能力目标:培养观察能力、类推思维能
力及归纳思维能力。
3、情感目标:培养辩证唯物主义思想。
教学重点
1、原电池形成条件及原电池工作原理
教学难点
原电池原理的理解
教学方法
实验探究教学法
各类电池
知识点1:各类电池
空气电池
发明电池的故事
说起原电池的发明,有一段有趣的故事。1786年,著名的意大利医师、生物学家伽伐尼,偶然发现挂在窗前铁栅栏的铜钩上的青蛙腿肌肉,每当碰到铁栅栏就猛烈地收缩一次。这偶然的现象并没有被伽伐尼放过,经不懈的探索和思考,第一个提出了“动物电”的见解。他认为:青蛙神经和肌肉是两种不同的组织,带有相反电荷,所以两者存在着电位差,一旦用导电材料将两者接通,就有电流通过,铁栅栏和铜钩在此接通了电路,于是有电流产生,由于有动物电流的刺激,蛙腿肌肉发生收缩。
发明电池的故事
动物电”的发现引起了意大利物理学家伏打的极大兴趣,他在多次重复伽伐尼的“动物电”实验时,发现实验成败的关键在于其中的两种金属――铁和铜,若把钩着蛙腿的铜钩换成铁钩,肌肉就不会收缩。他认为“动物电”的实质是金属属性不同造成的,不同金属带有不同的电量,它们之间必然存在电位差,若有导线在中间连接,就会产生电流,蛙腿的收缩正是这种原因产生的电流刺激的结果。
伏特经过反复实验,终于发明了被后人称做“伏特电堆”的电池,这就是在铜板和锌板中间夹上卡纸和用盐水浸过的布片,一层一层堆起来的蓄电池。这种电池,今天仍然在使用着
为了纪念他的贡献,人们把电压的计量单位叫做伏特,简称伏,符号V。比如我们手电筒里的电池的电压是1.5伏特,我们家里的电灯的电压是220伏特。
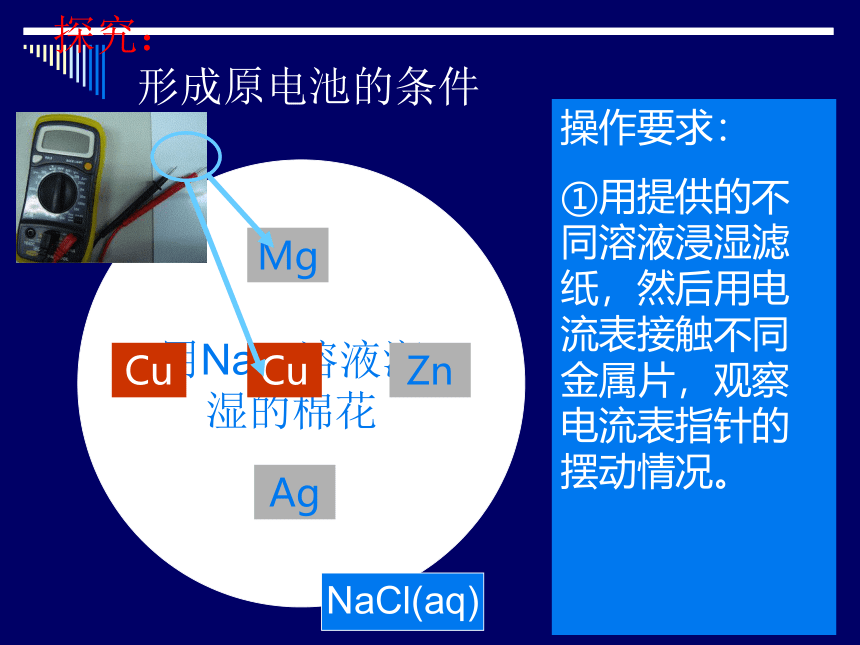
探究:
形成原电池的条件
NaCl(aq)
用NaCl溶液润湿的棉花
Cu
Cu
Mg
Zn
Ag
操作要求:
①用提供的不同溶液浸湿滤纸,然后用电流表接触不同金属片,观察电流表指针的摆动情况。
具体方案:
实验
电极接触
溶液A
溶液B
一
电极接触同一种材料
硫酸或硫酸铜
酒精或白糖水
二
电极接触不同种材料
硫酸或硫酸铜
酒精或白糖水
三
电极接触不同种材料
无
四
一材料置于滤纸中,另一材料放置在滤纸外
硫酸或硫酸铜
酒精或白糖水
实验情况汇报
1、两种活动性不同的金属(或一种非金属导体)作电极
2、电极材料必须和电解质溶液接触
3、两电极相连形成闭合回路
A
B
一
无
无
二
有
无
三
无
无
四
无
无
铜锌原电池
Cu
Cu2+
Cu2+
SO4
2-
SO4
2-
Zn
Cu2+
SO42-
Zn2+
Zn-2e-=Zn2+
Cu2++2e-=Cu
外电路
内电路
负极
正极
3、原电池工作原理(以Cu-Zn原电池为例)
负极(Zn)
正极(Cu)
e-
外导线
e-
溶液中的离子
阴离子
OH-
SO4
2-
阳离子
H+
Cu2+
离子流向
电子流向
电极反应
Zn-2e-=Zn2+
Cu2+
+2e-=Cu
氧化反应
还原反应
说明
溶液中靠自由移动的离子导电,无电子通过,外电路中靠电子移动导电,无离子通过。
e-
e-
e-
小结
:原电池
定义:是一种将化学能转化为电能的装置
构成原电池的条件:
1、两种活动性不同的金属(或一种非金属导体)作电极
2、电极材料必须和电解质溶液接触
3、两电极相连形成闭合回路
小结
:原电池
原电池工作原理
较不活泼金属铜做正极,正极发生还原反
应,较活泼金属锌做负极,负极发生氧化反应。
电子流动方向:锌(负极)→导线→铜(正极)
电流方向:铜(正极)
→导线→锌(负极)。
下列装置中哪些可以形成原电池?
负极
Zn片:
Zn-2e-=Zn2+
正极
Cu片:
Cu
2
++2e-=Cu
总反应:
Zn+
Cu
2
+
=Zn2+
+
Cu
你能推断出看到的现象吗?
课下探究:
两极与电压、电流的关系
NaCl(aq)
用NaCl溶液润湿的棉花
Cu
Cu
Mg
Zn
Ag
思考:
①电压、电流大小与两极活泼性的关系?
②产生最大电压、电流的金属对?
第一节 原电池
第四章 电化学基础
教学目标
1、知识目标:
①了解原电池形成条件
。
②理解原电池原理。
2、能力目标:培养观察能力、类推思维能
力及归纳思维能力。
3、情感目标:培养辩证唯物主义思想。
教学重点
1、原电池形成条件及原电池工作原理
教学难点
原电池原理的理解
教学方法
实验探究教学法
各类电池
知识点1:各类电池
空气电池
发明电池的故事
说起原电池的发明,有一段有趣的故事。1786年,著名的意大利医师、生物学家伽伐尼,偶然发现挂在窗前铁栅栏的铜钩上的青蛙腿肌肉,每当碰到铁栅栏就猛烈地收缩一次。这偶然的现象并没有被伽伐尼放过,经不懈的探索和思考,第一个提出了“动物电”的见解。他认为:青蛙神经和肌肉是两种不同的组织,带有相反电荷,所以两者存在着电位差,一旦用导电材料将两者接通,就有电流通过,铁栅栏和铜钩在此接通了电路,于是有电流产生,由于有动物电流的刺激,蛙腿肌肉发生收缩。
发明电池的故事
动物电”的发现引起了意大利物理学家伏打的极大兴趣,他在多次重复伽伐尼的“动物电”实验时,发现实验成败的关键在于其中的两种金属――铁和铜,若把钩着蛙腿的铜钩换成铁钩,肌肉就不会收缩。他认为“动物电”的实质是金属属性不同造成的,不同金属带有不同的电量,它们之间必然存在电位差,若有导线在中间连接,就会产生电流,蛙腿的收缩正是这种原因产生的电流刺激的结果。
伏特经过反复实验,终于发明了被后人称做“伏特电堆”的电池,这就是在铜板和锌板中间夹上卡纸和用盐水浸过的布片,一层一层堆起来的蓄电池。这种电池,今天仍然在使用着
为了纪念他的贡献,人们把电压的计量单位叫做伏特,简称伏,符号V。比如我们手电筒里的电池的电压是1.5伏特,我们家里的电灯的电压是220伏特。
探究:
形成原电池的条件
NaCl(aq)
用NaCl溶液润湿的棉花
Cu
Cu
Mg
Zn
Ag
操作要求:
①用提供的不同溶液浸湿滤纸,然后用电流表接触不同金属片,观察电流表指针的摆动情况。
具体方案:
实验
电极接触
溶液A
溶液B
一
电极接触同一种材料
硫酸或硫酸铜
酒精或白糖水
二
电极接触不同种材料
硫酸或硫酸铜
酒精或白糖水
三
电极接触不同种材料
无
四
一材料置于滤纸中,另一材料放置在滤纸外
硫酸或硫酸铜
酒精或白糖水
实验情况汇报
1、两种活动性不同的金属(或一种非金属导体)作电极
2、电极材料必须和电解质溶液接触
3、两电极相连形成闭合回路
A
B
一
无
无
二
有
无
三
无
无
四
无
无
铜锌原电池
Cu
Cu2+
Cu2+
SO4
2-
SO4
2-
Zn
Cu2+
SO42-
Zn2+
Zn-2e-=Zn2+
Cu2++2e-=Cu
外电路
内电路
负极
正极
3、原电池工作原理(以Cu-Zn原电池为例)
负极(Zn)
正极(Cu)
e-
外导线
e-
溶液中的离子
阴离子
OH-
SO4
2-
阳离子
H+
Cu2+
离子流向
电子流向
电极反应
Zn-2e-=Zn2+
Cu2+
+2e-=Cu
氧化反应
还原反应
说明
溶液中靠自由移动的离子导电,无电子通过,外电路中靠电子移动导电,无离子通过。
e-
e-
e-
小结
:原电池
定义:是一种将化学能转化为电能的装置
构成原电池的条件:
1、两种活动性不同的金属(或一种非金属导体)作电极
2、电极材料必须和电解质溶液接触
3、两电极相连形成闭合回路
小结
:原电池
原电池工作原理
较不活泼金属铜做正极,正极发生还原反
应,较活泼金属锌做负极,负极发生氧化反应。
电子流动方向:锌(负极)→导线→铜(正极)
电流方向:铜(正极)
→导线→锌(负极)。
下列装置中哪些可以形成原电池?
负极
Zn片:
Zn-2e-=Zn2+
正极
Cu片:
Cu
2
++2e-=Cu
总反应:
Zn+
Cu
2
+
=Zn2+
+
Cu
你能推断出看到的现象吗?
课下探究:
两极与电压、电流的关系
NaCl(aq)
用NaCl溶液润湿的棉花
Cu
Cu
Mg
Zn
Ag
思考:
①电压、电流大小与两极活泼性的关系?
②产生最大电压、电流的金属对?
