人教版选修4第四章第三节电解池23ppt
文档属性
| 名称 | 人教版选修4第四章第三节电解池23ppt |
|
|
| 格式 | zip | ||
| 文件大小 | 432.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-11 22:15:25 | ||
图片预览




文档简介
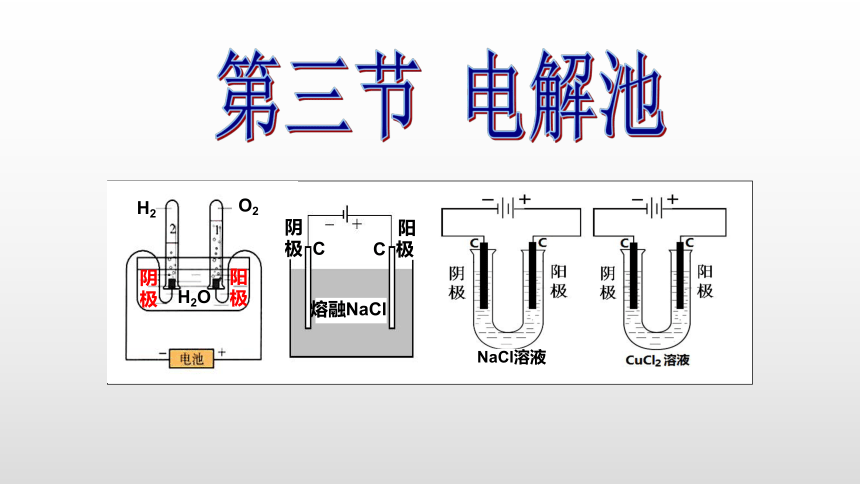
(共23张PPT)
第三节
电解池
NaCl溶液
H2
O2
H2O
熔融NaCl
阴
极
C
阳
C
极
阴
极
阳
极
思考:
1.什么叫电解池,怎么判断装置属于电解池?
2.电解池的结构如何?
两极的名称叫什么?
怎么判断两极?
两极分别发生什么反应?
怎么写电极方程式?
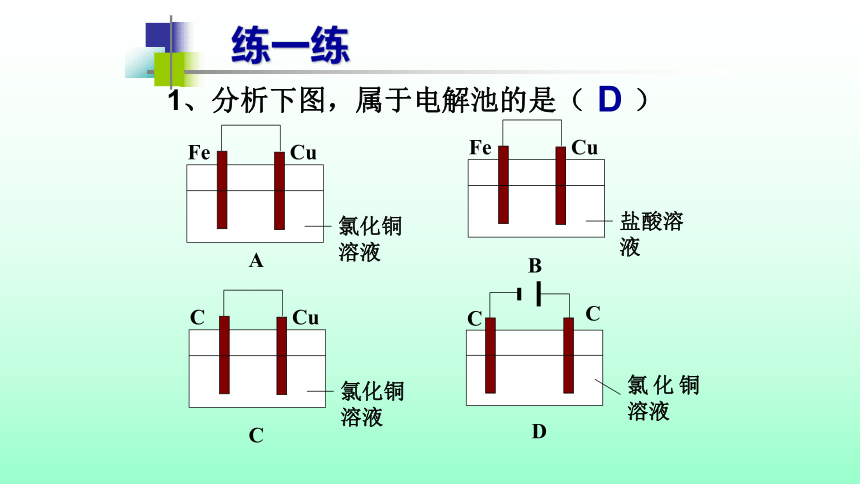
练一练
Fe
Cu
氯化铜溶液
氯化铜溶液
C
C
A
B
Fe
Cu
盐酸溶液
1、分析下图,属于电解池的是(
)
C
Cu
氯化铜溶液
D
C
D
一、电解原理:
1.电解:电流通过电解质溶液(或熔融电解质)
而在阴、阳两极引起氧化还原反应的过程。
2.电解池:电能转化为化学能的装置。
二、构成电解池的条件:
1.直流电源
2.两个电极:
3.电解质溶液或熔融的电解质;
4.闭合回路。
阴极:与电源负极相连
[还原反应]
阳极:与电源正极相连
[氧化反应]
1.电解:
2.电解池:
三、放电顺序:
阴极—阳离子,得电子能力(氧化性)强的离子先得
活泼金属
>
S2->I->Br->Cl->OH-
>…含氧酸根>F-
阳极—阴离子
,失电子能力(还原性)强的离子先失
Ag+>Hg2+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
(与离子得失电子的难易程度有关)
强者先上!
若以活泼金属(相对于Au、Pt、石墨)电极为阳极如Fe、Cu、Ag,阳极金属本身易失电子,故金属失电子。
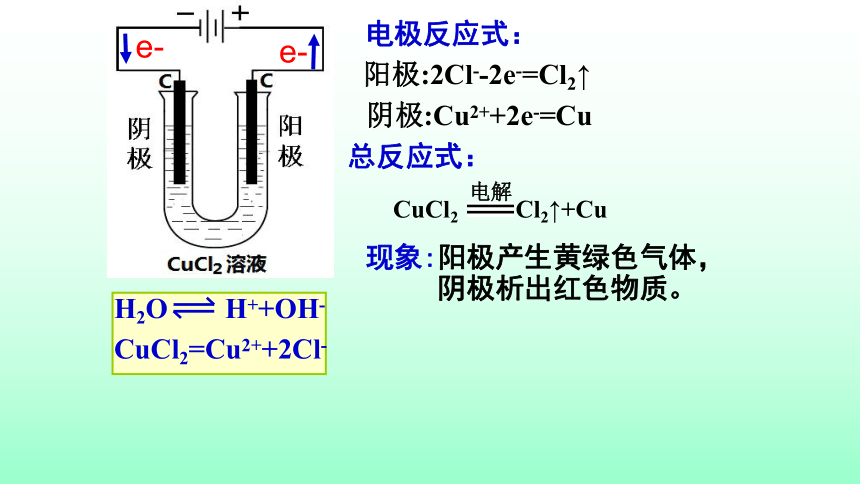
现象:
H2O
H++OH-
CuCl2=Cu2++2Cl-
阳极产生黄绿色气体,
阴极析出红色物质。
阳极:2Cl--2e-=Cl2↑
阴极:Cu2++2e-=Cu
CuCl2
Cl2↑+Cu
电解
电极反应式:
总反应式:
e-
e-
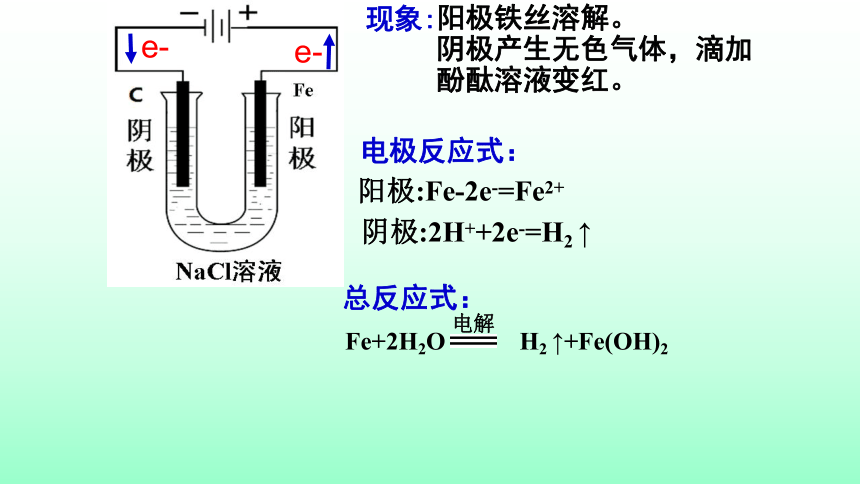
阳极:Fe-2e-=Fe2+
阴极:2H++2e-=H2
↑
电极反应式:
总反应式:
Fe+2H2O
H2
↑+Fe(OH)2
电解
e-
e-
现象:
阳极铁丝溶解。
阴极产生无色气体,滴加酚酞溶液变红。
H2O
H++OH-
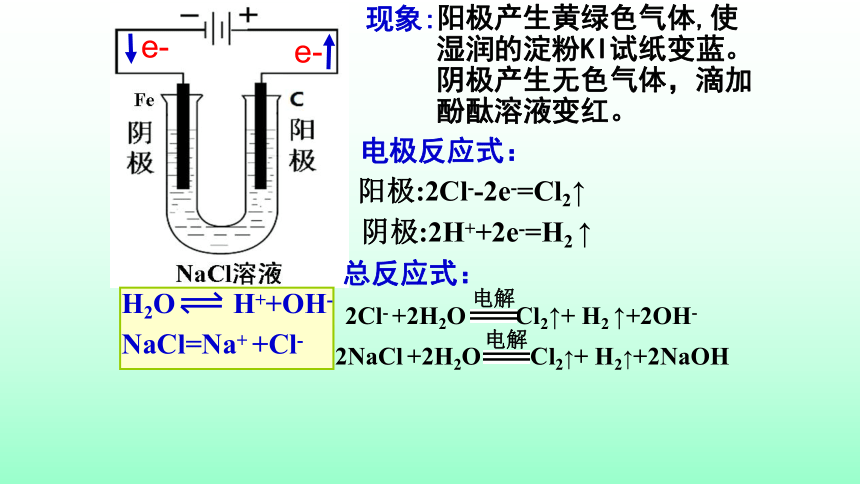
NaCl=Na+
+Cl-
阳极:2Cl--2e-=Cl2↑
阴极:2H++2e-=H2
↑
电极反应式:
现象:
总反应式:
2NaCl
+2H2O
Cl2↑+
H2↑+2NaOH
2Cl-
+2H2O
Cl2↑+
H2
↑+2OH-
电解
电解
e-
e-
阳极产生黄绿色气体,使湿润的淀粉KI试纸变蓝。
阴极产生无色气体,滴加酚酞溶液变红。
H2
O2
H2O
阴
极
阳
极
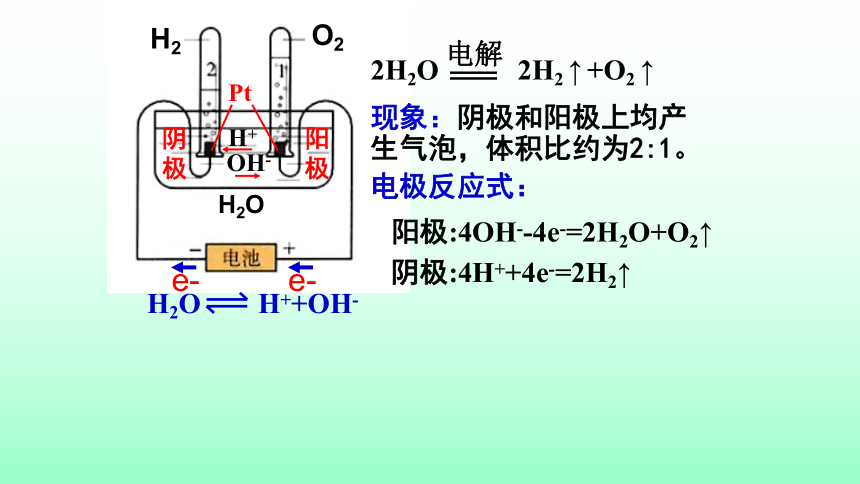
现象:阴极和阳极上均产生气泡,体积比约为2:1。
Pt
阳极:4OH--4e-=2H2O+O2↑
阴极:4H++4e-=2H2↑
电极反应式:
H+
2H2O
2H2
↑
+O2
↑
电解
OH-
H2O
H++OH-
e-
e-
2NaCl(熔融)
2Na
+Cl2
↑
熔融NaCl
阴
极
C
阳
C
极
电解
NaCl=Na+
+Cl-
阳极:2Cl--2e-=Cl2↑
阴极:2Na++2e-=2Na
电极反应式:
现象:阳极产生黄绿色气体。
e-
e-
1、标出图中电解池的阴、阳极。
2、写出电极反应式和总反应式
阳极:4OH--4e-=2H2O+O2↑
阴极:4H++4e-=2H2↑
2H2O
2H2
↑
+O2
↑
电解
阴
极
阳
极
阴
极
阳
极
Cu
Fe
(3)稀H2SO4
Cu
Fe
(4)CuSO4溶液
+
-
阳极
阴极
+
-
阳极
阴极
下列装置的电极反应式和总反应化学方程式?
阳极:Cu-2e-=Cu2+
阴极:2H++2e-=H2↑
Cu+2H2SO4
H2↑+CuSO4
电解
阳极:Cu-2e-=Cu2+
阴极:Cu2++2e-=Cu
CuSO4溶液浓度不变。
电镀池
C
Fe
NaCl溶液
氯碱工业:电解饱和食盐水制取氯气、烧碱和氢气。
电解槽
Cl2
H2
NaOH
溶液
含少量NaOH
的水
精制食盐水
淡盐水
阳极:2Cl--2e-=Cl2↑
阴极:2H++2e-=H2
↑
2NaCl
+2H2O
Cl2↑+
H2↑+2NaOH
电解
Cl2
H2
NaOH
溶液
含少量NaOH
的水
精制食盐水
淡盐水
CuSO4溶液
Cu
Fe
电镀铜—在铁片上镀铜。
待镀金属:Fe
镀层金属:Cu
电镀液:
阴极:
阳极:
含镀层金属阳离子Cu2+
电镀池
电极反应式:
阳极:Cu
-
2e-=Cu2+
阴极:Cu2+
+
2e-=Cu
CuSO4溶液浓度不变。
CuSO4溶液
粗铜
纯铜
铜的精炼
粗铜中常含有少量的Zn、Fe、Ag等金属杂质。
粗铜
纯铜
电解质溶液:
阳极:
阴极:
电极反应式:
阳极:
阴极:Cu2+
+
2e-=Cu
Cu
-
2e-=Cu2+
Zn
-
2e-=Zn2+
Fe
-
2e-=Fe2+
阳极泥:
金、银等
含Cu2+
CuSO4浓度减小。
电冶金—电解法冶炼活泼金属
2NaCl(熔融)
2Na
+Cl2
↑
电解
MgCl2(熔融)
Mg
+Cl2
↑
电解
2Al2O3(熔融)
4Al
+3O2
↑
电解
练习(2013北京理综9).用石墨电极
电解CuCl2溶液(见右图)。下列分
析正确的是(
)
A.a端是直流电源的负极
B.通电使CuCl2发生电离
C.阳极上发生的反应:Cu2++2e-=Cu
D.通电一段时间后,在阴极附近观察
到黄绿色气体
A
溶液复原问题:
电解一段时间后,要使电解质溶液恢复原来浓度,应加入什么物质?
2H2O
2H2
↑
+O2
↑
电解
NaCl溶液
2NaCl
+2H2O
Cl2↑+
H2↑+2NaOH
电解
CuCl2
Cl2↑+Cu
电解
加H2O
加H2O
加CuCl2
通HCl
练一练
2、下列有关电解质的叙述正确的是(
)
A
溶于水能导电的物质
B
熔融状态下能导电的物质
C
凡在水中生成离子的物质
D
电解质的导电过程实质上是电解过程
D
练一练
3、下列说法错误的是(
)
A
由电能转化为化学能的装置叫电解池
B
在电解池中跟直流电源的正极相连的电极是电解池的阳极
C
在电解池中通电时,电子从电解池的阴极流出,并沿导线流回电源的负极
D
电解池中阴极发生还原反应,阳极发生氧化反应
C
分别用惰性电极(石墨(C)或铂(Pt))电解下列溶液,写出电极反应式和总反应的化学方程式、离子方程式。指出实验现象和电解后溶液pH变化以及电解质溶液复原应加入的物质。
(1)HCl
(2)NaCl
(3)CuSO4
(4)稀H2SO4
Pt
Pt
仿此练习(5)KBr
(6)AgNO3
(7)NaOH
(8)Na2SO4
练习:
Pt
Pt
Pt
Pt
Pt
Pt
分析电解反应的一般思路(惰性电极电解时)
明确溶液中存在哪些离子
根据粒子的放电顺序,阳极氧化,阴极还原分析得出产物
阴阳两极附近各有哪些离子
…
第三节
电解池
NaCl溶液
H2
O2
H2O
熔融NaCl
阴
极
C
阳
C
极
阴
极
阳
极
思考:
1.什么叫电解池,怎么判断装置属于电解池?
2.电解池的结构如何?
两极的名称叫什么?
怎么判断两极?
两极分别发生什么反应?
怎么写电极方程式?
练一练
Fe
Cu
氯化铜溶液
氯化铜溶液
C
C
A
B
Fe
Cu
盐酸溶液
1、分析下图,属于电解池的是(
)
C
Cu
氯化铜溶液
D
C
D
一、电解原理:
1.电解:电流通过电解质溶液(或熔融电解质)
而在阴、阳两极引起氧化还原反应的过程。
2.电解池:电能转化为化学能的装置。
二、构成电解池的条件:
1.直流电源
2.两个电极:
3.电解质溶液或熔融的电解质;
4.闭合回路。
阴极:与电源负极相连
[还原反应]
阳极:与电源正极相连
[氧化反应]
1.电解:
2.电解池:
三、放电顺序:
阴极—阳离子,得电子能力(氧化性)强的离子先得
活泼金属
>
S2->I->Br->Cl->OH-
>…含氧酸根>F-
阳极—阴离子
,失电子能力(还原性)强的离子先失
Ag+>Hg2+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
(与离子得失电子的难易程度有关)
强者先上!
若以活泼金属(相对于Au、Pt、石墨)电极为阳极如Fe、Cu、Ag,阳极金属本身易失电子,故金属失电子。
现象:
H2O
H++OH-
CuCl2=Cu2++2Cl-
阳极产生黄绿色气体,
阴极析出红色物质。
阳极:2Cl--2e-=Cl2↑
阴极:Cu2++2e-=Cu
CuCl2
Cl2↑+Cu
电解
电极反应式:
总反应式:
e-
e-
阳极:Fe-2e-=Fe2+
阴极:2H++2e-=H2
↑
电极反应式:
总反应式:
Fe+2H2O
H2
↑+Fe(OH)2
电解
e-
e-
现象:
阳极铁丝溶解。
阴极产生无色气体,滴加酚酞溶液变红。
H2O
H++OH-
NaCl=Na+
+Cl-
阳极:2Cl--2e-=Cl2↑
阴极:2H++2e-=H2
↑
电极反应式:
现象:
总反应式:
2NaCl
+2H2O
Cl2↑+
H2↑+2NaOH
2Cl-
+2H2O
Cl2↑+
H2
↑+2OH-
电解
电解
e-
e-
阳极产生黄绿色气体,使湿润的淀粉KI试纸变蓝。
阴极产生无色气体,滴加酚酞溶液变红。
H2
O2
H2O
阴
极
阳
极
现象:阴极和阳极上均产生气泡,体积比约为2:1。
Pt
阳极:4OH--4e-=2H2O+O2↑
阴极:4H++4e-=2H2↑
电极反应式:
H+
2H2O
2H2
↑
+O2
↑
电解
OH-
H2O
H++OH-
e-
e-
2NaCl(熔融)
2Na
+Cl2
↑
熔融NaCl
阴
极
C
阳
C
极
电解
NaCl=Na+
+Cl-
阳极:2Cl--2e-=Cl2↑
阴极:2Na++2e-=2Na
电极反应式:
现象:阳极产生黄绿色气体。
e-
e-
1、标出图中电解池的阴、阳极。
2、写出电极反应式和总反应式
阳极:4OH--4e-=2H2O+O2↑
阴极:4H++4e-=2H2↑
2H2O
2H2
↑
+O2
↑
电解
阴
极
阳
极
阴
极
阳
极
Cu
Fe
(3)稀H2SO4
Cu
Fe
(4)CuSO4溶液
+
-
阳极
阴极
+
-
阳极
阴极
下列装置的电极反应式和总反应化学方程式?
阳极:Cu-2e-=Cu2+
阴极:2H++2e-=H2↑
Cu+2H2SO4
H2↑+CuSO4
电解
阳极:Cu-2e-=Cu2+
阴极:Cu2++2e-=Cu
CuSO4溶液浓度不变。
电镀池
C
Fe
NaCl溶液
氯碱工业:电解饱和食盐水制取氯气、烧碱和氢气。
电解槽
Cl2
H2
NaOH
溶液
含少量NaOH
的水
精制食盐水
淡盐水
阳极:2Cl--2e-=Cl2↑
阴极:2H++2e-=H2
↑
2NaCl
+2H2O
Cl2↑+
H2↑+2NaOH
电解
Cl2
H2
NaOH
溶液
含少量NaOH
的水
精制食盐水
淡盐水
CuSO4溶液
Cu
Fe
电镀铜—在铁片上镀铜。
待镀金属:Fe
镀层金属:Cu
电镀液:
阴极:
阳极:
含镀层金属阳离子Cu2+
电镀池
电极反应式:
阳极:Cu
-
2e-=Cu2+
阴极:Cu2+
+
2e-=Cu
CuSO4溶液浓度不变。
CuSO4溶液
粗铜
纯铜
铜的精炼
粗铜中常含有少量的Zn、Fe、Ag等金属杂质。
粗铜
纯铜
电解质溶液:
阳极:
阴极:
电极反应式:
阳极:
阴极:Cu2+
+
2e-=Cu
Cu
-
2e-=Cu2+
Zn
-
2e-=Zn2+
Fe
-
2e-=Fe2+
阳极泥:
金、银等
含Cu2+
CuSO4浓度减小。
电冶金—电解法冶炼活泼金属
2NaCl(熔融)
2Na
+Cl2
↑
电解
MgCl2(熔融)
Mg
+Cl2
↑
电解
2Al2O3(熔融)
4Al
+3O2
↑
电解
练习(2013北京理综9).用石墨电极
电解CuCl2溶液(见右图)。下列分
析正确的是(
)
A.a端是直流电源的负极
B.通电使CuCl2发生电离
C.阳极上发生的反应:Cu2++2e-=Cu
D.通电一段时间后,在阴极附近观察
到黄绿色气体
A
溶液复原问题:
电解一段时间后,要使电解质溶液恢复原来浓度,应加入什么物质?
2H2O
2H2
↑
+O2
↑
电解
NaCl溶液
2NaCl
+2H2O
Cl2↑+
H2↑+2NaOH
电解
CuCl2
Cl2↑+Cu
电解
加H2O
加H2O
加CuCl2
通HCl
练一练
2、下列有关电解质的叙述正确的是(
)
A
溶于水能导电的物质
B
熔融状态下能导电的物质
C
凡在水中生成离子的物质
D
电解质的导电过程实质上是电解过程
D
练一练
3、下列说法错误的是(
)
A
由电能转化为化学能的装置叫电解池
B
在电解池中跟直流电源的正极相连的电极是电解池的阳极
C
在电解池中通电时,电子从电解池的阴极流出,并沿导线流回电源的负极
D
电解池中阴极发生还原反应,阳极发生氧化反应
C
分别用惰性电极(石墨(C)或铂(Pt))电解下列溶液,写出电极反应式和总反应的化学方程式、离子方程式。指出实验现象和电解后溶液pH变化以及电解质溶液复原应加入的物质。
(1)HCl
(2)NaCl
(3)CuSO4
(4)稀H2SO4
Pt
Pt
仿此练习(5)KBr
(6)AgNO3
(7)NaOH
(8)Na2SO4
练习:
Pt
Pt
Pt
Pt
Pt
Pt
分析电解反应的一般思路(惰性电极电解时)
明确溶液中存在哪些离子
根据粒子的放电顺序,阳极氧化,阴极还原分析得出产物
阴阳两极附近各有哪些离子
…
