人教化学选修4第三章 第二节 水的电离和溶液的酸碱性第1课时(共21张PPT)
文档属性
| 名称 | 人教化学选修4第三章 第二节 水的电离和溶液的酸碱性第1课时(共21张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-10 00:00:00 | ||
图片预览






文档简介
(共21张PPT)
水乃生命之源,你对水又了解多少呢?
第二节
水的电离和溶液的酸碱性
第1课时
水的电离
溶液的酸碱性与pH
1.了解水的电离和影响水的电离的条件。
2.掌握水的离子积。
3.明确溶液酸碱性产生的原因,能正确判断溶液的酸碱性。
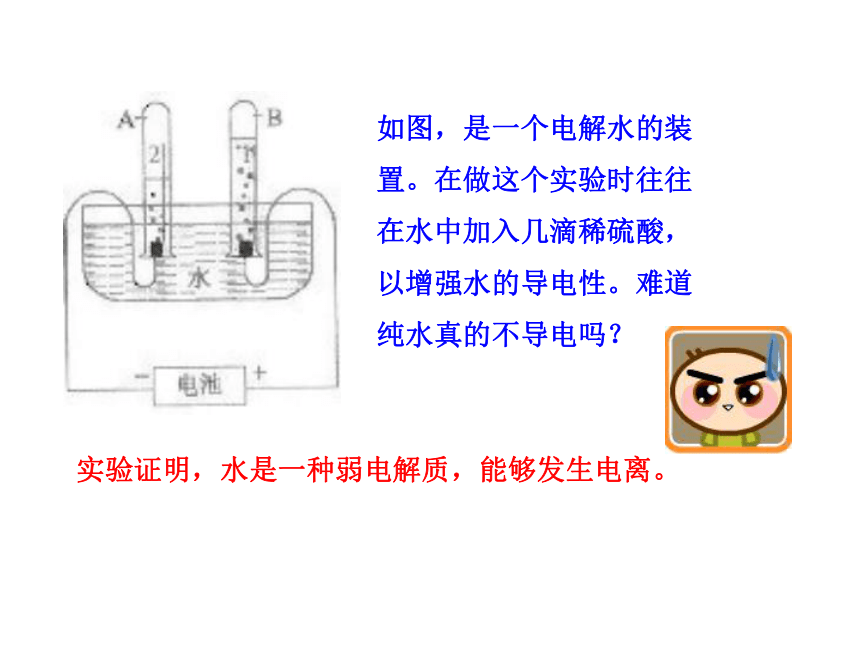
如图,是一个电解水的装置。在做这个实验时往往在水中加入几滴稀硫酸,以增强水的导电性。难道纯水真的不导电吗?
实验证明,水是一种弱电解质,能够发生电离。
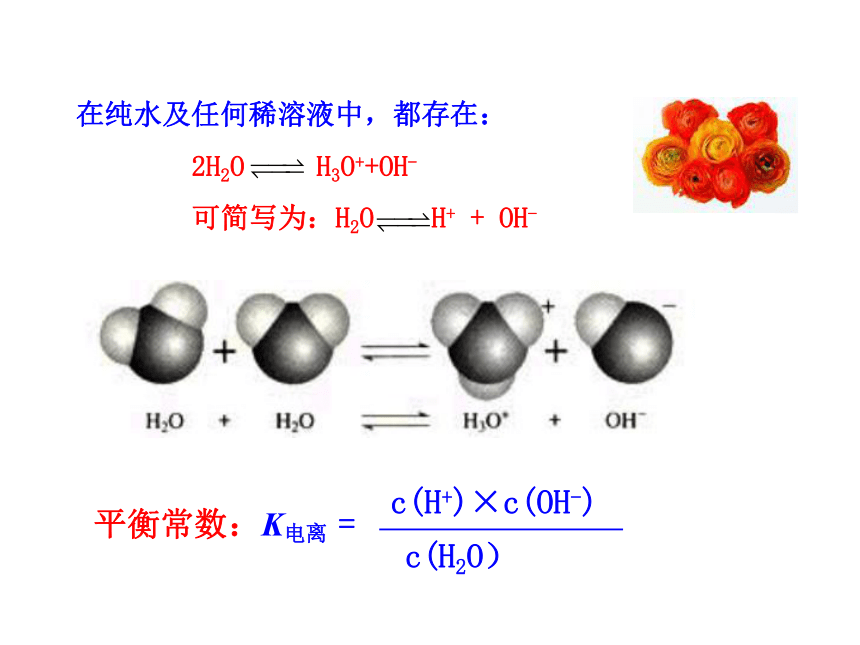
在纯水及任何稀溶液中,都存在:
2H2O
H3O++OH-
可简写为:H2O
H+
+
OH-
平衡常数:K电离
=
c(H+)×c(OH-)
c(H2O)
即
KW=
c(H+)×c(OH-)
Kw
100℃
50℃
25℃
20℃
0℃
温度
1.14×10-15
6.81×10-15
1×10-14
5.47×10-14
1×10-12
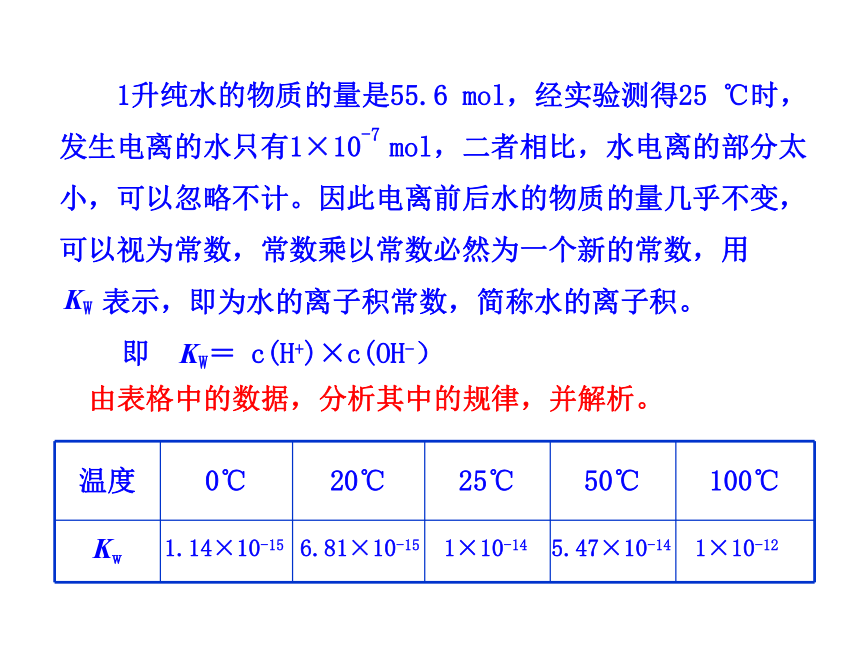
由表格中的数据,分析其中的规律,并解析。
1升纯水的物质的量是55.6
mol,经实验测得25
℃时,发生电离的水只有1×10-7
mol,二者相比,水电离的部分太小,可以忽略不计。因此电离前后水的物质的量几乎不变,可以视为常数,常数乘以常数必然为一个新的常数,用
表示,即为水的离子积常数,简称水的离子积。
KW
升高温度,促进水的电离,Kw增大。
Kw只与温度有关,与浓度无关。
温度越高,Kw越大。
水的电离是吸热过程。
室温下55.6
mol
H2O中
有1×10-7
mol
H2O电离,
因此c(H2O)可视为常数。
Kw
=
室温下
1×10-14
⑴KW叫做水的离子积常数,简称水的离子积。
特别提示:此时的c(H+)和c(OH-)是溶液中的总量。
⑵KW只是温度的函数(与浓度无关)。
⑶水本身电离出来的c(H+)和c(OH-)是相等的,但溶液中的c(H+)和c(OH-)不一定相等。
关于Kw的理解
25℃时,在10
mL蒸馏水中c(H+)和c(OH-)
各是多少?向其中加入10
mL0.2
mol/L
盐酸,c(H+)和c(OH-)如何变化?对水的电离平衡有何影响?
c(H+)
c(OH-)
c(H+)
和
c(OH-)
大小比较
酸碱性
平衡移动
蒸馏水
加酸后
10-7
10-7
10-1
10-13
c(H+)
=
c(OH-)
中性
c(H+)
>
c(OH-)
酸性
Kw
=
加酸后
1×10-14
不变
酸溶液中Kw
=
c(H+)酸·c(OH-)水
↓
↑
25℃时,在10
mL蒸馏水中c(H+)和c(OH-)各是多少?向其中加入10
mL
0.2
mol/L
氢氧化钠溶液,c(H+)和c(OH-)如何变化?对水的电离平衡有何影响?
c(H+)
c(OH-)
c(H+)
和
c(OH-)
大小比较
酸碱性
平衡移动
蒸馏水
加碱后
10-7
10-7
10-1
10-13
c(H+)
=
c(OH-)
中性
c(H+)
<
c(OH-)
碱性
Kw
=
加碱后
1×10-14
不变
碱溶液中Kw
=
c(H+)水·c(OH-)碱
↑
↓
结论:溶液的酸碱性跟c(H+)和c(OH-)相对大小有关。
常温下
c(H+)
=
c(OH-)
c(H+)
>
c(OH-)
c(H+)
<
c(OH-)
c(H+)
=
1×10-7
mol/L
c(OH-)
=
1×10-7
mol/L
c(H+)
>1×10-7
mol/L
c(OH-)
<1×10-7mol/L
中性溶液
酸性溶液
碱性溶液
c(H+)
<1×10-7
mol/L
c(OH-)>1×10-7
mol/L
溶液的酸碱性
讨论:100℃时
KW=10-12
在100
℃
时,纯水中c(H+)为多少?
c(H+)=10-6
mol/L
c(H+)>1×10-7
mol/L是否说明100
℃
时纯水溶液呈酸性?
不是,此时的纯水仍然呈中性!
100℃
时,c(H+)=1×10-7
mol/L的溶液呈酸性还是碱性?
碱性!
c(H+)=1×10-7
mol/L,c(OH-)=1×10-5
mol/L,
c(OH-)>c(H+)
pH定义:是c(H+)的负对数,即pH=-lgc(H+)。
如:c(H+)
=
1×10-7
mol/L,
pH=-lg10-7
=7.0
c(H+)
=
1×10-5
mol/L,
pH=-lg10-5
=5.0
c(H+)
=
1×10-9
mol/L,
pH=-lg10-9
=9.0
注意:当溶液中c(H+)或c(OH-)大于1
mol时,不用pH表示溶液的酸碱性。
溶液的酸碱性与pH
pH与酸、碱性的关系?
pH
0
1
2
3
4
5
6
7
8
9
10
11
12
13
14
酸性增强
中
性
碱性增强
25℃
pH的测定
(2)pH试纸
粗略测定
(1)酸碱指示剂
甲基橙
石蕊
酚酞
酸色
碱色
红
黄
红
蓝
无
红
变色范围(pH)
3.1~4.4
5.0~8.0
8.2~10.0
了解
用法:用玻璃棒蘸取溶液,点在pH试纸中央,半分钟后与标准比色卡对比。
注意:①不能用水润湿
②要放在玻璃片(或表面皿)上
③不能将试纸伸到溶液中
④广泛pH试纸只能读出整数
精确测定——pH计(酸度计)
pH试纸的使用
水的离子积
影响因素
水的
电离
纯水和稀溶液中均适用
溶液的酸
碱性与pH
溶液酸碱性关键看H+和OH-浓度的大小关系
1.水的电离过程为H2O
H+
+
OH-,在不同温度下其离
子积为KW25℃=1×10-14,KW35℃
=2.1×10-14。则下列叙述正
确的是(
)
A.c(H+)随着温度的升高而降低
B.在35℃时,纯水中
c(H+)>c(OH-)
C.水的电离常数KW25℃
>KW35℃
D.水的电离是一个吸热过程
D
2.判断正误
(1)任何水溶液中都存在水的电离平衡。(
)
(2)任何水溶液中(不论酸、碱或中性)都存在Kw=10-14。(
)
(3)某温度下,某液体c(H+)=10-7mol/L,则该溶液一定是纯
水。(
)
√
×
×
3.常温下,浓度为1×10-5
mol/L的盐酸溶液中,由水电离产生的c(H+)是多少?
解:
酸溶液中Kw
=
c(H+)酸·c(OH-)水
c(OH-)水=
c(H+)水
=
Kw
c(H+)酸
=
1×10-9
mol/L
1×10-14
1×10-5
=
mol/L
4.常温下,浓度为1×10-5
mol/L的NaOH溶液中,由水电离产生的c(OH-)是多少?
解:
碱溶液中Kw
=
c(H+)水·c(OH-)碱
c(OH-)水=
c(H+)水
=
Kw
c(OH-)碱
=1×10-9
mol/L
=
1×10-14
1×10-5
mol/L
克服畏惧、建立自信的方法,就是去做你害怕的事,直到你获得成功的经验。
水乃生命之源,你对水又了解多少呢?
第二节
水的电离和溶液的酸碱性
第1课时
水的电离
溶液的酸碱性与pH
1.了解水的电离和影响水的电离的条件。
2.掌握水的离子积。
3.明确溶液酸碱性产生的原因,能正确判断溶液的酸碱性。
如图,是一个电解水的装置。在做这个实验时往往在水中加入几滴稀硫酸,以增强水的导电性。难道纯水真的不导电吗?
实验证明,水是一种弱电解质,能够发生电离。
在纯水及任何稀溶液中,都存在:
2H2O
H3O++OH-
可简写为:H2O
H+
+
OH-
平衡常数:K电离
=
c(H+)×c(OH-)
c(H2O)
即
KW=
c(H+)×c(OH-)
Kw
100℃
50℃
25℃
20℃
0℃
温度
1.14×10-15
6.81×10-15
1×10-14
5.47×10-14
1×10-12
由表格中的数据,分析其中的规律,并解析。
1升纯水的物质的量是55.6
mol,经实验测得25
℃时,发生电离的水只有1×10-7
mol,二者相比,水电离的部分太小,可以忽略不计。因此电离前后水的物质的量几乎不变,可以视为常数,常数乘以常数必然为一个新的常数,用
表示,即为水的离子积常数,简称水的离子积。
KW
升高温度,促进水的电离,Kw增大。
Kw只与温度有关,与浓度无关。
温度越高,Kw越大。
水的电离是吸热过程。
室温下55.6
mol
H2O中
有1×10-7
mol
H2O电离,
因此c(H2O)可视为常数。
Kw
=
室温下
1×10-14
⑴KW叫做水的离子积常数,简称水的离子积。
特别提示:此时的c(H+)和c(OH-)是溶液中的总量。
⑵KW只是温度的函数(与浓度无关)。
⑶水本身电离出来的c(H+)和c(OH-)是相等的,但溶液中的c(H+)和c(OH-)不一定相等。
关于Kw的理解
25℃时,在10
mL蒸馏水中c(H+)和c(OH-)
各是多少?向其中加入10
mL0.2
mol/L
盐酸,c(H+)和c(OH-)如何变化?对水的电离平衡有何影响?
c(H+)
c(OH-)
c(H+)
和
c(OH-)
大小比较
酸碱性
平衡移动
蒸馏水
加酸后
10-7
10-7
10-1
10-13
c(H+)
=
c(OH-)
中性
c(H+)
>
c(OH-)
酸性
Kw
=
加酸后
1×10-14
不变
酸溶液中Kw
=
c(H+)酸·c(OH-)水
↓
↑
25℃时,在10
mL蒸馏水中c(H+)和c(OH-)各是多少?向其中加入10
mL
0.2
mol/L
氢氧化钠溶液,c(H+)和c(OH-)如何变化?对水的电离平衡有何影响?
c(H+)
c(OH-)
c(H+)
和
c(OH-)
大小比较
酸碱性
平衡移动
蒸馏水
加碱后
10-7
10-7
10-1
10-13
c(H+)
=
c(OH-)
中性
c(H+)
<
c(OH-)
碱性
Kw
=
加碱后
1×10-14
不变
碱溶液中Kw
=
c(H+)水·c(OH-)碱
↑
↓
结论:溶液的酸碱性跟c(H+)和c(OH-)相对大小有关。
常温下
c(H+)
=
c(OH-)
c(H+)
>
c(OH-)
c(H+)
<
c(OH-)
c(H+)
=
1×10-7
mol/L
c(OH-)
=
1×10-7
mol/L
c(H+)
>1×10-7
mol/L
c(OH-)
<1×10-7mol/L
中性溶液
酸性溶液
碱性溶液
c(H+)
<1×10-7
mol/L
c(OH-)>1×10-7
mol/L
溶液的酸碱性
讨论:100℃时
KW=10-12
在100
℃
时,纯水中c(H+)为多少?
c(H+)=10-6
mol/L
c(H+)>1×10-7
mol/L是否说明100
℃
时纯水溶液呈酸性?
不是,此时的纯水仍然呈中性!
100℃
时,c(H+)=1×10-7
mol/L的溶液呈酸性还是碱性?
碱性!
c(H+)=1×10-7
mol/L,c(OH-)=1×10-5
mol/L,
c(OH-)>c(H+)
pH定义:是c(H+)的负对数,即pH=-lgc(H+)。
如:c(H+)
=
1×10-7
mol/L,
pH=-lg10-7
=7.0
c(H+)
=
1×10-5
mol/L,
pH=-lg10-5
=5.0
c(H+)
=
1×10-9
mol/L,
pH=-lg10-9
=9.0
注意:当溶液中c(H+)或c(OH-)大于1
mol时,不用pH表示溶液的酸碱性。
溶液的酸碱性与pH
pH与酸、碱性的关系?
pH
0
1
2
3
4
5
6
7
8
9
10
11
12
13
14
酸性增强
中
性
碱性增强
25℃
pH的测定
(2)pH试纸
粗略测定
(1)酸碱指示剂
甲基橙
石蕊
酚酞
酸色
碱色
红
黄
红
蓝
无
红
变色范围(pH)
3.1~4.4
5.0~8.0
8.2~10.0
了解
用法:用玻璃棒蘸取溶液,点在pH试纸中央,半分钟后与标准比色卡对比。
注意:①不能用水润湿
②要放在玻璃片(或表面皿)上
③不能将试纸伸到溶液中
④广泛pH试纸只能读出整数
精确测定——pH计(酸度计)
pH试纸的使用
水的离子积
影响因素
水的
电离
纯水和稀溶液中均适用
溶液的酸
碱性与pH
溶液酸碱性关键看H+和OH-浓度的大小关系
1.水的电离过程为H2O
H+
+
OH-,在不同温度下其离
子积为KW25℃=1×10-14,KW35℃
=2.1×10-14。则下列叙述正
确的是(
)
A.c(H+)随着温度的升高而降低
B.在35℃时,纯水中
c(H+)>c(OH-)
C.水的电离常数KW25℃
>KW35℃
D.水的电离是一个吸热过程
D
2.判断正误
(1)任何水溶液中都存在水的电离平衡。(
)
(2)任何水溶液中(不论酸、碱或中性)都存在Kw=10-14。(
)
(3)某温度下,某液体c(H+)=10-7mol/L,则该溶液一定是纯
水。(
)
√
×
×
3.常温下,浓度为1×10-5
mol/L的盐酸溶液中,由水电离产生的c(H+)是多少?
解:
酸溶液中Kw
=
c(H+)酸·c(OH-)水
c(OH-)水=
c(H+)水
=
Kw
c(H+)酸
=
1×10-9
mol/L
1×10-14
1×10-5
=
mol/L
4.常温下,浓度为1×10-5
mol/L的NaOH溶液中,由水电离产生的c(OH-)是多少?
解:
碱溶液中Kw
=
c(H+)水·c(OH-)碱
c(OH-)水=
c(H+)水
=
Kw
c(OH-)碱
=1×10-9
mol/L
=
1×10-14
1×10-5
mol/L
克服畏惧、建立自信的方法,就是去做你害怕的事,直到你获得成功的经验。
