人教化学选修4第三章第一节 弱电解质的电离第2课时 (共21张PPT)
文档属性
| 名称 | 人教化学选修4第三章第一节 弱电解质的电离第2课时 (共21张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-15 00:00:00 | ||
图片预览






文档简介
(共21张PPT)
第2课时
弱电解质的电离平衡
第一节
弱电解质的电离
第三章
水溶液中的离子平衡
本节课学习目标:
1.知道弱电解质电离平衡状态;
2.理解外界条件对电离平衡的影响;(重难点)
3.掌握电离平衡常数的含义。(难点)
【知识回顾】强弱电解质的概念
强电解质:在水溶液里全部电离成离子的电解质。如:强酸、强碱和大多数盐类。
弱电解质:在水溶液里只有一部分分子电离成离子的电解质。如
:弱酸、弱碱等。
你如何理解醋酸的“部分”电离?
假设二:醋酸电离出的离子在溶液中相互碰撞,同时存在CH3COO-和H+结合成分子的过程,使得总体只有部分电离
两种假设:
假设一:只存在一部分醋酸分子电离成离子的过程
可以进行实验验证!
弱电解质的电离是可逆的
不能相互大量共存
强电解质的电离是不可逆的
可以相互大量共存
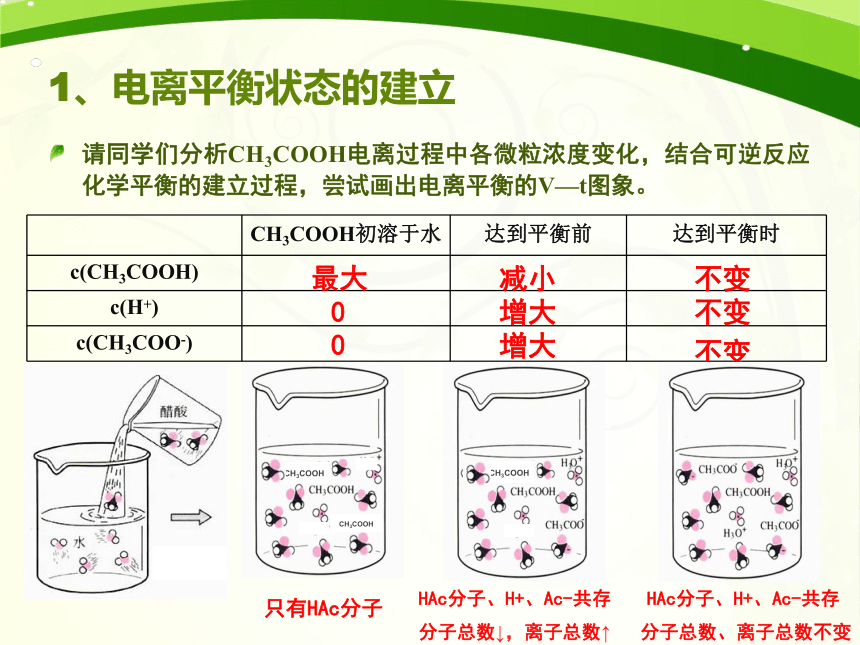
1、电离平衡状态的建立
请同学们分析CH3COOH电离过程中各微粒浓度变化,结合可逆反应化学平衡的建立过程,尝试画出电离平衡的V—t图象。
最大
0
0
只有HAc分子
HAc分子、H+、Ac-共存
分子总数↓,离子总数↑
增大
增大
减小
不变
不变
不变
HAc分子、H+、Ac-共存
分子总数、离子总数不变
CH3COOH初溶于水
达到平衡前
达到平衡时
c(CH3COOH)
c(H+)
c(CH3COO-)
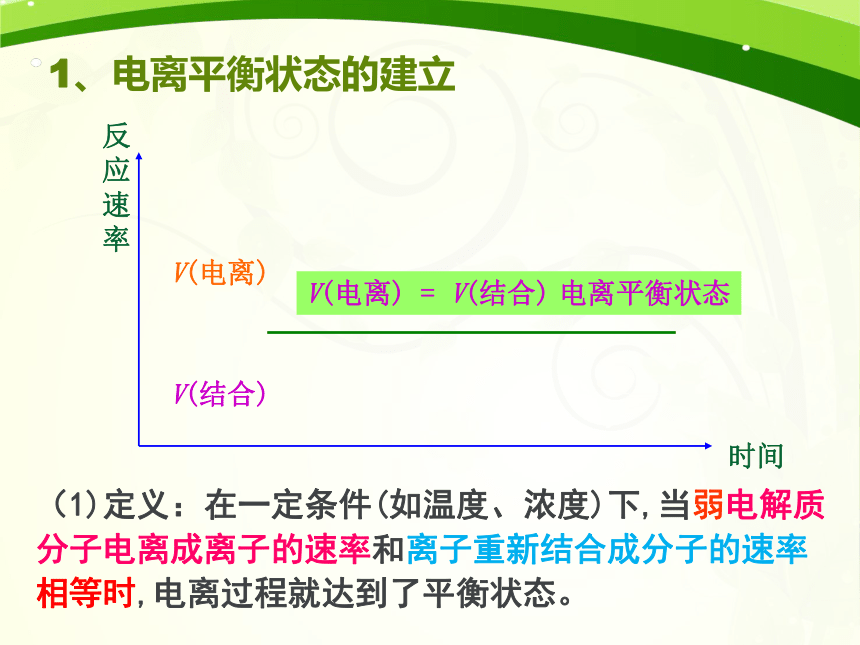
V(电离)
V(结合)
V(电离)
=
V(结合)
电离平衡状态
(1)定义:在一定条件(如温度、浓度)下,当弱电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡状态。
1、电离平衡状态的建立
(2)特点:
动
电离平衡是一种动态平衡
变
条件改变时,电离平衡发生移动。
等
V电离=V结合≠0
逆
弱电解质的电离是可逆的
1、电离平衡状态的建立
吸
弱电解质的电离过程是吸热的
【自主探究】0.1mol/L的CH3COOH溶液
CH3COOH
CH3COO-
+
H+
,△H>0
增大
增大
正
减小
减小
正
减小
增大
逆
增大
减小
逆
减小
增大
正
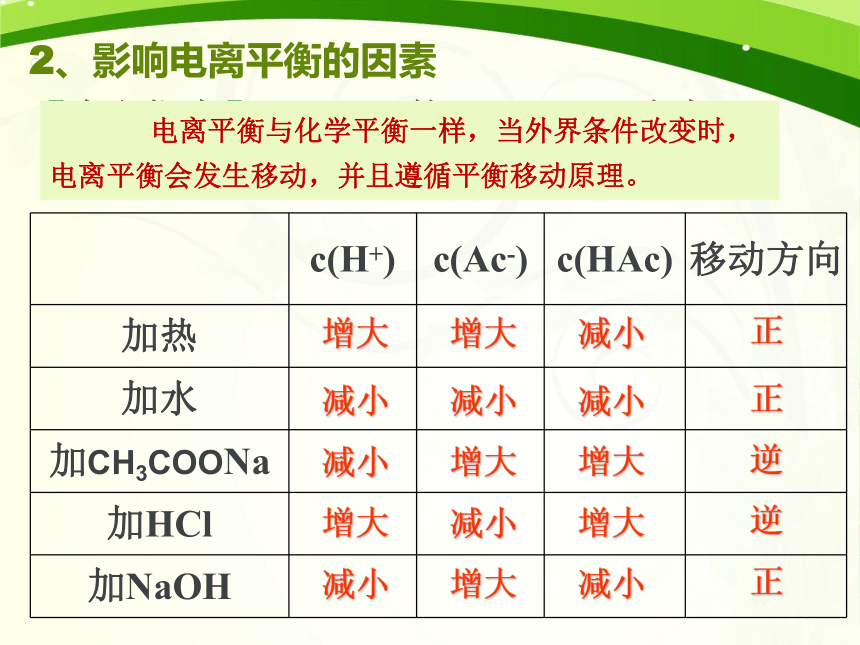
2、影响电离平衡的因素
减小
减小
增大
增大
减小
电离平衡与化学平衡一样,当外界条件改变时,电离平衡会发生移动,并且遵循平衡移动原理。
c(H+)
c(Ac-)
c(HAc)
移动方向
加热
加水
加CH3COONa
加HCl
加NaOH
2、影响电离平衡的因素
温度:
电离过程是吸热过程,温度升高,平衡向电离方向移动。
浓度:
加水稀释,电离平衡向电离方向移动
加入其他
电解质:
②外因
同离子效应:
加入与弱电解质电离出的离子相同的离子,电离平衡逆向移动。
①内因:电解质的本性。通常电解质越弱,电离程度越小。
化学反应:
消耗弱电解质的离子,电离平衡正向移动。
越热越电离,越稀越电离!
【合作探究】
利用影响电离平衡的因素,验证强、弱电解质的电离是否为可逆过程
HCl
=
H+
+
Cl-
NaCl
=
Na+
+
Cl-
CH3COONH4
=
NH4+
+
CH3COO-
实验步骤
实验现象
0.1mol/L
盐酸
+
少量氯化钠固体,
测溶液前后的pH变化
pH
_________
(变大、变小、不变)
0.1mol/L
醋酸溶液
+少量醋酸铵固体
,
测溶液前后的pH变化
pH
_________
(变大、变小、不变)
验证结果:
①强电解质(HCl)的电离是
(可逆或不可逆)。
②弱电解质(CH3COOH)的电离是
(可逆或不可逆)。
0.1mol/L醋酸+醋酸铵
0.1mol/L盐酸
0.1mol/L醋酸
0.1mol/L盐酸+氯化钠
【合作探究】
利用影响电离平衡的因素,验证强、弱电解质的电离是否为可逆过程
HCl
=
H+
+
Cl-
NaCl
=
Na+
+
Cl-
CH3COONH4
=
NH4+
+
CH3COO-
不变
变大
不可逆
可逆
实验步骤
实验现象
0.1mol/L
盐酸
+
少量氯化钠固体,
测溶液前后的pH变化
pH
_________
(变大、变小、不变)
0.1mol/L
醋酸溶液
+少量醋酸铵固体
,
测溶液前后的pH变化
pH
_________
(变大、变小、不变)
验证结果:
①强电解质(HCl)的电离是
(可逆或不可逆)。
②弱电解质(CH3COOH)的电离是
(可逆或不可逆)。
CH3COOH:
3、电离常数——度量电离程度的大小
平衡时
NH3·H2O:
平衡时
与化学平衡类似,电离平衡的平衡常数,叫做电离平衡常数,简称电离常数。
参照化学平衡常数表达式的写法,写出下列物质的电离常数表达式:
Ka=
Kb=
电离常数的影响因素
与化学平衡常数类似,电离常数只与____________和_____有关。由于电离过程是_____的,同一弱电解质,温度越高,电离常数越____。
弱电解质本身
温度
吸热
大
根据实验现象,你能否推测醋酸、硼酸、碳酸三种弱酸的相对强弱,及其与电离常数大小的关系?
【自主探究3】
向两支分别盛有1mol/L
CH3COOH溶液和饱和硼酸溶液的试管中滴加1mol/L的Na2CO3溶液,观察现象。
你认为三种酸的酸性强弱大小为:
__________>
___________>__________
你认为三种酸的电离常数大小为:
__________>
___________>__________
【自主探究3】
Ka(醋酸)=1.75×10-5
mol·L-1
Ka(碳酸)=4.4×10-7
mol·L-1(第一步电离)
Ka(硼酸)=5.8×10-10
mol·L-1
向两支分别盛有0.1mol/L
CH3COOH溶液和饱和硼酸溶液的试管中滴加等浓度的Na2CO3溶液,观察现象。
实验现象:醋酸能与Na2CO3溶液反应,放出CO2气体,而硼酸不能。
酸性:醋酸>碳酸>硼酸
电离常数的意义:
K值越大,电离程度越大,
相应弱酸
/弱碱的酸/碱性越强。
H3PO4在水溶液中的电离方程式。
H3PO4
H+
+
H2PO4-
H2PO4-
H+
+
HPO42-
HPO42-
H+
+
PO43-
请你推测每一步的电离程度如何变化,为什么?
上一级电离产生的H+对下一级电离有抑制作用
多元弱酸是分步电离的,K1>>K2
>>
K3
多元弱酸的酸性由第一步电离决定。
K1=7.1
×10-3
K2=6.3
×10-8
K3=4.2
×10-13
试根据课本p42中“一些弱酸和弱碱的电离平衡常数”比较它们的相对强弱。
酸性:草酸>磷酸>柠檬酸>碳酸
【学以致用】
温度
浓度
其它
影响因素
电离平衡
电离常数
欢迎各位老师给予指正与建议!
本节内容到此结束
第2课时
弱电解质的电离平衡
第一节
弱电解质的电离
第三章
水溶液中的离子平衡
本节课学习目标:
1.知道弱电解质电离平衡状态;
2.理解外界条件对电离平衡的影响;(重难点)
3.掌握电离平衡常数的含义。(难点)
【知识回顾】强弱电解质的概念
强电解质:在水溶液里全部电离成离子的电解质。如:强酸、强碱和大多数盐类。
弱电解质:在水溶液里只有一部分分子电离成离子的电解质。如
:弱酸、弱碱等。
你如何理解醋酸的“部分”电离?
假设二:醋酸电离出的离子在溶液中相互碰撞,同时存在CH3COO-和H+结合成分子的过程,使得总体只有部分电离
两种假设:
假设一:只存在一部分醋酸分子电离成离子的过程
可以进行实验验证!
弱电解质的电离是可逆的
不能相互大量共存
强电解质的电离是不可逆的
可以相互大量共存
1、电离平衡状态的建立
请同学们分析CH3COOH电离过程中各微粒浓度变化,结合可逆反应化学平衡的建立过程,尝试画出电离平衡的V—t图象。
最大
0
0
只有HAc分子
HAc分子、H+、Ac-共存
分子总数↓,离子总数↑
增大
增大
减小
不变
不变
不变
HAc分子、H+、Ac-共存
分子总数、离子总数不变
CH3COOH初溶于水
达到平衡前
达到平衡时
c(CH3COOH)
c(H+)
c(CH3COO-)
V(电离)
V(结合)
V(电离)
=
V(结合)
电离平衡状态
(1)定义:在一定条件(如温度、浓度)下,当弱电解质分子电离成离子的速率和离子重新结合成分子的速率相等时,电离过程就达到了平衡状态。
1、电离平衡状态的建立
(2)特点:
动
电离平衡是一种动态平衡
变
条件改变时,电离平衡发生移动。
等
V电离=V结合≠0
逆
弱电解质的电离是可逆的
1、电离平衡状态的建立
吸
弱电解质的电离过程是吸热的
【自主探究】0.1mol/L的CH3COOH溶液
CH3COOH
CH3COO-
+
H+
,△H>0
增大
增大
正
减小
减小
正
减小
增大
逆
增大
减小
逆
减小
增大
正
2、影响电离平衡的因素
减小
减小
增大
增大
减小
电离平衡与化学平衡一样,当外界条件改变时,电离平衡会发生移动,并且遵循平衡移动原理。
c(H+)
c(Ac-)
c(HAc)
移动方向
加热
加水
加CH3COONa
加HCl
加NaOH
2、影响电离平衡的因素
温度:
电离过程是吸热过程,温度升高,平衡向电离方向移动。
浓度:
加水稀释,电离平衡向电离方向移动
加入其他
电解质:
②外因
同离子效应:
加入与弱电解质电离出的离子相同的离子,电离平衡逆向移动。
①内因:电解质的本性。通常电解质越弱,电离程度越小。
化学反应:
消耗弱电解质的离子,电离平衡正向移动。
越热越电离,越稀越电离!
【合作探究】
利用影响电离平衡的因素,验证强、弱电解质的电离是否为可逆过程
HCl
=
H+
+
Cl-
NaCl
=
Na+
+
Cl-
CH3COONH4
=
NH4+
+
CH3COO-
实验步骤
实验现象
0.1mol/L
盐酸
+
少量氯化钠固体,
测溶液前后的pH变化
pH
_________
(变大、变小、不变)
0.1mol/L
醋酸溶液
+少量醋酸铵固体
,
测溶液前后的pH变化
pH
_________
(变大、变小、不变)
验证结果:
①强电解质(HCl)的电离是
(可逆或不可逆)。
②弱电解质(CH3COOH)的电离是
(可逆或不可逆)。
0.1mol/L醋酸+醋酸铵
0.1mol/L盐酸
0.1mol/L醋酸
0.1mol/L盐酸+氯化钠
【合作探究】
利用影响电离平衡的因素,验证强、弱电解质的电离是否为可逆过程
HCl
=
H+
+
Cl-
NaCl
=
Na+
+
Cl-
CH3COONH4
=
NH4+
+
CH3COO-
不变
变大
不可逆
可逆
实验步骤
实验现象
0.1mol/L
盐酸
+
少量氯化钠固体,
测溶液前后的pH变化
pH
_________
(变大、变小、不变)
0.1mol/L
醋酸溶液
+少量醋酸铵固体
,
测溶液前后的pH变化
pH
_________
(变大、变小、不变)
验证结果:
①强电解质(HCl)的电离是
(可逆或不可逆)。
②弱电解质(CH3COOH)的电离是
(可逆或不可逆)。
CH3COOH:
3、电离常数——度量电离程度的大小
平衡时
NH3·H2O:
平衡时
与化学平衡类似,电离平衡的平衡常数,叫做电离平衡常数,简称电离常数。
参照化学平衡常数表达式的写法,写出下列物质的电离常数表达式:
Ka=
Kb=
电离常数的影响因素
与化学平衡常数类似,电离常数只与____________和_____有关。由于电离过程是_____的,同一弱电解质,温度越高,电离常数越____。
弱电解质本身
温度
吸热
大
根据实验现象,你能否推测醋酸、硼酸、碳酸三种弱酸的相对强弱,及其与电离常数大小的关系?
【自主探究3】
向两支分别盛有1mol/L
CH3COOH溶液和饱和硼酸溶液的试管中滴加1mol/L的Na2CO3溶液,观察现象。
你认为三种酸的酸性强弱大小为:
__________>
___________>__________
你认为三种酸的电离常数大小为:
__________>
___________>__________
【自主探究3】
Ka(醋酸)=1.75×10-5
mol·L-1
Ka(碳酸)=4.4×10-7
mol·L-1(第一步电离)
Ka(硼酸)=5.8×10-10
mol·L-1
向两支分别盛有0.1mol/L
CH3COOH溶液和饱和硼酸溶液的试管中滴加等浓度的Na2CO3溶液,观察现象。
实验现象:醋酸能与Na2CO3溶液反应,放出CO2气体,而硼酸不能。
酸性:醋酸>碳酸>硼酸
电离常数的意义:
K值越大,电离程度越大,
相应弱酸
/弱碱的酸/碱性越强。
H3PO4在水溶液中的电离方程式。
H3PO4
H+
+
H2PO4-
H2PO4-
H+
+
HPO42-
HPO42-
H+
+
PO43-
请你推测每一步的电离程度如何变化,为什么?
上一级电离产生的H+对下一级电离有抑制作用
多元弱酸是分步电离的,K1>>K2
>>
K3
多元弱酸的酸性由第一步电离决定。
K1=7.1
×10-3
K2=6.3
×10-8
K3=4.2
×10-13
试根据课本p42中“一些弱酸和弱碱的电离平衡常数”比较它们的相对强弱。
酸性:草酸>磷酸>柠檬酸>碳酸
【学以致用】
温度
浓度
其它
影响因素
电离平衡
电离常数
欢迎各位老师给予指正与建议!
本节内容到此结束
