人教化学选修4第三章 第三节 盐类的水解第3课时(共22张PPT)
文档属性
| 名称 | 人教化学选修4第三章 第三节 盐类的水解第3课时(共22张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-11 22:08:50 | ||
图片预览








文档简介
(共22张PPT)
盐类的水解
人教版高中化学选修4
第三章
第三节
1.纯水中有哪些微粒?
2.纯水中c(H+)
c(OH-),
所以纯水显
性。常温下,
纯水的PH=
。
中
7
=
精密pH试纸
呈弱碱性
【分组探究】
用pH试纸按顺序测定下列盐溶液的酸碱性:
NaCl、Na2CO3、NaHCO3、NH4Cl、Na2SO4、CH3COONa、(NH4)2SO4
温馨提示:
1.将pH试纸放在点滴板上,
2.用试剂瓶上的小滴管滴1滴溶液在试纸中部,
3.约20s后pH试纸颜色与标准比色卡对比,判
断溶液酸碱性。
探究盐溶液的酸碱性
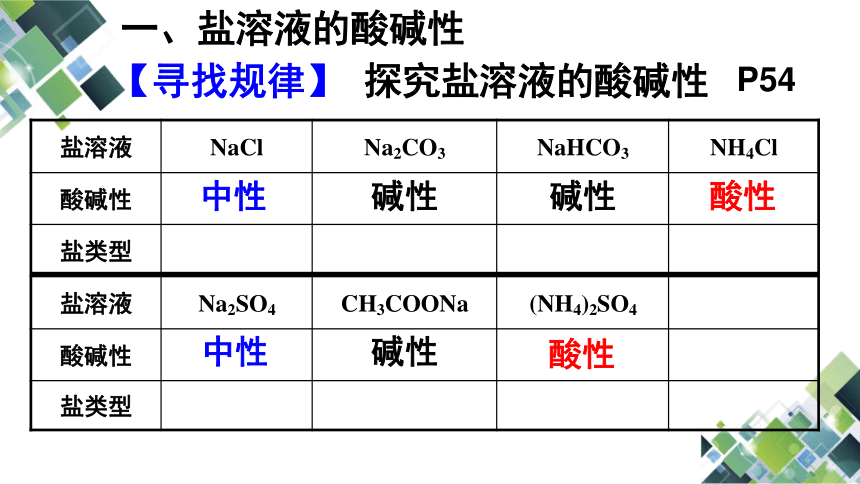
中性
碱性
碱性
酸性
中性
碱性
酸性
P54
【寻找规律】
一、盐溶液的酸碱性
盐溶液
NaCl
Na2CO3
NaHCO3
NH4Cl
酸碱性
盐类型
盐溶液
Na2SO4
CH3COONa
(NH4)2SO4
酸碱性
盐类型
酸
+
碱
=
盐
+
水
(中和反应)
强酸
强碱
弱酸
弱碱
强酸弱碱盐
强碱弱酸盐
强酸强碱盐
弱酸弱碱盐
探究盐溶液的酸碱性
中性
碱性
碱性
酸性
中性
碱性
酸性
强酸强碱盐
强碱弱酸盐
强碱弱酸盐
强酸弱碱盐
强酸强碱盐
强碱弱酸盐
强酸弱碱盐
P54
【寻找规律】
一、盐溶液的酸碱性
盐溶液
NaCl
Na2CO3
NaHCO3
NH4Cl
酸碱性
盐类型
盐溶液
Na2SO4
CH3COONa
(NH4)2SO4
酸碱性
盐类型
一、盐溶液的酸碱性
【探究1】
强酸弱碱盐:
NH4Cl溶液
一、盐溶液的酸碱性
【探究1】
强酸弱碱盐:
NH4Cl溶液
正移,促进水的电离
c(H+)
c(OH–)
酸性
Cl–、NH4+、H+、OH–、H2O、NH3
·
H2O
NH3
·
H2O
>
NH4Cl
+
H2O
?
NH3
·
H2O
+
HCl
NH4+
+
H2O
?
NH3
·
H2O
+
H+
H2O
?
H+
+
OH–
NH4Cl
=
Cl–
+
NH4+
+
?
NH3
·
H2O
⑴
电离方程式
⑵有无弱电解质生成
⑶盐溶液中存在哪些粒子
⑷水的电离平衡移动方向
⑸c(H+)和c(OH–)相对大小
⑹相关化学反应方程式
一、盐溶液的酸碱性
【探究2】
强碱弱酸盐:CH3COONa溶液
正移,促进水的电离
c(H+)
c(OH–)
<
碱性
Na+、CH3COO–、OH–、H+、H2O、CH3COOH
CH3COONa
+
H2O
?
CH3COOH
+
NaOH
CH3COO–
+
H2O
?
CH3COOH
+
OH–
CH3COOH
CH3COONa
=
Na+
+
CH3COO–
+
CH3COOH
?
⑴
电离方程式
⑵有无弱电解质生成
⑶盐溶液中存在哪些微粒
⑷水的电离平衡移动方向
⑸c(H+)和c(OH–)相对大小
⑹相关反应方程式
一、盐溶液的酸碱性
【探究3】
强酸强碱盐:
NaCl溶液
不移,对水的电离平衡无影响
c(H+)
c(OH–)
中性
无
=
H2O
?
H+
+
OH–
NaCl
=
Cl–
+
Na+
Na+、Cl–、H+、OH–、H2O
无
⑴
电离方程式
⑵有无弱电解质生成
⑶盐溶液中存在哪些微粒
⑷水的电离平衡移动方向
⑸c(H+)和c(OH–)相对大小
⑹相关反应方程式
二、盐类的水解
在溶液中盐电离出来的弱离子跟水电离出来的H+或OH–结合生成弱电解质的反应。
1.概念:
弱酸阴离子或
弱碱阳离子
弱酸或弱碱
盐易溶,有弱离子
2.
条件:
3.
实质:
使
c
(H+)
≠
c
(OH–)
生成弱电解质(促进水电离)
二、盐类的水解
盐
+
水
?
酸
+
碱
4.
特点:
⑴
可逆
⑵
吸热
⑶
微弱
中和
水解
有
才水解;
无
不水解;
5.规律:
谁
显谁性;
同强显
性。
弱
弱
强
中
【学以致用】
K+、Na+、Ca2+
强碱弱酸盐
SiO32-
水解显碱性
Na2CO3
强碱弱酸盐
【学以致用】
水解显碱性
多元弱酸阴离子分步水解。
CO3
2-
+H2O
?
HCO3-
+
OH-(主要)
HCO3-
+
H2O
?H2CO3+OH-
Na2CO3=
CO32-
+
2Na+
KAl(SO4)2·12H2O
Al3+
+
3H2O
?
Al(OH)3(胶体)+
3H+
明矾
净水前
净水后
【学以致用】
多元弱碱阳离子的水解一步完成。
=K+
+
Al3+
+
2SO42-
+
12H2O
【课堂小结】
一、盐溶液的酸碱性
二、盐类的水解
1.概念:
2.条件:
3.实质:
4.特点:
5.规律:
在溶液中盐电离出来的弱离子跟水电离出来
H+或OH–结合生成弱电解质的反应
盐易溶,有弱离子
生成弱电解质(促进水电离)
⑴
可逆
⑵
吸热
⑶
微弱
有
才水解;
无
不水解;
谁
显谁性;
同强显
性。
弱
弱
强
中
【随堂演练】
1.水中加入下列溶液对水的电离平衡不产生影响的是(
)
A.Na2S溶液
B.KF溶液
C.FeCl3溶液
D.NaI溶液
D
下列盐的水溶液中,哪些呈酸性(
)
哪些呈碱性(
)
①
FeCl3
②
NaClO
③
(NH4)2SO4
④
AgNO3
⑤
Na2S
⑥
K2SO4
①③④
②⑤
【随堂演练】
3.
用“<”“>”“=”填空
0.1mol/L的CH3COONa溶液中c
(CH3COO-)
0.1mol/L
1mol/L的Na2S溶液中,
c
(Na+)
2c
(S2-)
<
>
【作业布置】
基础作业:
课本P59习题1、5。
提升作业:
比较常温下pH=10的NaOH溶液和pH=10
的
CH3COONa溶液中水的电离度大小。
拓展作业:
查阅相关资料,解释泡沫灭火器的工作原理。
盐类的水解
人教版高中化学选修4
第三章
第三节
1.纯水中有哪些微粒?
2.纯水中c(H+)
c(OH-),
所以纯水显
性。常温下,
纯水的PH=
。
中
7
=
精密pH试纸
呈弱碱性
【分组探究】
用pH试纸按顺序测定下列盐溶液的酸碱性:
NaCl、Na2CO3、NaHCO3、NH4Cl、Na2SO4、CH3COONa、(NH4)2SO4
温馨提示:
1.将pH试纸放在点滴板上,
2.用试剂瓶上的小滴管滴1滴溶液在试纸中部,
3.约20s后pH试纸颜色与标准比色卡对比,判
断溶液酸碱性。
探究盐溶液的酸碱性
中性
碱性
碱性
酸性
中性
碱性
酸性
P54
【寻找规律】
一、盐溶液的酸碱性
盐溶液
NaCl
Na2CO3
NaHCO3
NH4Cl
酸碱性
盐类型
盐溶液
Na2SO4
CH3COONa
(NH4)2SO4
酸碱性
盐类型
酸
+
碱
=
盐
+
水
(中和反应)
强酸
强碱
弱酸
弱碱
强酸弱碱盐
强碱弱酸盐
强酸强碱盐
弱酸弱碱盐
探究盐溶液的酸碱性
中性
碱性
碱性
酸性
中性
碱性
酸性
强酸强碱盐
强碱弱酸盐
强碱弱酸盐
强酸弱碱盐
强酸强碱盐
强碱弱酸盐
强酸弱碱盐
P54
【寻找规律】
一、盐溶液的酸碱性
盐溶液
NaCl
Na2CO3
NaHCO3
NH4Cl
酸碱性
盐类型
盐溶液
Na2SO4
CH3COONa
(NH4)2SO4
酸碱性
盐类型
一、盐溶液的酸碱性
【探究1】
强酸弱碱盐:
NH4Cl溶液
一、盐溶液的酸碱性
【探究1】
强酸弱碱盐:
NH4Cl溶液
正移,促进水的电离
c(H+)
c(OH–)
酸性
Cl–、NH4+、H+、OH–、H2O、NH3
·
H2O
NH3
·
H2O
>
NH4Cl
+
H2O
?
NH3
·
H2O
+
HCl
NH4+
+
H2O
?
NH3
·
H2O
+
H+
H2O
?
H+
+
OH–
NH4Cl
=
Cl–
+
NH4+
+
?
NH3
·
H2O
⑴
电离方程式
⑵有无弱电解质生成
⑶盐溶液中存在哪些粒子
⑷水的电离平衡移动方向
⑸c(H+)和c(OH–)相对大小
⑹相关化学反应方程式
一、盐溶液的酸碱性
【探究2】
强碱弱酸盐:CH3COONa溶液
正移,促进水的电离
c(H+)
c(OH–)
<
碱性
Na+、CH3COO–、OH–、H+、H2O、CH3COOH
CH3COONa
+
H2O
?
CH3COOH
+
NaOH
CH3COO–
+
H2O
?
CH3COOH
+
OH–
CH3COOH
CH3COONa
=
Na+
+
CH3COO–
+
CH3COOH
?
⑴
电离方程式
⑵有无弱电解质生成
⑶盐溶液中存在哪些微粒
⑷水的电离平衡移动方向
⑸c(H+)和c(OH–)相对大小
⑹相关反应方程式
一、盐溶液的酸碱性
【探究3】
强酸强碱盐:
NaCl溶液
不移,对水的电离平衡无影响
c(H+)
c(OH–)
中性
无
=
H2O
?
H+
+
OH–
NaCl
=
Cl–
+
Na+
Na+、Cl–、H+、OH–、H2O
无
⑴
电离方程式
⑵有无弱电解质生成
⑶盐溶液中存在哪些微粒
⑷水的电离平衡移动方向
⑸c(H+)和c(OH–)相对大小
⑹相关反应方程式
二、盐类的水解
在溶液中盐电离出来的弱离子跟水电离出来的H+或OH–结合生成弱电解质的反应。
1.概念:
弱酸阴离子或
弱碱阳离子
弱酸或弱碱
盐易溶,有弱离子
2.
条件:
3.
实质:
使
c
(H+)
≠
c
(OH–)
生成弱电解质(促进水电离)
二、盐类的水解
盐
+
水
?
酸
+
碱
4.
特点:
⑴
可逆
⑵
吸热
⑶
微弱
中和
水解
有
才水解;
无
不水解;
5.规律:
谁
显谁性;
同强显
性。
弱
弱
强
中
【学以致用】
K+、Na+、Ca2+
强碱弱酸盐
SiO32-
水解显碱性
Na2CO3
强碱弱酸盐
【学以致用】
水解显碱性
多元弱酸阴离子分步水解。
CO3
2-
+H2O
?
HCO3-
+
OH-(主要)
HCO3-
+
H2O
?H2CO3+OH-
Na2CO3=
CO32-
+
2Na+
KAl(SO4)2·12H2O
Al3+
+
3H2O
?
Al(OH)3(胶体)+
3H+
明矾
净水前
净水后
【学以致用】
多元弱碱阳离子的水解一步完成。
=K+
+
Al3+
+
2SO42-
+
12H2O
【课堂小结】
一、盐溶液的酸碱性
二、盐类的水解
1.概念:
2.条件:
3.实质:
4.特点:
5.规律:
在溶液中盐电离出来的弱离子跟水电离出来
H+或OH–结合生成弱电解质的反应
盐易溶,有弱离子
生成弱电解质(促进水电离)
⑴
可逆
⑵
吸热
⑶
微弱
有
才水解;
无
不水解;
谁
显谁性;
同强显
性。
弱
弱
强
中
【随堂演练】
1.水中加入下列溶液对水的电离平衡不产生影响的是(
)
A.Na2S溶液
B.KF溶液
C.FeCl3溶液
D.NaI溶液
D
下列盐的水溶液中,哪些呈酸性(
)
哪些呈碱性(
)
①
FeCl3
②
NaClO
③
(NH4)2SO4
④
AgNO3
⑤
Na2S
⑥
K2SO4
①③④
②⑤
【随堂演练】
3.
用“<”“>”“=”填空
0.1mol/L的CH3COONa溶液中c
(CH3COO-)
0.1mol/L
1mol/L的Na2S溶液中,
c
(Na+)
2c
(S2-)
<
>
【作业布置】
基础作业:
课本P59习题1、5。
提升作业:
比较常温下pH=10的NaOH溶液和pH=10
的
CH3COONa溶液中水的电离度大小。
拓展作业:
查阅相关资料,解释泡沫灭火器的工作原理。
