人教化学选修4第三章 第一节 弱电解质的电离第一课时(共21张PPT)
文档属性
| 名称 | 人教化学选修4第三章 第一节 弱电解质的电离第一课时(共21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 769.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-11 21:52:12 | ||
图片预览





文档简介
(共21张PPT)
第三章
水溶液中的离子平衡
第一节
弱电解质的电离
(第一课时)
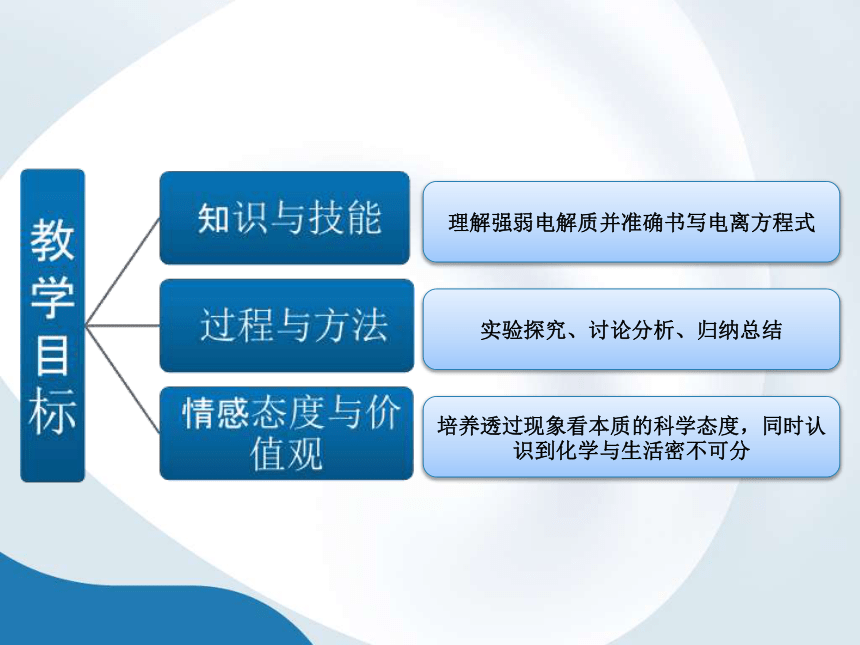
理解强弱电解质并准确书写电离方程式
实验探究、讨论分析、归纳总结
培养透过现象看本质的科学态度,同时认识到化学与生活密不可分
知识回顾
在水溶液或熔融状态下能够导电的化合物
在水溶液和熔融状态下都不能导电的化合物
均为化合物
本身能电离
本身不能电离
酸、碱、盐、水、活泼金属氧化物等
非金属氧化物、大多数有机物、某些气态氢化物等
离子化合物、共价化合物
共价化合物
电解质
非电解质
定义
相同点
不同点
包含的物质种类
化合物类型
现有以下物质:
①NaCl晶体②SO2③液态HCl④汞⑤固体
BaSO4
⑥蔗糖溶液⑦酒精(C2H5OH)⑧熔化的KNO3
⑨NH3
请回答下列问题。(填相应序号)
(1)以上物质能导电的是______________________
(2)以上物质属于电解质的是______________________
(3)以上物质属于非电解质的是______________________
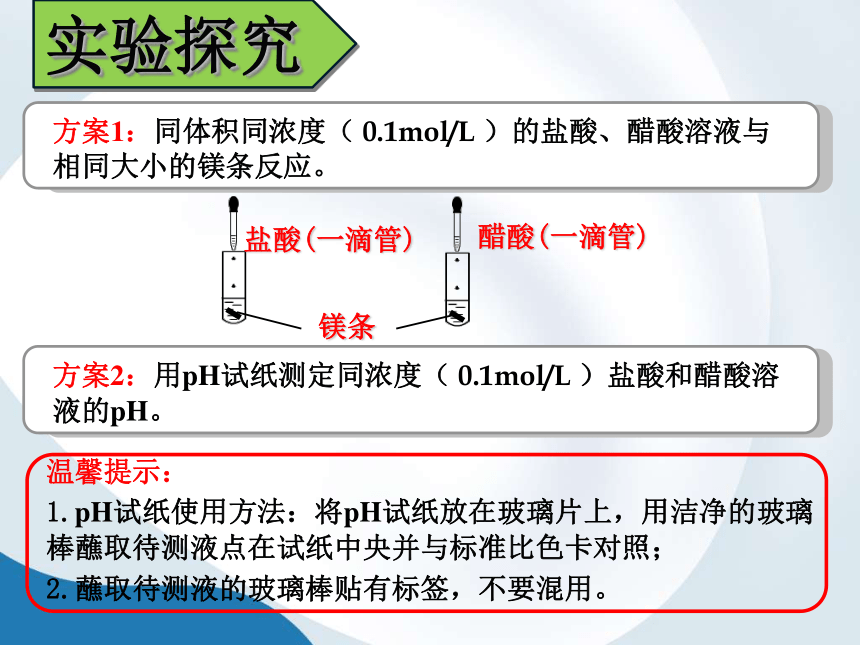
实验探究
实验现象:
实验讨论:
(1)镁条和盐酸的反应的实质是什么?
(2)当盐酸溶液和醋酸溶液的物质的量浓度相
等时,溶液中的H+
浓度是否相等?怎么判断?
实验结论:
盐酸和醋酸电离程度不同
0.1mol/L
HCl
0.1
mol/L
CH3COOH
溶液pH大小
与镁条反应
盐酸溶液
醋酸溶液
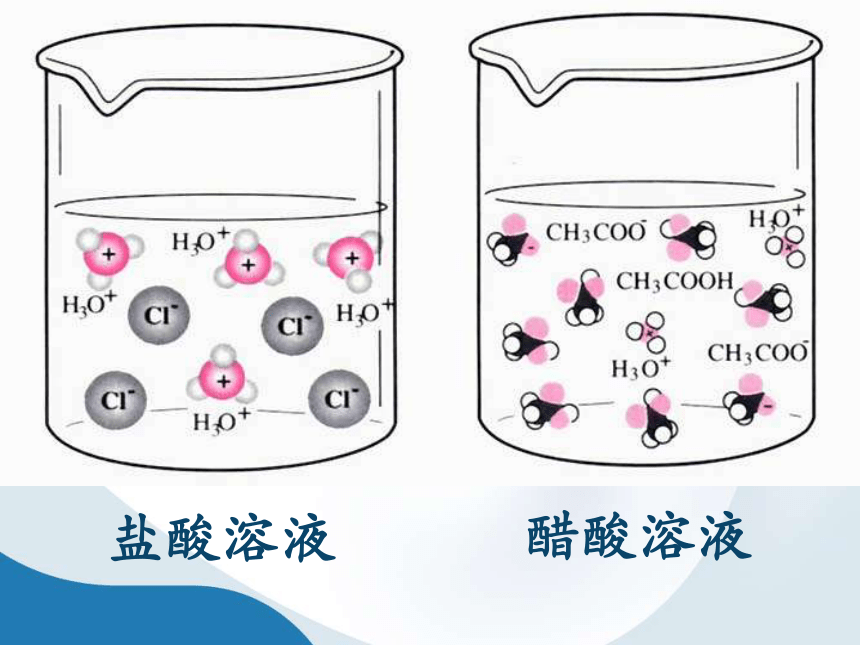
H3O+
Cl-
H3O+
H3O+
Cl-
Cl-
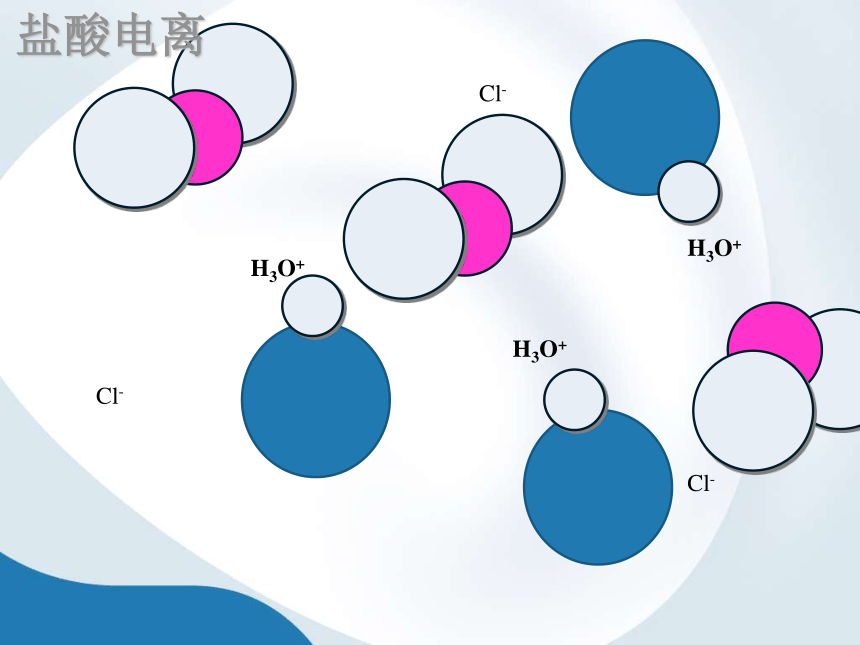
盐酸电离
CH3COO-
CH3COOH
H3O+
H3O+
CH3COO-
H2O
醋酸电离
盐酸中存在H+、Cl-
无HCl分子
醋酸溶液中存在
H+、CH3COO-
和CH3COOH分子
在水中全部电离的电解质
在水中部分电离的电解质
强酸、强碱、大多数盐、活泼金属氧化物
弱酸、弱碱、水、
两性氢氧化物
均为电解质
全部电离
部分电离
不可逆
可逆
阴阳离子
阴阳离子、电解质分子
讲授新知
一、强弱电解质
HCl、H2SO4、HNO3、HI、HBr、HClO4
KOH、NaOH、
Ca(OH)2、Ba(OH)2
强电解质
弱电解质
概念
包含物质种类
相同点
不同点
电离程度
电离过程
粒子存在形式
二、电离方程式
1.强电解质:
HCl
NaOH
Na2SO4
用“=”表示。
2.弱电解质:
CH3COOH
NH3·H2O
H2O
注意:多元弱酸分步写,多元弱碱一步写。
H2CO3
Fe(OH)3
用“
”表示。
3.酸式盐
a.强酸的酸式盐:
NaHSO4
b.弱酸的酸式盐:
水中
熔融
一步完全电离。
第一步全部电离,第二步弱酸根部分电离。
NaHCO3
?强等于,弱可逆。多元弱酸分步写,多元弱碱一步写
?电荷守恒和原子个数守恒
书写技巧
巩固训练
【训练1】写出下列电解质在水中的电离方程式:
H2SO4
__________________________________
HI
_____________________________________
H2S
____________________________________
HClO
__________________________________
NaHSO3
________________________________
Cu(OH)2
________________________________
【训练2】关于强弱电解质及非电解质的组合完全
正确的是( )
A
B
C
D
强电解质
NaCl
H2SO4
CaCO3
HNO3
弱电解质
HF
BaSO4
HClO
HI
非电解质
Cl2
NH3
C2H5OH
SO2
课堂小结
1.弱电解质的电离存在电离平衡吗?
2.若存在,试着分析哪些条件的改变会使电离平衡发生移动?
课后思考
第三章
水溶液中的离子平衡
第一节
弱电解质的电离
(第一课时)
理解强弱电解质并准确书写电离方程式
实验探究、讨论分析、归纳总结
培养透过现象看本质的科学态度,同时认识到化学与生活密不可分
知识回顾
在水溶液或熔融状态下能够导电的化合物
在水溶液和熔融状态下都不能导电的化合物
均为化合物
本身能电离
本身不能电离
酸、碱、盐、水、活泼金属氧化物等
非金属氧化物、大多数有机物、某些气态氢化物等
离子化合物、共价化合物
共价化合物
电解质
非电解质
定义
相同点
不同点
包含的物质种类
化合物类型
现有以下物质:
①NaCl晶体②SO2③液态HCl④汞⑤固体
BaSO4
⑥蔗糖溶液⑦酒精(C2H5OH)⑧熔化的KNO3
⑨NH3
请回答下列问题。(填相应序号)
(1)以上物质能导电的是______________________
(2)以上物质属于电解质的是______________________
(3)以上物质属于非电解质的是______________________
实验探究
实验现象:
实验讨论:
(1)镁条和盐酸的反应的实质是什么?
(2)当盐酸溶液和醋酸溶液的物质的量浓度相
等时,溶液中的H+
浓度是否相等?怎么判断?
实验结论:
盐酸和醋酸电离程度不同
0.1mol/L
HCl
0.1
mol/L
CH3COOH
溶液pH大小
与镁条反应
盐酸溶液
醋酸溶液
H3O+
Cl-
H3O+
H3O+
Cl-
Cl-
盐酸电离
CH3COO-
CH3COOH
H3O+
H3O+
CH3COO-
H2O
醋酸电离
盐酸中存在H+、Cl-
无HCl分子
醋酸溶液中存在
H+、CH3COO-
和CH3COOH分子
在水中全部电离的电解质
在水中部分电离的电解质
强酸、强碱、大多数盐、活泼金属氧化物
弱酸、弱碱、水、
两性氢氧化物
均为电解质
全部电离
部分电离
不可逆
可逆
阴阳离子
阴阳离子、电解质分子
讲授新知
一、强弱电解质
HCl、H2SO4、HNO3、HI、HBr、HClO4
KOH、NaOH、
Ca(OH)2、Ba(OH)2
强电解质
弱电解质
概念
包含物质种类
相同点
不同点
电离程度
电离过程
粒子存在形式
二、电离方程式
1.强电解质:
HCl
NaOH
Na2SO4
用“=”表示。
2.弱电解质:
CH3COOH
NH3·H2O
H2O
注意:多元弱酸分步写,多元弱碱一步写。
H2CO3
Fe(OH)3
用“
”表示。
3.酸式盐
a.强酸的酸式盐:
NaHSO4
b.弱酸的酸式盐:
水中
熔融
一步完全电离。
第一步全部电离,第二步弱酸根部分电离。
NaHCO3
?强等于,弱可逆。多元弱酸分步写,多元弱碱一步写
?电荷守恒和原子个数守恒
书写技巧
巩固训练
【训练1】写出下列电解质在水中的电离方程式:
H2SO4
__________________________________
HI
_____________________________________
H2S
____________________________________
HClO
__________________________________
NaHSO3
________________________________
Cu(OH)2
________________________________
【训练2】关于强弱电解质及非电解质的组合完全
正确的是( )
A
B
C
D
强电解质
NaCl
H2SO4
CaCO3
HNO3
弱电解质
HF
BaSO4
HClO
HI
非电解质
Cl2
NH3
C2H5OH
SO2
课堂小结
1.弱电解质的电离存在电离平衡吗?
2.若存在,试着分析哪些条件的改变会使电离平衡发生移动?
课后思考
