仁爱版化学九年级下册专题8《金属和金属材料》测试题(含答案)
文档属性
| 名称 | 仁爱版化学九年级下册专题8《金属和金属材料》测试题(含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 128.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 仁爱科普版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-11 15:25:10 | ||
图片预览




文档简介
专题8《金属和金属材料》测试题
一、单选题(每小题只有一个正确答案)
1.中国短道速滑队在索契冬奥会取得骄人的成绩。速滑冰刀可用不锈钢制成,不锈钢含有的主要元素是
A.钢
B.碳
C.铝
D.铁
2.下列化学方程式书写正确且符合题意的是
A.用胃舒乳[Mg(OH)2]治疗胃酸过多:Mg(OH)2+H2SO4=MgSO4+2H2O
B.正常雨水的pH约为5.6的原因:CO2+H2O=H2CO3
C.细铁丝在氧气中燃烧:4Fe+3O2=2Fe2O3
D.消石灰吸收二氧化硫:Ca(OH)2+SO2=CaSO4+H2O
3.谚语诗词中蕴含着科学道理。下列说法正确的是( )
A.“真金不怕火炼”是说黄金熔点很高
B.“众人拾柴火焰高”是指可燃物越多,着火点越低,越容易着火
C.“百炼成钢”与“只要“功夫深铁杵磨成针”蕴含的化学原理相同
D.“满架蔷薇一院香”的原因是分子在不停地运动
4.下列物质的俗称、化学式及类别一致的是( )
A.水银
Ag
单质
B.小苏打
NaHCO3
盐
C.火碱
Ca(OH)2
碱
D.熟石灰
CaO
氧化物
5.下列化学方程式书写正确的是( )
A.3CO+2Fe2O3=2Fe+3CO2
B.Ca(OH)2+H2SO4=CaSO4+2H2O
C.2Fe+6HCl=2FeCl3+3H2
D.2H2O=2H2+O2
6.下列有关合金的叙述正确的是
①合金至少含有两种金属???
②合金中的元素以化合物的形式存在???
③合金中一定含有金属元素???
④合金一定是混合物???
⑤生铁是含少量杂质的铁合金???⑥生铁可完全溶解于稀盐酸中.
A.①②③④⑤⑥
B.①②③
C.③④⑤
D.④⑤⑥
7.下列说法中错误的是(??
)
A.地壳中的铁都以化合物形式存在
B.生铁和钢都不能完全溶解在盐酸中
C.锯条上的烤蓝是一层致密的氧化膜??????
D.钢是由生铁炼制而成的,因而钢不会生锈
8.向AgNO3和Cu(
NO3)2混合溶液中加入一定量的锌粉,充分反应后再加入稀盐酸无明显现象。下列说法正确的是
(
)
A.一定有锌粉剩余
B.所得溶液中一定有Zn(
NO3)
2、Cu(
NO3)2
C.一定有银粉生成
D.所得溶液中一定有Cu(
NO3)2、AgNO3
9.下列各项比较中,正确的是(
)
A.含铁的质量分数:Fe3O4B.含碳量:生铁<钢
C.地壳中元素的含量:铝<铁
D.金属的导电性:银<铜
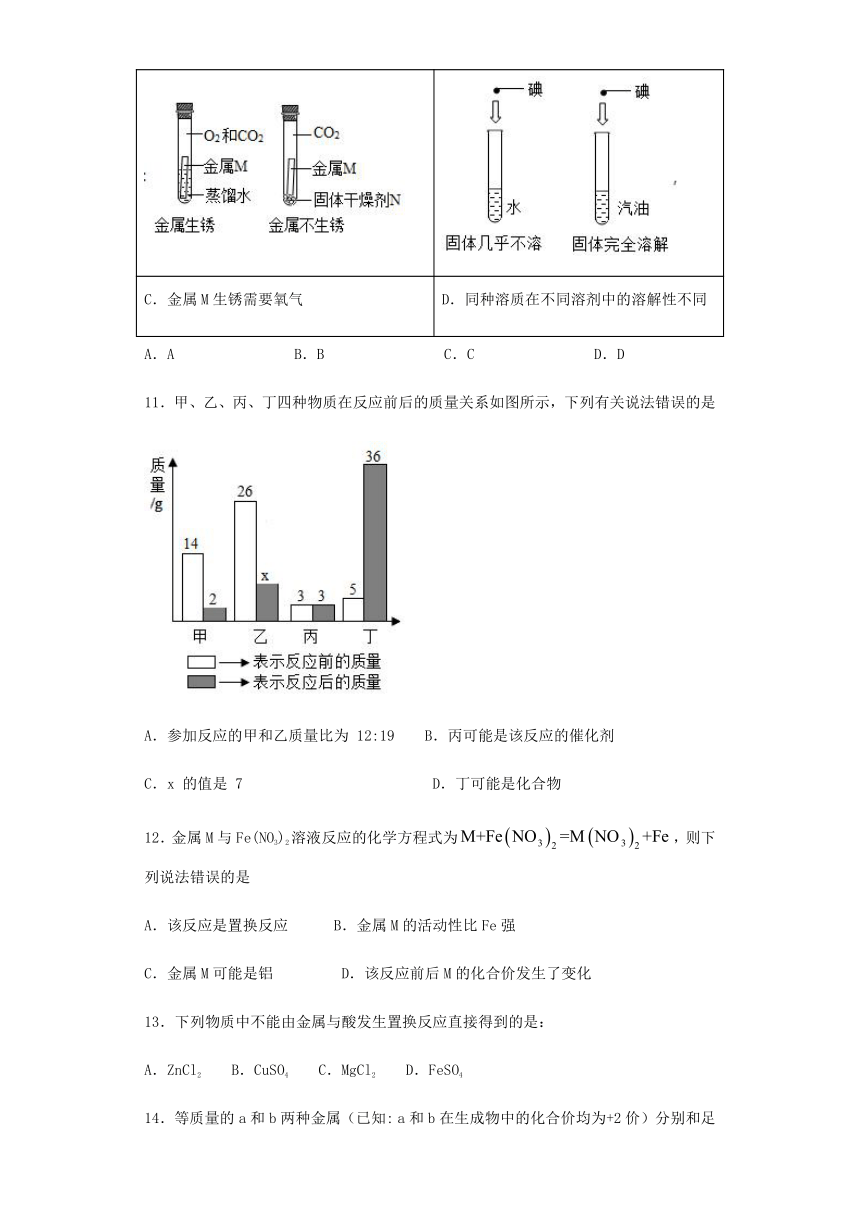
10.下列对比实验得到的实验结论正确的是(
)
A.能使紫色石蕊变红
B.二氧化锰是催化剂
C.金属M生锈需要氧气
D.同种溶质在不同溶剂中的溶解性不同
A.A
B.B
C.C
D.D
11.甲、乙、丙、丁四种物质在反应前后的质量关系如图所示,下列有关说法错误的是
A.参加反应的甲和乙质量比为
12:19
B.丙可能是该反应的催化剂
C.x
的值是
7
D.丁可能是化合物
12.金属M与Fe(NO3)2溶液反应的化学方程式为,则下列说法错误的是
A.该反应是置换反应
B.金属M的活动性比Fe强
C.金属M可能是铝
D.该反应前后M的化合价发生了变化
13.下列物质中不能由金属与酸发生置换反应直接得到的是:
A.ZnCl2
B.CuSO4
C.MgCl2
D.FeSO4
14.等质量的a和b两种金属(已知:
a和b在生成物中的化合价均为+2价)分别和足量的同体积、同浓度的盐酸反应,产生气体的质量与时间的关系如下图所示。下列说法中正确的个数是
①金属a
一定可以把金属b从它的化合物溶液中置换出来
②金属b所消耗盐酸的量一定比金属a多
③反应所放出的氢气的量:金属b一定大于金属a
④相对原子质量:金属b一定大于金属a
⑤若金属b是铁,则金属a可能是锌
A.2个
B.3个
C.4个
D.5个
15.甲、乙、丙、丁4种物质在密闭容器中发生反应,一段时间后测得反应前后各物质的质量如下表所示。下列说法正确的是( )
物质
甲
乙
丙
丁
反应前质量/g
30
3
6
8
反应后质量/g
16
m
4
24
A.甲和丙两种物质中的元素种类与丁物质中元素种类相同
B.乙一定是反应的催化剂
C.参加反应的甲、丙的质量比是5
:1
D.甲、丙一定都是单质
二、填空题
16.金属制品在生活中应用很广泛。
(1)下列生活用品,属于金属材料制品的是_________(填序号)。
A
塑料水杯
B
大理石砖
C
不锈钢水盆
(2)工业上用赤铁矿(主要成分Fe2O3)冶炼生铁的化学方程式为____________。
(3)铁制品锈蚀的过程,实际上是铁与__________等物质
发生化学反应的过程。防止铁制栏杆生锈的方法之一是_____________。
(4)路边的太阳能路灯灯柱为铝合金材质,因为铝合金的__________要比铝大。
17.硫酸的浓度不同,化学性质会有很大差异。将65
g锌加入到150
g质量分数为98%的浓硫酸中,发现锌逐渐溶解,产生有刺激性气味的气体,该气体是形成酸雨的主要气体。随着反应不断进行,硫酸浓度变小,变成稀硫酸,此时产生的气体没有刺激性气味。最终锌与硫酸恰好完全反应,剩余的溶液只含有一种溶质。
(1)请写出锌与稀硫酸反应的化学方程式_______,锌与浓硫酸反应的化学方程式_______。
(2)生成的气体总质量是________g。
18.厨房里也有许许多多的化学物质。
(1)NaCl是一种重要的盐,构成NaCl的微粒符号是_________、_________。
(2)烧水的水壶中经常会出现水垢,水垢的主要成分有CaCO3、Mg(OH)2
,写出用稀盐酸除水垢的化学反应方程式__________
,________。
(3)小红妈妈为她准备的午餐有米饭、红烧鱼、鸡蛋汤,从营养均衡的角度看,你认为还应该为她准备的是________。(填序号)
A.牛奶
B.炒青菜
C.红烧肉
D.馒头
(4)铁锅容易生锈,铁生锈是铁和空气中的________、________两种物质共同作用的结果,为防止铁锅生锈,可采取的措施是________________________。
(5)高铁酸钠(Na2FeO4)是一种新型高效的净水剂,高铁酸钠中铁元素的化合价为____;常见的食品脱氧剂多为无机铁盐脱氧剂,其主要成分为活性铁粉,请将脱氧过程中一步主要反应的化学方程式补充完整:4Fe(OH)2+O2+2____═4Fe(OH)3
19.人类社会的发展离不开金属。
(1)钢铁的锈蚀主要是铁与空气中的________等物质发生化学反应的结果;
(2)在空气中,铝的表明易生成致密的氧化膜,氧化膜的主要成分是_____(写化学式);
(3)某同学取少量工厂废液[溶质是AgNO3、Cu(NO3)2],向其中加入一定量的金属锌,反应结束后,发现溶液仍然是蓝色。据此推断,反应后溶液中一定含有的溶质是________________。
20.向、的混合溶液中加入一定量的锌粉、铁粉的混合物,并充分反应,过滤得滤渣和滤液。
(1)若往滤液中加盐酸有沉淀生成,则该反应的化学方程式为____________。
(2)若往滤渣中加入盐酸有气体放出,则滤液中一定有的溶质是_________。
三、推断题
21.A~F是初中化学中的常见物质,其中A是天然气的主要成分,B在常温下为液态,F是黑色粉末.如图是它们之间的转化关系,图中部分反应物或生成物未全部标出.
(1)B→D是
反应(填“放热”或“吸热”);
(2)C→E属于基本反应类型中的
反应;
(3)写出E→F的化学反应方程式
;
(4)写出E物质的另一种用途
.
22.A--E是初中化学常见的五种不同类别的物质,它们的转化关系如图所示(部分物质和反应条件已省略)。A是目前世界年产量最大的金属,B中金属元素的质量分数为70%,E是常用的一种建筑材料,则C的化学式为______;
“一”表示相互反应
“→”表示反应一步实现
①的化学方程式为______;②中的反应现象为______
四、实验题
23.某校同学以“比较锰、铁、铜三种金属的活动性”为课题进行探究.
提供的药品:铁片、铜片、锰片、稀盐酸、硫酸亚铁溶液、硫酸铜溶液、硫酸锰溶液
[做出猜想]他们考虑到铁的活动性比铜强,对三种金属的活动性顺序作出如下猜想.
猜想一:锰>铁>铜
猜想二:铁>铜>锰
猜想三:
.
[设计实验]为了验证猜想成立,同学们分成三组,分别针对一种猜想设计实验方案.
(1)第一组验证猜想一.实验方案是将锰片、铁片分别放入稀盐酸中,观察现象.
(2)第二组验证猜想二.实验方案是将锰片放入
中,观察现象.
(3)第三组验证猜想三.实验方案是(只用两个实验):
.
[实验及结论]各组通过实验和交流,确认猜想一是正确的.第一组同学的实验现象是:
.
[拓展研究]随后同学们对探究金属活动性的方案设计做了进一步研究.
为了验证甲、乙、丙、丁四种金属的活动性依次减弱,某同学设计了如下方案:①把甲放入乙的化合物溶液中;②把乙放入丙的化合物溶液中;③把乙放入丁的化合物溶液中;④把丁放入丙的化合物溶液中.你认为哪个实验没有必要做?请说明理由.
.
24.为研究酸的性质,让研究小组的同学进行了如下探究。
(1)小涵同学将颗粒大小相同的纯锌粒和粗锌粒中分别加入相同浓度的稀硫酸中,写出锌与硫酸反应的化学方程式_______________。
(2)小涵通过观察发现纯锌粒与硫酸的反应明显比粗锌粒慢。通过查阅资料得知粗锌中含有一些不活泼金属,她猜想可能是粗锌中不活泼金属促进了锌与硫酸的反应。为了验证小涵的猜想,你认为应该在盛有纯锌粒和稀硫酸的试管中,加入下列那种物质?________,选择该物质的理由是________________。
AHCl
B
CNaCl
D
(3)实验中小涵发现加入上述四种物质,纯锌与稀硫酸的反应都有不同程度的加快,请你分析可能的原因是什么?__________________。
(4)小川同学想通过用一定质量粗锌与足量的硫酸反应,测量生成氢气的体积来计算粗锌的纯度,于是设计了如图所示的实验装置。
在虚线框中应接入如图中的________,广口瓶上方残留的空气________(填“会”或“不会”)对氢气体积的测量造成影响。
五、计算题
25.小王同学想测定某Cu-Zn合金中铜的质量分数,取合金粉末13g,向其中逐渐加入一定溶质质量分数的稀硫酸,所加稀硫酸与生成氢气的质量关系如图所示。试计算合金中铜的质量分数______。
参考答案
1.D
2.B
3.D
4.B
5.B
6.C
7.D
8.C
9.A
10.D
11.D
12.C
13.B
14.C
15.A
16.C
氧气和水
刷漆
硬度
17.Zn+H2SO4
(稀)===
ZnSO4+H2↑
Zn+2H2SO4(浓)===
ZnSO4+SO2↑+2H2O
33
18.Na+
Cl-
CaCO3+2HCl═CaCl2+H2O+CO2↑
Mg(OH)2+2HCl=MgCl2+2H2O
B
氧气
水
洗净擦干、涂上植物油
+6
H2O
19.13.(1)氧气和水蒸气(或O2和H2O)
(2)Al2O3(3)硝酸铜和硝酸锌[或Cu(NO3)2和Zn(NO3)2]
20.
硝酸镁、硝酸锌
21.(1)放热;(2)化合;
(3)Fe2O3+3CO==2Fe+3CO2;(4)燃料.
22.HCl或H2SO4
3CO+Fe2O32Fe+3CO2
有白色沉淀生成
23.【作出猜想】铁>锰>铜
【设计实验】(2)硫酸铜溶液;(3)将两片锰分别放入硫酸亚铁溶液和硫酸铜溶液中,观察现象;
【实现及结论】都有气泡产生,锰片的反应比铁片的反应剧烈;
【拓展探究】实验③;实验①②④已可验证4中金属的活动性顺序,没必要进行实验③
24.
B
锌可以置换出铜(或铜不活泼)
加快了反应(或这些物质中都含氯元素)
②
不会
25.75%
一、单选题(每小题只有一个正确答案)
1.中国短道速滑队在索契冬奥会取得骄人的成绩。速滑冰刀可用不锈钢制成,不锈钢含有的主要元素是
A.钢
B.碳
C.铝
D.铁
2.下列化学方程式书写正确且符合题意的是
A.用胃舒乳[Mg(OH)2]治疗胃酸过多:Mg(OH)2+H2SO4=MgSO4+2H2O
B.正常雨水的pH约为5.6的原因:CO2+H2O=H2CO3
C.细铁丝在氧气中燃烧:4Fe+3O2=2Fe2O3
D.消石灰吸收二氧化硫:Ca(OH)2+SO2=CaSO4+H2O
3.谚语诗词中蕴含着科学道理。下列说法正确的是( )
A.“真金不怕火炼”是说黄金熔点很高
B.“众人拾柴火焰高”是指可燃物越多,着火点越低,越容易着火
C.“百炼成钢”与“只要“功夫深铁杵磨成针”蕴含的化学原理相同
D.“满架蔷薇一院香”的原因是分子在不停地运动
4.下列物质的俗称、化学式及类别一致的是( )
A.水银
Ag
单质
B.小苏打
NaHCO3
盐
C.火碱
Ca(OH)2
碱
D.熟石灰
CaO
氧化物
5.下列化学方程式书写正确的是( )
A.3CO+2Fe2O3=2Fe+3CO2
B.Ca(OH)2+H2SO4=CaSO4+2H2O
C.2Fe+6HCl=2FeCl3+3H2
D.2H2O=2H2+O2
6.下列有关合金的叙述正确的是
①合金至少含有两种金属???
②合金中的元素以化合物的形式存在???
③合金中一定含有金属元素???
④合金一定是混合物???
⑤生铁是含少量杂质的铁合金???⑥生铁可完全溶解于稀盐酸中.
A.①②③④⑤⑥
B.①②③
C.③④⑤
D.④⑤⑥
7.下列说法中错误的是(??
)
A.地壳中的铁都以化合物形式存在
B.生铁和钢都不能完全溶解在盐酸中
C.锯条上的烤蓝是一层致密的氧化膜??????
D.钢是由生铁炼制而成的,因而钢不会生锈
8.向AgNO3和Cu(
NO3)2混合溶液中加入一定量的锌粉,充分反应后再加入稀盐酸无明显现象。下列说法正确的是
(
)
A.一定有锌粉剩余
B.所得溶液中一定有Zn(
NO3)
2、Cu(
NO3)2
C.一定有银粉生成
D.所得溶液中一定有Cu(
NO3)2、AgNO3
9.下列各项比较中,正确的是(
)
A.含铁的质量分数:Fe3O4
C.地壳中元素的含量:铝<铁
D.金属的导电性:银<铜
10.下列对比实验得到的实验结论正确的是(
)
A.能使紫色石蕊变红
B.二氧化锰是催化剂
C.金属M生锈需要氧气
D.同种溶质在不同溶剂中的溶解性不同
A.A
B.B
C.C
D.D
11.甲、乙、丙、丁四种物质在反应前后的质量关系如图所示,下列有关说法错误的是
A.参加反应的甲和乙质量比为
12:19
B.丙可能是该反应的催化剂
C.x
的值是
7
D.丁可能是化合物
12.金属M与Fe(NO3)2溶液反应的化学方程式为,则下列说法错误的是
A.该反应是置换反应
B.金属M的活动性比Fe强
C.金属M可能是铝
D.该反应前后M的化合价发生了变化
13.下列物质中不能由金属与酸发生置换反应直接得到的是:
A.ZnCl2
B.CuSO4
C.MgCl2
D.FeSO4
14.等质量的a和b两种金属(已知:
a和b在生成物中的化合价均为+2价)分别和足量的同体积、同浓度的盐酸反应,产生气体的质量与时间的关系如下图所示。下列说法中正确的个数是
①金属a
一定可以把金属b从它的化合物溶液中置换出来
②金属b所消耗盐酸的量一定比金属a多
③反应所放出的氢气的量:金属b一定大于金属a
④相对原子质量:金属b一定大于金属a
⑤若金属b是铁,则金属a可能是锌
A.2个
B.3个
C.4个
D.5个
15.甲、乙、丙、丁4种物质在密闭容器中发生反应,一段时间后测得反应前后各物质的质量如下表所示。下列说法正确的是( )
物质
甲
乙
丙
丁
反应前质量/g
30
3
6
8
反应后质量/g
16
m
4
24
A.甲和丙两种物质中的元素种类与丁物质中元素种类相同
B.乙一定是反应的催化剂
C.参加反应的甲、丙的质量比是5
:1
D.甲、丙一定都是单质
二、填空题
16.金属制品在生活中应用很广泛。
(1)下列生活用品,属于金属材料制品的是_________(填序号)。
A
塑料水杯
B
大理石砖
C
不锈钢水盆
(2)工业上用赤铁矿(主要成分Fe2O3)冶炼生铁的化学方程式为____________。
(3)铁制品锈蚀的过程,实际上是铁与__________等物质
发生化学反应的过程。防止铁制栏杆生锈的方法之一是_____________。
(4)路边的太阳能路灯灯柱为铝合金材质,因为铝合金的__________要比铝大。
17.硫酸的浓度不同,化学性质会有很大差异。将65
g锌加入到150
g质量分数为98%的浓硫酸中,发现锌逐渐溶解,产生有刺激性气味的气体,该气体是形成酸雨的主要气体。随着反应不断进行,硫酸浓度变小,变成稀硫酸,此时产生的气体没有刺激性气味。最终锌与硫酸恰好完全反应,剩余的溶液只含有一种溶质。
(1)请写出锌与稀硫酸反应的化学方程式_______,锌与浓硫酸反应的化学方程式_______。
(2)生成的气体总质量是________g。
18.厨房里也有许许多多的化学物质。
(1)NaCl是一种重要的盐,构成NaCl的微粒符号是_________、_________。
(2)烧水的水壶中经常会出现水垢,水垢的主要成分有CaCO3、Mg(OH)2
,写出用稀盐酸除水垢的化学反应方程式__________
,________。
(3)小红妈妈为她准备的午餐有米饭、红烧鱼、鸡蛋汤,从营养均衡的角度看,你认为还应该为她准备的是________。(填序号)
A.牛奶
B.炒青菜
C.红烧肉
D.馒头
(4)铁锅容易生锈,铁生锈是铁和空气中的________、________两种物质共同作用的结果,为防止铁锅生锈,可采取的措施是________________________。
(5)高铁酸钠(Na2FeO4)是一种新型高效的净水剂,高铁酸钠中铁元素的化合价为____;常见的食品脱氧剂多为无机铁盐脱氧剂,其主要成分为活性铁粉,请将脱氧过程中一步主要反应的化学方程式补充完整:4Fe(OH)2+O2+2____═4Fe(OH)3
19.人类社会的发展离不开金属。
(1)钢铁的锈蚀主要是铁与空气中的________等物质发生化学反应的结果;
(2)在空气中,铝的表明易生成致密的氧化膜,氧化膜的主要成分是_____(写化学式);
(3)某同学取少量工厂废液[溶质是AgNO3、Cu(NO3)2],向其中加入一定量的金属锌,反应结束后,发现溶液仍然是蓝色。据此推断,反应后溶液中一定含有的溶质是________________。
20.向、的混合溶液中加入一定量的锌粉、铁粉的混合物,并充分反应,过滤得滤渣和滤液。
(1)若往滤液中加盐酸有沉淀生成,则该反应的化学方程式为____________。
(2)若往滤渣中加入盐酸有气体放出,则滤液中一定有的溶质是_________。
三、推断题
21.A~F是初中化学中的常见物质,其中A是天然气的主要成分,B在常温下为液态,F是黑色粉末.如图是它们之间的转化关系,图中部分反应物或生成物未全部标出.
(1)B→D是
反应(填“放热”或“吸热”);
(2)C→E属于基本反应类型中的
反应;
(3)写出E→F的化学反应方程式
;
(4)写出E物质的另一种用途
.
22.A--E是初中化学常见的五种不同类别的物质,它们的转化关系如图所示(部分物质和反应条件已省略)。A是目前世界年产量最大的金属,B中金属元素的质量分数为70%,E是常用的一种建筑材料,则C的化学式为______;
“一”表示相互反应
“→”表示反应一步实现
①的化学方程式为______;②中的反应现象为______
四、实验题
23.某校同学以“比较锰、铁、铜三种金属的活动性”为课题进行探究.
提供的药品:铁片、铜片、锰片、稀盐酸、硫酸亚铁溶液、硫酸铜溶液、硫酸锰溶液
[做出猜想]他们考虑到铁的活动性比铜强,对三种金属的活动性顺序作出如下猜想.
猜想一:锰>铁>铜
猜想二:铁>铜>锰
猜想三:
.
[设计实验]为了验证猜想成立,同学们分成三组,分别针对一种猜想设计实验方案.
(1)第一组验证猜想一.实验方案是将锰片、铁片分别放入稀盐酸中,观察现象.
(2)第二组验证猜想二.实验方案是将锰片放入
中,观察现象.
(3)第三组验证猜想三.实验方案是(只用两个实验):
.
[实验及结论]各组通过实验和交流,确认猜想一是正确的.第一组同学的实验现象是:
.
[拓展研究]随后同学们对探究金属活动性的方案设计做了进一步研究.
为了验证甲、乙、丙、丁四种金属的活动性依次减弱,某同学设计了如下方案:①把甲放入乙的化合物溶液中;②把乙放入丙的化合物溶液中;③把乙放入丁的化合物溶液中;④把丁放入丙的化合物溶液中.你认为哪个实验没有必要做?请说明理由.
.
24.为研究酸的性质,让研究小组的同学进行了如下探究。
(1)小涵同学将颗粒大小相同的纯锌粒和粗锌粒中分别加入相同浓度的稀硫酸中,写出锌与硫酸反应的化学方程式_______________。
(2)小涵通过观察发现纯锌粒与硫酸的反应明显比粗锌粒慢。通过查阅资料得知粗锌中含有一些不活泼金属,她猜想可能是粗锌中不活泼金属促进了锌与硫酸的反应。为了验证小涵的猜想,你认为应该在盛有纯锌粒和稀硫酸的试管中,加入下列那种物质?________,选择该物质的理由是________________。
AHCl
B
CNaCl
D
(3)实验中小涵发现加入上述四种物质,纯锌与稀硫酸的反应都有不同程度的加快,请你分析可能的原因是什么?__________________。
(4)小川同学想通过用一定质量粗锌与足量的硫酸反应,测量生成氢气的体积来计算粗锌的纯度,于是设计了如图所示的实验装置。
在虚线框中应接入如图中的________,广口瓶上方残留的空气________(填“会”或“不会”)对氢气体积的测量造成影响。
五、计算题
25.小王同学想测定某Cu-Zn合金中铜的质量分数,取合金粉末13g,向其中逐渐加入一定溶质质量分数的稀硫酸,所加稀硫酸与生成氢气的质量关系如图所示。试计算合金中铜的质量分数______。
参考答案
1.D
2.B
3.D
4.B
5.B
6.C
7.D
8.C
9.A
10.D
11.D
12.C
13.B
14.C
15.A
16.C
氧气和水
刷漆
硬度
17.Zn+H2SO4
(稀)===
ZnSO4+H2↑
Zn+2H2SO4(浓)===
ZnSO4+SO2↑+2H2O
33
18.Na+
Cl-
CaCO3+2HCl═CaCl2+H2O+CO2↑
Mg(OH)2+2HCl=MgCl2+2H2O
B
氧气
水
洗净擦干、涂上植物油
+6
H2O
19.13.(1)氧气和水蒸气(或O2和H2O)
(2)Al2O3(3)硝酸铜和硝酸锌[或Cu(NO3)2和Zn(NO3)2]
20.
硝酸镁、硝酸锌
21.(1)放热;(2)化合;
(3)Fe2O3+3CO==2Fe+3CO2;(4)燃料.
22.HCl或H2SO4
3CO+Fe2O32Fe+3CO2
有白色沉淀生成
23.【作出猜想】铁>锰>铜
【设计实验】(2)硫酸铜溶液;(3)将两片锰分别放入硫酸亚铁溶液和硫酸铜溶液中,观察现象;
【实现及结论】都有气泡产生,锰片的反应比铁片的反应剧烈;
【拓展探究】实验③;实验①②④已可验证4中金属的活动性顺序,没必要进行实验③
24.
B
锌可以置换出铜(或铜不活泼)
加快了反应(或这些物质中都含氯元素)
②
不会
25.75%
