人教化学选修4第四章第三节 电解池(共36张PPT)
文档属性
| 名称 | 人教化学选修4第四章第三节 电解池(共36张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-11 22:24:17 | ||
图片预览








文档简介
(共36张PPT)
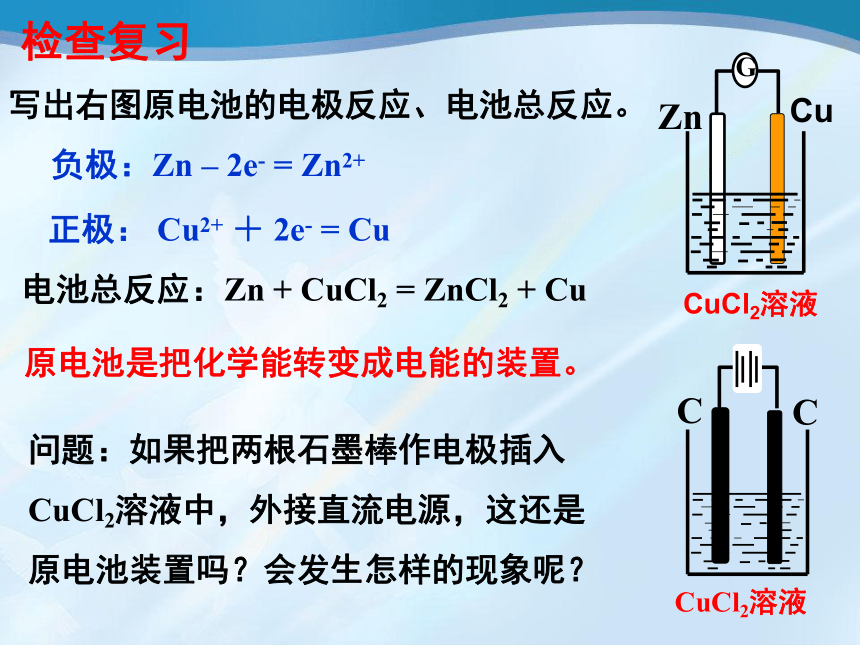
CuCl2溶液
写出右图原电池的电极反应、电池总反应。
负极:Zn
–
2e-
=
Zn2+
正极:
Cu2+
+
2e-
=
Cu
电池总反应:Zn
+
CuCl2
=
ZnCl2
+
Cu
CuCl2溶液
问题:如果把两根石墨棒作电极插入CuCl2溶液中,外接直流电源,这还是原电池装置吗?会发生怎样的现象呢?
原电池是把化学能转变成电能的装置。
检查复习
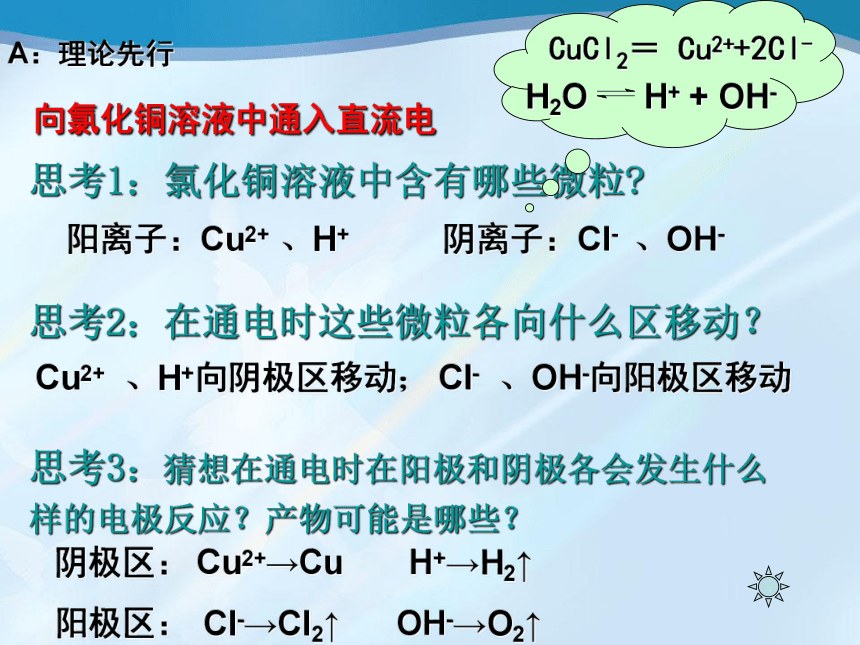
向氯化铜溶液中通入直流电
A:理论先行
思考1:氯化铜溶液中含有哪些微粒?
思考2:在通电时这些微粒各向什么区移动?
思考3:猜想在通电时在阳极和阴极各会发生什么样的电极反应?产物可能是哪些?
阳离子:Cu2+
、H+
阴离子:Cl-
、OH-
Cu2+
、H+向阴极区移动;
Cl-
、OH-向阳极区移动
Cl-→Cl2↑
OH-→O2↑
H2O
H+
+
OH-
CuCl2=
Cu2++2Cl-
阴极区:
Cu2+→Cu
H+→H2↑
阳极区:
电解原理:
①通电前:CuCl2
=
Cu2+
+
2Cl-,
Cu2+、Cl-为自由移动的离子;
②通电后:Cu2+移向阴极得到电子,
Cl-移向阳极失去电子;
③电极反应:
阳极:2Cl-
-
2e-=
Cl2↑(氧化反应)
阴极:Cu2+
+
2e-
=
Cu(还原反应)
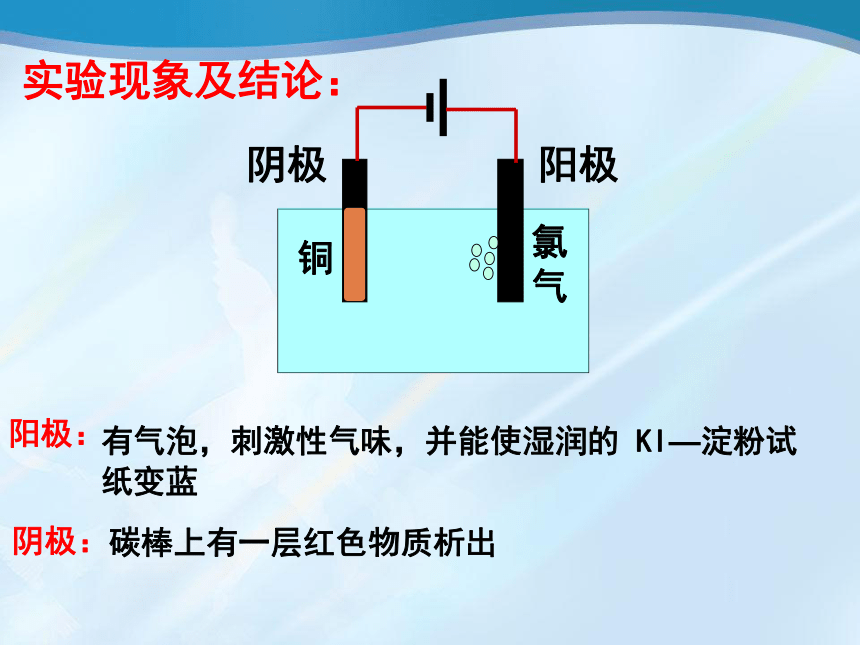
A
有气泡,刺激性气味,并能使湿润的
KI—淀粉试纸变蓝
碳棒上有一层红色物质析出
阳极
阴极
氯
气
铜
实验现象及结论:
阳极:
阴极:
一、电解原理
电解:电流通过电解质溶液(或熔融电解质)而在阴、阳两极引起氧化还原反应的过程。
理解:电解质溶液导电的过程就是
过程。
电解
电流是直流电;
电解是非自发地将
能转化为
能。
电
化学
1、电解池(槽):
电能转化为化学能的装置。
2、构成电解池的条件:
(1)直流电源、两个电极;
(2)电解质溶液或熔融的电解质;
(3)闭合回路。
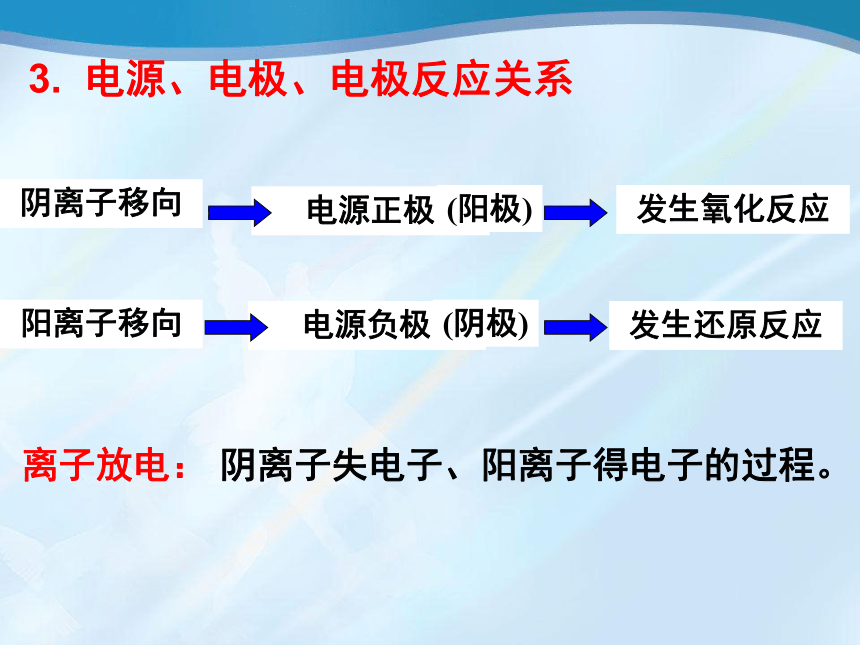
发生氧化反应
阴离子移向
电源正极
(阳极)
3.
电源、电极、电极反应关系
电源负极
(阴极)
发生还原反应
阳离子移向
离子放电:
阴离子失电子、阳离子得电子的过程。
4、离子放电顺序:
(1)阳离子放电(得电子)顺序:
Ag+
>
Hg2+
>
Fe3+
>
Cu2+
>
H+(水)
>
Pb2+
>
Sn2+
>
Fe2+
>Zn2+
>
Al3+
>
Mg2+
>
Na+
>
Ca2+
>
Ba2+
>
K+
(2)阴离子放电(失电子)顺序:
氧化性
还原性
S2–
>I–>
Br–
>
Cl–
>
OH–
(水)>
(NO3-、SO42–
等)含氧酸根
>
F-
注意:若阳极是活性电极(铂、碳、金之外)阳极本身失去电子被氧化,阴离子不在阳极放电;若阳极是惰性电极,还原性强的阴离子在阳极放电,阴极材料不发生任何变化。
总结:分析电解反应的一般思路:
明确溶液中存在哪些离子
根据阳极氧化、阴极还原分析得出产物
判断阳极材料及阴阳两极附近离子种类及离子放电顺序
先电离
后电解
5.电极反应式的书写
(1)写出用石墨电极电解硫酸铜溶液的电极反应式及总反应式
(2)写出用铜做电极电解硫酸铜溶液的电极反应式
阳极
4OH--4e-=2H2O+O2↑
阴极
2Cu2++4e-=2Cu
总反应式
阳极
(
Cu
):
阴极
(
Cu
):
Cu
-
2e–
=
Cu2+
Cu2+
+
2e–
=
Cu
6.
书写电解方程式的注意事项
(2)电极反应式要注意溶液的酸碱性对书写的影响;要注意两边的电荷要守恒(电子看作负电荷)
(3)标明条件:通电或电解。若电解的H+或OH-来自于H2O,在方程式中要以H2O形式存在,不能书写H+或OH-作为反应物
(4)电解反应是一个氧化还原反应,是被外界强迫发生的反应一
般形式为:弱氧化剂+弱还原剂
=
强氧化剂+强还原剂
(1)首先看阳极材料,若阳极是活性电极阳极本身失去电子被氧化,若阳极是惰性电极,阴离子在阳极放电。
阳
极
氧
化
阴
极
还!
练习1:
根据电解原理,画出电解NaCl水溶液的装置图。用碳棒作两极材料,注明哪是阳极哪是阴极,写出两极反应式及总的电解化学方程式。
阳极:
2Cl-+2e-
=
Cl2↑
阴极:
2H++2e-=H2↑
练习2
分析下图,哪个是原电池,哪个是电解池
①③⑤
⑥⑦
A、a为负极,b为正极
B、a为阳极,b为阴极
C、电解过程中,d电极质量增加
D、电解过程中,氯离子浓度不变
–
+
阴极
阳极
阴极d:
阳极c:
2Cl–
–
2e–
=
Cu2+
+
2e–
=
Cu
C
练习3
:如右图是电解氯化铜溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是
Cl2
↑
发生氧化还原反应,从而形成电流
电流通过引起氧化还原反应
两个电极、电解质溶液或熔融态电解质、形成闭合回路、自发发生氧化还原反应
电源、电极(惰性或非惰性)、电解质(水溶液或熔融态)
由电极本身决定
正极:流入电子
负极:流出电子
由外电源决定
阳极:连电源正极
阴极:连电源负极
(外电路)负极
→
正极
电源负极→阴极→阳极→电源正极
(外电路)正极→负极
电源正极→阳极→阴极→电源负极
负极:Zn
-
2e-
=Zn2+(氧化反应)
正极:2H+
+
2e-
=H2↑(还原原应)
阳极:2
Cl-
-
2e-
=
Cl2
↑(氧化反应)
阴极:
Cu2+
+
2e-
=
Cu
(还原反应)
化学能→
电能
电能→化学能
设计电池、金属防腐
氯碱工业、电镀、电冶、金属精炼
铜锌原电池
电解氯化铜
二.
电解原理的应用
1.电解饱和NaCl溶液
(氯碱工业)
两极材料:碳棒或其它惰性电极
NaCl
==
Na+
+
Cl–
阴极:
阳极:
2Cl–
–
2e–
=
Cl2↑
2H+
+
2e–
=
H2↑
2NaCl
+
2H2O
==
2NaOH
+
H2↑+
Cl2↑
总反应:
通电
阳极产物
Cl2
和阴极产物
NaOH(H2)如何检验?
阳极:
使湿润的KI淀粉试纸
变蓝
阴极:
滴入酚酞,溶液变红
–
+
Cl2
Cl2
Cl—
H2
H+
OH—
淡盐水
NaOH溶液
精制饱和NaCl溶液
阳离子交换膜
阳极室
阴极室
电解饱和食盐水的原理示意图
10
(1)生产设备名称:离子交换膜电解槽
阴极:碳钢
阳极:钛(惰性)
氯碱工业:离子交换膜法制烧碱
(2)离子交换膜的作用:
a、防止氢气和氯气混合而引起爆炸;
b、避免氯气与氢氧化钠反应生成次氯酸钠影响氢氧化钠的产量。
只允许阳离子通过(Cl-、OH-离子和
气体不能通过),把电解槽隔成阴极室和阳极室。
阳离子交换膜:
电镀制品
2、电镀
⑴
定义:
利用电解原理在某些金属的表面镀上一薄层其它金属或是合金的方法。
⑵
电镀材料的选择:
阴极
⑶
装置:
铜
镀件
CuSO4溶液
阳极
阴极
(电镀铜)
阳极:
阴极:
Cu
–
2e–
=
Cu2+
Cu2+
+
2e–
=
Cu
⑷
电镀的特点:
电镀液的浓度基本不变。
阳极参加反应
——镀件
阳极
——
镀层金属
电镀液
——含有镀层金属离子的溶液
1.
a
、b哪一极为正极?
2.
若要给铁叉镀银,
a极选用什么材料?
选择何种溶液?
【思考】
e–
–
+
阳极
阴极
3、铜的电解精炼
粗铜:含杂质(Zn、Fe、Ni、Ag、Au
等)
阳极:
Zn
–
2e–
=
Zn2+
Fe
–
2e–
=
Fe2+
Ni
–
2e–
=
Ni2+
Cu
–
2e–
=
Cu2+
Zn
Fe
Ni
Cu
Ag
Au
阴极:
阳极泥
粗铜
纯铜
硫酸铜溶液
阳极
阴极
Cu2+
+
2e–
=
Cu
思考:若把阴极纯铜换成铁棒,电解过程变吗?
不变,但不是精炼铜了,而叫电镀铜。
电解完后,CuSO4溶液的浓度有何变化?
基本不变,但变小
阳极:6O2--12
e-
=3O2↑
阴极:4Al3+
+
12e-
=4Al
冶炼铝原理:
助熔剂:冰晶石(Na3AlF6
六氟合铝酸钠)
阳极材料(碳)和熔融氧化铝需要定期补充
思考:工业上为什么用电解熔融氧化铝的方法冶炼铝而不用AlCl3?
4、电冶金
冶炼活泼金属
K
~~
Al
冶炼铝设备图
烟罩
1、用石墨作电极电解CuCl2、NaCl的混合溶液时,
阴极析出的物质是
;阳极产物是
。
2、两极都用银片作电极电解AgNO3时,阳极的产物
是
;阴极的产物是
。
练习1:
Cu
Cl2
Ag+
Ag
3、试写出下列装置中所发生的电极反应式。
石墨
石墨
粗铜
纯铜
纯铜
铁
CuSO4溶液
CuSO4溶液
CuSO4溶液
(A)
(B)
(C)
练习2.请观察下列实验装置图,指出各装置的名称。
电解池
电镀池
NaCl溶液
硫酸溶液
原电池
Cu
Zn
C
Cu
Fe
Fe
粗Cu
CuSO4溶液
精Cu
精炼池
A
B
C
D
CuSO4溶液
电解池
原电池
阴极
阳极
练习3、判断下列装置各属于什么池?
正极
负极
1、无外接电源,
可能是原电池:依据原电池的形成条件判定,
“三看”
电极:两极为导体且活泼性不同
电解液:两极插入电解液中
回路:形成闭合回路或两极接触
2、有外接电源,两极插入电解质溶液中,可能是电解池或电镀池:当阳极金属与电解质溶液中的金属阳离子相同,为电镀池,其余情况为电解池。
下列描述不正确的是(
)
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.把铜片插入氯化铁溶液中,在铜片表面出现一层铁
C.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速度加快
D.与电源负极相连的是电解槽的阴极
B
练习4:
下图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。下列说法正确的是(
)
A.X是正极,Y是负极
B.X是负极,Y是正极
C.CuSO4溶液的PH值逐渐减小
D.CuSO4溶液的PH值不变
A
C
+
-
阳
阴
阳
阴
练习5:
★电解规律
阴极
阳极
氯
气
铜
阳极:2Cl--2
e-
=Cl2↑
阴极:Cu2++
2e-=2Cu↓
减小
减小
CuCl2
CuCl2溶液
1、电解电解质型
阳极
阴极
氧气
氢
气
阳极:
4OH-
-4e-
=
2H2O+O2↑
阴极:
4H
++
4e-
=
2H2
↑
变大
不
变
加H2O
Na2SO4溶液
2H2O
2H2↑
+O2↑
2、电解水型
阳极
阴极
氯气
氢
气
阳极:
2Cl--2e-
=Cl2↑
阴极:
2H
++
2e-
=H2
↑
2NaCl+2H2O
2NaOH+H2
↑
+
Cl2
↑
减小
增
大
加
HCl
NaCl溶液
3、放氢生碱型
阳极
阴极
氧
气
铜
阳极:
4OH-
-
4e-
=
2H2O+O2↑
阴极:Cu2++
2e-
=Cu
减小
减小
加
CuO
CuSO4溶液
4、放氧生酸型
实例
电极反应
浓度
PH值
复原
CuSO4
CuCl2溶液
写出右图原电池的电极反应、电池总反应。
负极:Zn
–
2e-
=
Zn2+
正极:
Cu2+
+
2e-
=
Cu
电池总反应:Zn
+
CuCl2
=
ZnCl2
+
Cu
CuCl2溶液
问题:如果把两根石墨棒作电极插入CuCl2溶液中,外接直流电源,这还是原电池装置吗?会发生怎样的现象呢?
原电池是把化学能转变成电能的装置。
检查复习
向氯化铜溶液中通入直流电
A:理论先行
思考1:氯化铜溶液中含有哪些微粒?
思考2:在通电时这些微粒各向什么区移动?
思考3:猜想在通电时在阳极和阴极各会发生什么样的电极反应?产物可能是哪些?
阳离子:Cu2+
、H+
阴离子:Cl-
、OH-
Cu2+
、H+向阴极区移动;
Cl-
、OH-向阳极区移动
Cl-→Cl2↑
OH-→O2↑
H2O
H+
+
OH-
CuCl2=
Cu2++2Cl-
阴极区:
Cu2+→Cu
H+→H2↑
阳极区:
电解原理:
①通电前:CuCl2
=
Cu2+
+
2Cl-,
Cu2+、Cl-为自由移动的离子;
②通电后:Cu2+移向阴极得到电子,
Cl-移向阳极失去电子;
③电极反应:
阳极:2Cl-
-
2e-=
Cl2↑(氧化反应)
阴极:Cu2+
+
2e-
=
Cu(还原反应)
A
有气泡,刺激性气味,并能使湿润的
KI—淀粉试纸变蓝
碳棒上有一层红色物质析出
阳极
阴极
氯
气
铜
实验现象及结论:
阳极:
阴极:
一、电解原理
电解:电流通过电解质溶液(或熔融电解质)而在阴、阳两极引起氧化还原反应的过程。
理解:电解质溶液导电的过程就是
过程。
电解
电流是直流电;
电解是非自发地将
能转化为
能。
电
化学
1、电解池(槽):
电能转化为化学能的装置。
2、构成电解池的条件:
(1)直流电源、两个电极;
(2)电解质溶液或熔融的电解质;
(3)闭合回路。
发生氧化反应
阴离子移向
电源正极
(阳极)
3.
电源、电极、电极反应关系
电源负极
(阴极)
发生还原反应
阳离子移向
离子放电:
阴离子失电子、阳离子得电子的过程。
4、离子放电顺序:
(1)阳离子放电(得电子)顺序:
Ag+
>
Hg2+
>
Fe3+
>
Cu2+
>
H+(水)
>
Pb2+
>
Sn2+
>
Fe2+
>Zn2+
>
Al3+
>
Mg2+
>
Na+
>
Ca2+
>
Ba2+
>
K+
(2)阴离子放电(失电子)顺序:
氧化性
还原性
S2–
>I–>
Br–
>
Cl–
>
OH–
(水)>
(NO3-、SO42–
等)含氧酸根
>
F-
注意:若阳极是活性电极(铂、碳、金之外)阳极本身失去电子被氧化,阴离子不在阳极放电;若阳极是惰性电极,还原性强的阴离子在阳极放电,阴极材料不发生任何变化。
总结:分析电解反应的一般思路:
明确溶液中存在哪些离子
根据阳极氧化、阴极还原分析得出产物
判断阳极材料及阴阳两极附近离子种类及离子放电顺序
先电离
后电解
5.电极反应式的书写
(1)写出用石墨电极电解硫酸铜溶液的电极反应式及总反应式
(2)写出用铜做电极电解硫酸铜溶液的电极反应式
阳极
4OH--4e-=2H2O+O2↑
阴极
2Cu2++4e-=2Cu
总反应式
阳极
(
Cu
):
阴极
(
Cu
):
Cu
-
2e–
=
Cu2+
Cu2+
+
2e–
=
Cu
6.
书写电解方程式的注意事项
(2)电极反应式要注意溶液的酸碱性对书写的影响;要注意两边的电荷要守恒(电子看作负电荷)
(3)标明条件:通电或电解。若电解的H+或OH-来自于H2O,在方程式中要以H2O形式存在,不能书写H+或OH-作为反应物
(4)电解反应是一个氧化还原反应,是被外界强迫发生的反应一
般形式为:弱氧化剂+弱还原剂
=
强氧化剂+强还原剂
(1)首先看阳极材料,若阳极是活性电极阳极本身失去电子被氧化,若阳极是惰性电极,阴离子在阳极放电。
阳
极
氧
化
阴
极
还!
练习1:
根据电解原理,画出电解NaCl水溶液的装置图。用碳棒作两极材料,注明哪是阳极哪是阴极,写出两极反应式及总的电解化学方程式。
阳极:
2Cl-+2e-
=
Cl2↑
阴极:
2H++2e-=H2↑
练习2
分析下图,哪个是原电池,哪个是电解池
①③⑤
⑥⑦
A、a为负极,b为正极
B、a为阳极,b为阴极
C、电解过程中,d电极质量增加
D、电解过程中,氯离子浓度不变
–
+
阴极
阳极
阴极d:
阳极c:
2Cl–
–
2e–
=
Cu2+
+
2e–
=
Cu
C
练习3
:如右图是电解氯化铜溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是
Cl2
↑
发生氧化还原反应,从而形成电流
电流通过引起氧化还原反应
两个电极、电解质溶液或熔融态电解质、形成闭合回路、自发发生氧化还原反应
电源、电极(惰性或非惰性)、电解质(水溶液或熔融态)
由电极本身决定
正极:流入电子
负极:流出电子
由外电源决定
阳极:连电源正极
阴极:连电源负极
(外电路)负极
→
正极
电源负极→阴极→阳极→电源正极
(外电路)正极→负极
电源正极→阳极→阴极→电源负极
负极:Zn
-
2e-
=Zn2+(氧化反应)
正极:2H+
+
2e-
=H2↑(还原原应)
阳极:2
Cl-
-
2e-
=
Cl2
↑(氧化反应)
阴极:
Cu2+
+
2e-
=
Cu
(还原反应)
化学能→
电能
电能→化学能
设计电池、金属防腐
氯碱工业、电镀、电冶、金属精炼
铜锌原电池
电解氯化铜
二.
电解原理的应用
1.电解饱和NaCl溶液
(氯碱工业)
两极材料:碳棒或其它惰性电极
NaCl
==
Na+
+
Cl–
阴极:
阳极:
2Cl–
–
2e–
=
Cl2↑
2H+
+
2e–
=
H2↑
2NaCl
+
2H2O
==
2NaOH
+
H2↑+
Cl2↑
总反应:
通电
阳极产物
Cl2
和阴极产物
NaOH(H2)如何检验?
阳极:
使湿润的KI淀粉试纸
变蓝
阴极:
滴入酚酞,溶液变红
–
+
Cl2
Cl2
Cl—
H2
H+
OH—
淡盐水
NaOH溶液
精制饱和NaCl溶液
阳离子交换膜
阳极室
阴极室
电解饱和食盐水的原理示意图
10
(1)生产设备名称:离子交换膜电解槽
阴极:碳钢
阳极:钛(惰性)
氯碱工业:离子交换膜法制烧碱
(2)离子交换膜的作用:
a、防止氢气和氯气混合而引起爆炸;
b、避免氯气与氢氧化钠反应生成次氯酸钠影响氢氧化钠的产量。
只允许阳离子通过(Cl-、OH-离子和
气体不能通过),把电解槽隔成阴极室和阳极室。
阳离子交换膜:
电镀制品
2、电镀
⑴
定义:
利用电解原理在某些金属的表面镀上一薄层其它金属或是合金的方法。
⑵
电镀材料的选择:
阴极
⑶
装置:
铜
镀件
CuSO4溶液
阳极
阴极
(电镀铜)
阳极:
阴极:
Cu
–
2e–
=
Cu2+
Cu2+
+
2e–
=
Cu
⑷
电镀的特点:
电镀液的浓度基本不变。
阳极参加反应
——镀件
阳极
——
镀层金属
电镀液
——含有镀层金属离子的溶液
1.
a
、b哪一极为正极?
2.
若要给铁叉镀银,
a极选用什么材料?
选择何种溶液?
【思考】
e–
–
+
阳极
阴极
3、铜的电解精炼
粗铜:含杂质(Zn、Fe、Ni、Ag、Au
等)
阳极:
Zn
–
2e–
=
Zn2+
Fe
–
2e–
=
Fe2+
Ni
–
2e–
=
Ni2+
Cu
–
2e–
=
Cu2+
Zn
Fe
Ni
Cu
Ag
Au
阴极:
阳极泥
粗铜
纯铜
硫酸铜溶液
阳极
阴极
Cu2+
+
2e–
=
Cu
思考:若把阴极纯铜换成铁棒,电解过程变吗?
不变,但不是精炼铜了,而叫电镀铜。
电解完后,CuSO4溶液的浓度有何变化?
基本不变,但变小
阳极:6O2--12
e-
=3O2↑
阴极:4Al3+
+
12e-
=4Al
冶炼铝原理:
助熔剂:冰晶石(Na3AlF6
六氟合铝酸钠)
阳极材料(碳)和熔融氧化铝需要定期补充
思考:工业上为什么用电解熔融氧化铝的方法冶炼铝而不用AlCl3?
4、电冶金
冶炼活泼金属
K
~~
Al
冶炼铝设备图
烟罩
1、用石墨作电极电解CuCl2、NaCl的混合溶液时,
阴极析出的物质是
;阳极产物是
。
2、两极都用银片作电极电解AgNO3时,阳极的产物
是
;阴极的产物是
。
练习1:
Cu
Cl2
Ag+
Ag
3、试写出下列装置中所发生的电极反应式。
石墨
石墨
粗铜
纯铜
纯铜
铁
CuSO4溶液
CuSO4溶液
CuSO4溶液
(A)
(B)
(C)
练习2.请观察下列实验装置图,指出各装置的名称。
电解池
电镀池
NaCl溶液
硫酸溶液
原电池
Cu
Zn
C
Cu
Fe
Fe
粗Cu
CuSO4溶液
精Cu
精炼池
A
B
C
D
CuSO4溶液
电解池
原电池
阴极
阳极
练习3、判断下列装置各属于什么池?
正极
负极
1、无外接电源,
可能是原电池:依据原电池的形成条件判定,
“三看”
电极:两极为导体且活泼性不同
电解液:两极插入电解液中
回路:形成闭合回路或两极接触
2、有外接电源,两极插入电解质溶液中,可能是电解池或电镀池:当阳极金属与电解质溶液中的金属阳离子相同,为电镀池,其余情况为电解池。
下列描述不正确的是(
)
A.把铜片和铁片紧靠在一起浸入稀硫酸中,铜片表面出现气泡
B.把铜片插入氯化铁溶液中,在铜片表面出现一层铁
C.把锌粒放入盛有盐酸的试管中,加入几滴氯化铜溶液,气泡放出速度加快
D.与电源负极相连的是电解槽的阴极
B
练习4:
下图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。下列说法正确的是(
)
A.X是正极,Y是负极
B.X是负极,Y是正极
C.CuSO4溶液的PH值逐渐减小
D.CuSO4溶液的PH值不变
A
C
+
-
阳
阴
阳
阴
练习5:
★电解规律
阴极
阳极
氯
气
铜
阳极:2Cl--2
e-
=Cl2↑
阴极:Cu2++
2e-=2Cu↓
减小
减小
CuCl2
CuCl2溶液
1、电解电解质型
阳极
阴极
氧气
氢
气
阳极:
4OH-
-4e-
=
2H2O+O2↑
阴极:
4H
++
4e-
=
2H2
↑
变大
不
变
加H2O
Na2SO4溶液
2H2O
2H2↑
+O2↑
2、电解水型
阳极
阴极
氯气
氢
气
阳极:
2Cl--2e-
=Cl2↑
阴极:
2H
++
2e-
=H2
↑
2NaCl+2H2O
2NaOH+H2
↑
+
Cl2
↑
减小
增
大
加
HCl
NaCl溶液
3、放氢生碱型
阳极
阴极
氧
气
铜
阳极:
4OH-
-
4e-
=
2H2O+O2↑
阴极:Cu2++
2e-
=Cu
减小
减小
加
CuO
CuSO4溶液
4、放氧生酸型
实例
电极反应
浓度
PH值
复原
CuSO4
