人教高中化学必修二2.3化学反应的速率和限度《“三段式”法在化学反应速率计算中的应用》教学设计
文档属性
| 名称 | 人教高中化学必修二2.3化学反应的速率和限度《“三段式”法在化学反应速率计算中的应用》教学设计 |  | |
| 格式 | zip | ||
| 文件大小 | 144.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-13 21:40:37 | ||
图片预览




文档简介
《“三段式”法在化学反应速率计算中的应用》
人教版《化学必修2》第二章第三节
一、课程标准、教材以及学生分析
1.课程标准和教材分析
对于《化学反应速率》的教学,在《化学必修2》和《化学选修4》中都有出现,《课程标准》要求知道化学反应速率的定量表示方法,能计算反应物的转化率。
人教版《化学必修2》第二章第三节《化学反应的速率和限度》中从日常生活中的现象入手,发现有的化学反应进行得快,有的化学反应进行得慢,结合物理学中物体的运动快慢用“速度”来表示,引出化学反应过程进行的快慢用“反应速率”来表示,通常用单位反应物浓度的减少量或生成物浓度的增加量(均去正值)来表示。接着通过实验探究影响化学反应速率的因素,并未过多提及计算。但是在学业水平测试和高考中,却常常以计算题的形式考察相关知识,特别是在高二《化学选修4》中会进一步学习化学反应速率和化学平衡,若高一就学得糊里糊涂,高二的学习就会显得更加困难,因此在规定的2课时之后,我又加入了“三段式”法在化学反应速率计算中的应用这1课时,作为补充。
2.学生分析
化学反应速率的计算中数据比较多、关系也比较复杂,特别容易混淆,在学习完本节内容后发现,学生做题遇到计算都很头疼,只能做简单的带入公式的直接计算,而对于略显复杂的计算也有畏难情绪,所以希望通过“三段式”法的教学,可以使得各种数据直观、调理清晰、便于分析和计算,为《化学选修4》中进一步学习化学反应速率和化学平衡奠定基础。
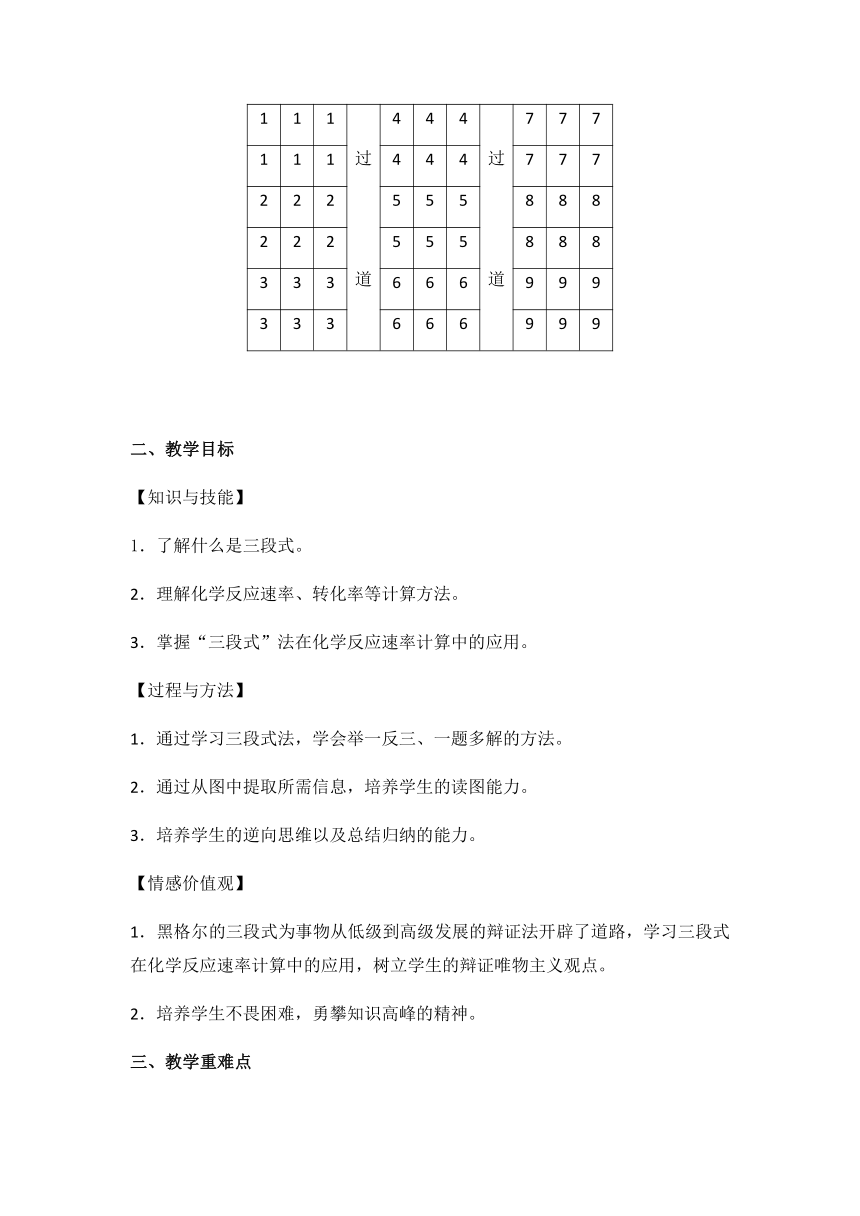
本班学生是我校普通班的学生,基础较薄弱,教学中要多鼓励,多启发,让他们觉得计算题也是可以有突破口的,培养他们的自信心。该班的座位是按照“3过道3过道3”排布的,前后两排的6位同学为一个学习小组(如下图),在教学过程的探究学习都以小组为单位,内部先达成一致,再派代表发言,然后有异议的组再派代表发言,形成良好的讨论氛围。
1
1
1
过道
4
4
4
过道
7
7
7
1
1
1
4
4
4
7
7
7
2
2
2
5
5
5
8
8
8
2
2
2
5
5
5
8
8
8
3
3
3
6
6
6
9
9
9
3
3
3
6
6
6
9
9
9
二、教学目标
【知识与技能】
1.了解什么是三段式。
2.理解化学反应速率、转化率等计算方法。
3.掌握“三段式”法在化学反应速率计算中的应用。
【过程与方法】
1.通过学习三段式法,学会举一反三、一题多解的方法。
2.通过从图中提取所需信息,培养学生的读图能力。
3.培养学生的逆向思维以及总结归纳的能力。
【情感价值观】
1.黑格尔的三段式为事物从低级到高级发展的辩证法开辟了道路,学习三段式在化学反应速率计算中的应用,树立学生的辩证唯物主义观点。
2.培养学生不畏困难,勇攀知识高峰的精神。
三、教学重难点
熟练地掌握三段式法,并能运用三段式法解决化学反应速率计算中的问题。
四、教学流程图
五、教学过程
教学进程
教师活动
学生活动
设计意图
引入(约1min)
提问:作业中丢分最多的是什么题型?引入:介绍一种神奇的方法来解决该问题。
回顾:化学反应速率的计算题丢分最多。
教师提出问题,引领学生进入新课。
通过【例题1】讲解三段式的基本步骤(约8min)
【投影】一定条件下,向2L容器中通入3
mol氮气和10
mol氢气及催化剂反应,2
min
后,生成氨气的物质的量为2
mol,0-2min则内v(NH3)=______,2
min
末,C(N2)=_____,H2
的转化率为________。电子白板上边写边讲解:解:
N2
(g)
+
3H2(g)2NH3(g)n始(mol)
3
10
0
△n(mol)
n末(mol)
2N2
(g)
+
3H2(g)2NH3(g)n始(mol)
3
10
0
△n(mol)
1
3
2
n末(mol)
2
7
2v(NH3)
=△C(NH3)
=
△n(NH3)
=
2mol
△t
V·△t
2L×2
min=
0.5
mol/(L·min)C末(N2)=
n末(N2)
=
2mol
=
1mol/LV
2Lα(H2)=△n(H2)×100%
=
3mol×100%
=
30%n始(H2)
10mol
聆听、观察、思考、填写学案:基本步骤:1.写出正确的化学反应方程式。2.根据题意,依次在反应方程式下列出各反应物和生成物的n始、△n及n末。3.根据n始与n末的差的绝对值等于△n、△n之比等于对应物质的化学计量数之比,列出关系式计算。
通过实例分析讲解,构建三段式法的基本步骤,边讲边总结,便于学生理解记忆,比讲模式性的公式更直观。
学生分组自主探究【例题2】,教师指导。(约10min)
【投影】在某一容积为5
L的密闭容器内,加入0.2
mol的CO和0.2
mol的H2O(g),在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)CO2(g)+H2(g),反应放出热量。反应中CO2的浓度随时间变化的情况如图所示:根据图中数据,从反应开始至达到平衡时,H2O的化学反应速率为________;反应平衡c(H2)=______,CO的转化率为__________。指导学生按照例题1介绍基本步骤,结合上图中给出的信息,写出该题的三段式。教师走进学生小组讨论中,寻找不同解题方法的学生。询问是否有同学用了不同的方法来算?引导学生根据公式n=C·V,对于同一化学反应,V相同,n与C成正比,那么是否可以用C始、△C及C末来计算呢?引出第二种计算方法强调起始量、变化量、末尾量三者物理量及单位要统一
小组自主探究,讨论学习,达成共识。经过激烈的讨论,有以下两(或三)种方法,请每组派代表发言,看看哪一组才是正确的?×错误思路:误将10min后CO2
的浓度当成物质的量带入三段式。CO(g)
+
H2O(g)
CO2(g)
+
H2(g)n始(mol)
0.2
0.2
0
0△n(mol)
0.03
0.03
0.03
0.03
n末(mol)
0.17
0.17
0.03
0.03√正确思路一:先求出n末(CO2)=
C末(CO2)×V
=
0.03mol/L×5L
=
0.15mol,再代入三段式:CO(g)
+
H2O(g)
CO2(g)
+
H2(g)n始(mol)
0.2
0.2
0
0△n(mol)
0.15
0.15
0.15
0.15
n末(mol)
0.05
0.05
0.15
0.15v(H2O)
=
△C(H2O)
=
△n(H2O)
△t
V·△t=
0.15mol
=
0.003
mol/(L·min)5L×10
minC末(H2)
=
n末(H2)=
0.15mol
=
0.03
mol/L
V
5Lα(CO)=△n(CO)×100%
=
0.15mol×100%
=
75%n始(CO)
0.2mol√正确思路二:先求出C始(CO)=n始(CO)=0.2mol
=
0.04mol/L
V
5LC始(H2O)=n始(H2O)
=
0.2mol
=
0.04mol/L,V
5L再代入三段式:
CO(g)
+
H2O(g)
CO2(g)
+
H2(g)C始(mol/L)
0.04
0.04
0
0△C(mol/L)
0.03
0.03
0.03
0.03
C末(mol/L)
0.01
0.01
0.03
0.03
v(H2O)=△C(H2O)
=
0.03mol/L
=0.003
mol/(L·min)
△t
10
minC末(H2)
=
0.03
mol/Lα(CO)=△C(CO)×100%=0.03mol/L×100%
=
75%C始(CO)
0.04mol/L填写学案基本步骤中的空格以及注意事项1:2.……(或C始、△C及C末)……3.……(或C始与C末的差的绝对值等于△C)…(或△C)……1.起始量、变化量、末尾量三者物理量及单位要统一,都是物质的量或物质的量浓度,否则无法计算。
根据例题1中介绍的基本步骤,举一反三。使学生们的思维发生碰撞,产生知识的火花。这是学生们最可能犯的错误。经过讨论得出来的正确答案,往往比老师讲解得来的答案,印象深刻。培养学生一题多解的能力。总结出,三段式的两种切入点,虽然所用的物理量不一样,但是计算出的结果是一模一样的,切记,一定要统一物理量及单位。
学生分组自主探究【例题3】,教师指导。(约6min)
【投影】在2L容器中,某可逆反应从0—2分钟进行过程中,
在不同反应时间各物质的量的变化情况如图所示。则该反应的的反应物是
,生成物是
,化学方程式为
;反应开始至2分钟时,C的反应速率为
;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了
状态。指导学生读图,分析A、B的物质的量随着反应的进行逐渐减少,为反应物;C的物质的量随着反应的进行逐渐增多,为反生成物。根据题意,依次在反应方程式下列出各反应物和生成物的n始、n末。根据n始与n末的差的绝对值等于△n填空再根据△n
之比等于对应物质的化学计量数之比,推到出该反应的化学方程式。
小组自主探究,讨论学习,达成共识。
___
A
+
___
B
___
C
n始(mol)
5
2
2
△n(mol)
n末(mol)
3
1
4
2
A
+
B
2
C
n始(mol)
5
2
2
△n(mol)
2
1
2
n末(mol)
3
1
4
v(C)=△C(C)
=△n(C)
=
2mol
=
0.5
mol/(L·min)
△t
V·△t
2L×2
min2分钟后,各组分的物质的量不再改变,说明已达到了化学平衡状态。
前两个例题都是已知化学方程式,计算化学反应速率及转化率等,该题首先通过读图,分析出反应物和生成物,再通过列出三段式,最后逆向思维推出反应的化学方程式。培养读图能力,复习化学平衡状态的判断依据。
学生分组自主探究【例题4】,教师指导。(约10min)
【投影】氢气是合成氨的重要原料,合成氨反应的化学方程式如下:N2(g)+3H2(g)2NH3(g)。(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。图中表示反应处于化学平衡状态的时间段(t1时刻后)为 。指导学生读图,复习化学平衡状态的判断依据。(2)在一定温度下,向一个容积为1
L的固定容器中通入2
mol氮气和8
mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%,N2的转化率为 。指导学生设未知数时,按照化学计量数之比,设△n分别为x、3x、2x根阿伏伽德罗定律的推论,恒温、恒容时混合气体的压强与其物质的量成正比:
?小组自主探究,讨论学习,达成共识。学生通过读图,分析出t2-t3、t4-t5中正逆反应速率相等,则表示已达到化学平衡状态。N2
(g)
+
3H2(g)
2NH3(g)n始(mol)
2
8
0
△n(mol)
n末(mol)
N2
(g)
+
3H2(g)
2NH3(g)n始(mol)
2
8
0
△n(mol)
x
3x
2x
n末(mol)
2-x
8-3x
2x
P末=
n末
80%=(2-x+8-3x+2x)mol
P始
n始
(2+8)
mol
x=1α(H2)
=
△n(H2)×100%
=
1mol×100%
=
50%n始(H2)
2mol填写学案基本步骤中的空格:2.……未知量可以设未知数表示;
培养读图能力,复习化学平衡状态的判断依据。遇到只告诉开始的物理量和压强比或者体积比的题目,需要设未知数进行计算。复习阿伏伽德罗定律的推论。
课堂小结(约3min)
提问:不同物质的起始量或末尾量与化学计量数有没有关系?总结:通过本节课学习“三段式”法在化学反应速率计算中的应用,同学们有没有觉得,计算也没有那么难?有没有觉得这是一个神奇的方法?希望大家课下再巩固、练习,将上次作业中的错题订正,为我们高二的学习奠定基础,
回顾例题1-2,思考,回答,没有关系。
填写学案注意事项中的空格:2.起始量、变化量、末尾量中,只有不同物质的变化量之比等于对应物质的化学计量数之比,不同物质的起始量或末尾量与化学计量数没有必然的关系,不能列比例计算。
学生学有所获,自己觉得很开心。
很多学生会认为起始量或末尾量之比等于化学计量数之比,这也是一个常见的误区。增加学生的自信心。再次加强巩固、练习,返回到加这一个课时的本意,解决问题。
六、教学设计反思
本课教学设计根据新课程倡导的以学生探究学习为主,教师指导为辅的理念,精选一道例题教师讲解,三道例题创设小组探究学习的情境,激发学生的学习兴趣,共同探讨如何利用三段式法解决化学反应速率计算中的相关问题,真正使学生转变思维方式,打开突破计算题的新视角。通过教学实践,我认为自己做的好的方面有:
1.依法治校,注重教育公平,因材施教
因为所教班级为普通班,学生基础较薄弱,所以教学进度适当的慢一点是可以的,针对学生在练习中体现出的问题,发现问题、解决问题,加了这一个课时,恰恰是因材施教,注重教育公平的最好体现,也是实践党中央依法治校的好机会。
2.小专题,大智慧
化学反应速率的计算,从工作开始的第一届学生到现在,每一届都会讲,但是之前的每一届都没有讲精,以至于好像什么都讲了,但学生还是怕,看到计算题就怕,稍微难一点的立即放弃,也许是当老师的觉得简单,就讲得快,恰恰忽略了这样的小专题,通过这一次精选例题,发现里面也有大智慧。今后的教学中,应该学会善于发现类似的小专题,组个突破,让学生感受到学习化学是有成就感的。
3.自主学习、探究学习,乐在其中
新课程改革倡导学生主动参与、乐于探究、培养学生分析和解决问题的能力以及交流与合作的能力。本节课力求使得学生在自主学习和探究合作学习的轻松切换中,成为自我引导的学习者、思考者,信息的使用者和生产者,学习的合作者和问题的解决者,而老师则是学生学习坚定的支持者、合作者和评价者。例题2的设计使学生思维碰撞出火花,产生争论,最后通过小组代表发言,说服其他组,学生会很有成就感,乐在其中。
4.利用多媒体和学案,辅助教学
本节课充分利用了多媒体技术的强大显示功能,不但将例题通过PPT投影,还利用电子白板笔可以直接在白板上书写,后期需要,还可翻看之前的板书。同时,准备学案,让学生能直观快速的看这例题讨论,并作答。
虽然课前做了精心的准备,但在实际的教学中还是凸显出了一些不足:
1.例题2讨论的时间过长,今后要注意把握好整节课的节奏。
2.例题3最初的设计是直接问该反应的化学方程式为,让部分学生又摸不清方向,后来修改为增加反应物和生成物分别是什么两问,让学生更容易上手。
通过本节课的教学设计,自己也成长了不少,愿每天心中开出一朵花,用此美丽的心情发现更多的小专题,哺育学生茁壮成长。
七、附学生学案:《“三段式”法在化学反应速率计算中的应用》
一.基本步骤:
1.写出正确的
;
2.根据题意,依次在反应方程式下列出各反应物和生成物的
、
及
(或
、
及
),未知量可以
表示;
3.根据
与
的差的绝对值等于
(或
与
的差的绝对值等于
)、
(或
)之比等于对应物质的
之比,列出关系式计算。
二.注意事项
1.起始量、变化量、末尾量三者
及
要统一,都是物质的量或物质的量浓度,否则无法计算。
2.起始量、变化量、末尾量中,只有不同物质的
之比等于对应物质的
之比,不同物质的起始量或末尾量与化学计量数没有必然的关系,不能列比例计算。
【例题1】一定条件下,向2L容器中通入3
mol氮气和10
mol氢气及催化剂反应,2
min
后,生成氨气的物质的量为2
mol,0-2min则内v(NH3)=___________,
2
min
末,C(N2)=____________,H2
的转化率为________。
N2
(g)
+
3H2(g)2NH3(g)
n始(mol)
3
10
0
△n(mol)
n末(mol)
2
【例题2】在某一容积为5
L的密闭容器内,加入0.2
mol的CO和0.2
mol的H2O(g),在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)
CO2(g)+H2(g),反应放出热量。反应中CO2的浓度随时间变化的情况如图所示:根据图中数据,从反应开始至达到平衡时,H2O的化学反应速率为________________________;反应平衡时c(H2)=______________,CO的转化率为______________。
【例题3】在2L容器中,某可逆反应从0—2分钟进行过程中,
在不同反应时间各物质的量的变化情况如右图所示。则该反应的的反应物是
,生成物是
,化学方程式为
;反应开始至2分钟时,C的反应速率为
;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了
状态。
【例题4】氢气是合成氨的重要原料,合成氨反应的化学方程式如下:N2(g)+3H2(g)2NH3(g)。
(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。图中表示反应处于化学平衡状态的时间段(t1时刻后)为 。
(2)在一定温度下,向一个容积为1
L的固定容器中通入2
mol氮气和8
mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%,N2的转化率为 。?
人教版《化学必修2》第二章第三节
一、课程标准、教材以及学生分析
1.课程标准和教材分析
对于《化学反应速率》的教学,在《化学必修2》和《化学选修4》中都有出现,《课程标准》要求知道化学反应速率的定量表示方法,能计算反应物的转化率。
人教版《化学必修2》第二章第三节《化学反应的速率和限度》中从日常生活中的现象入手,发现有的化学反应进行得快,有的化学反应进行得慢,结合物理学中物体的运动快慢用“速度”来表示,引出化学反应过程进行的快慢用“反应速率”来表示,通常用单位反应物浓度的减少量或生成物浓度的增加量(均去正值)来表示。接着通过实验探究影响化学反应速率的因素,并未过多提及计算。但是在学业水平测试和高考中,却常常以计算题的形式考察相关知识,特别是在高二《化学选修4》中会进一步学习化学反应速率和化学平衡,若高一就学得糊里糊涂,高二的学习就会显得更加困难,因此在规定的2课时之后,我又加入了“三段式”法在化学反应速率计算中的应用这1课时,作为补充。
2.学生分析
化学反应速率的计算中数据比较多、关系也比较复杂,特别容易混淆,在学习完本节内容后发现,学生做题遇到计算都很头疼,只能做简单的带入公式的直接计算,而对于略显复杂的计算也有畏难情绪,所以希望通过“三段式”法的教学,可以使得各种数据直观、调理清晰、便于分析和计算,为《化学选修4》中进一步学习化学反应速率和化学平衡奠定基础。
本班学生是我校普通班的学生,基础较薄弱,教学中要多鼓励,多启发,让他们觉得计算题也是可以有突破口的,培养他们的自信心。该班的座位是按照“3过道3过道3”排布的,前后两排的6位同学为一个学习小组(如下图),在教学过程的探究学习都以小组为单位,内部先达成一致,再派代表发言,然后有异议的组再派代表发言,形成良好的讨论氛围。
1
1
1
过道
4
4
4
过道
7
7
7
1
1
1
4
4
4
7
7
7
2
2
2
5
5
5
8
8
8
2
2
2
5
5
5
8
8
8
3
3
3
6
6
6
9
9
9
3
3
3
6
6
6
9
9
9
二、教学目标
【知识与技能】
1.了解什么是三段式。
2.理解化学反应速率、转化率等计算方法。
3.掌握“三段式”法在化学反应速率计算中的应用。
【过程与方法】
1.通过学习三段式法,学会举一反三、一题多解的方法。
2.通过从图中提取所需信息,培养学生的读图能力。
3.培养学生的逆向思维以及总结归纳的能力。
【情感价值观】
1.黑格尔的三段式为事物从低级到高级发展的辩证法开辟了道路,学习三段式在化学反应速率计算中的应用,树立学生的辩证唯物主义观点。
2.培养学生不畏困难,勇攀知识高峰的精神。
三、教学重难点
熟练地掌握三段式法,并能运用三段式法解决化学反应速率计算中的问题。
四、教学流程图
五、教学过程
教学进程
教师活动
学生活动
设计意图
引入(约1min)
提问:作业中丢分最多的是什么题型?引入:介绍一种神奇的方法来解决该问题。
回顾:化学反应速率的计算题丢分最多。
教师提出问题,引领学生进入新课。
通过【例题1】讲解三段式的基本步骤(约8min)
【投影】一定条件下,向2L容器中通入3
mol氮气和10
mol氢气及催化剂反应,2
min
后,生成氨气的物质的量为2
mol,0-2min则内v(NH3)=______,2
min
末,C(N2)=_____,H2
的转化率为________。电子白板上边写边讲解:解:
N2
(g)
+
3H2(g)2NH3(g)n始(mol)
3
10
0
△n(mol)
n末(mol)
2N2
(g)
+
3H2(g)2NH3(g)n始(mol)
3
10
0
△n(mol)
1
3
2
n末(mol)
2
7
2v(NH3)
=△C(NH3)
=
△n(NH3)
=
2mol
△t
V·△t
2L×2
min=
0.5
mol/(L·min)C末(N2)=
n末(N2)
=
2mol
=
1mol/LV
2Lα(H2)=△n(H2)×100%
=
3mol×100%
=
30%n始(H2)
10mol
聆听、观察、思考、填写学案:基本步骤:1.写出正确的化学反应方程式。2.根据题意,依次在反应方程式下列出各反应物和生成物的n始、△n及n末。3.根据n始与n末的差的绝对值等于△n、△n之比等于对应物质的化学计量数之比,列出关系式计算。
通过实例分析讲解,构建三段式法的基本步骤,边讲边总结,便于学生理解记忆,比讲模式性的公式更直观。
学生分组自主探究【例题2】,教师指导。(约10min)
【投影】在某一容积为5
L的密闭容器内,加入0.2
mol的CO和0.2
mol的H2O(g),在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)CO2(g)+H2(g),反应放出热量。反应中CO2的浓度随时间变化的情况如图所示:根据图中数据,从反应开始至达到平衡时,H2O的化学反应速率为________;反应平衡c(H2)=______,CO的转化率为__________。指导学生按照例题1介绍基本步骤,结合上图中给出的信息,写出该题的三段式。教师走进学生小组讨论中,寻找不同解题方法的学生。询问是否有同学用了不同的方法来算?引导学生根据公式n=C·V,对于同一化学反应,V相同,n与C成正比,那么是否可以用C始、△C及C末来计算呢?引出第二种计算方法强调起始量、变化量、末尾量三者物理量及单位要统一
小组自主探究,讨论学习,达成共识。经过激烈的讨论,有以下两(或三)种方法,请每组派代表发言,看看哪一组才是正确的?×错误思路:误将10min后CO2
的浓度当成物质的量带入三段式。CO(g)
+
H2O(g)
CO2(g)
+
H2(g)n始(mol)
0.2
0.2
0
0△n(mol)
0.03
0.03
0.03
0.03
n末(mol)
0.17
0.17
0.03
0.03√正确思路一:先求出n末(CO2)=
C末(CO2)×V
=
0.03mol/L×5L
=
0.15mol,再代入三段式:CO(g)
+
H2O(g)
CO2(g)
+
H2(g)n始(mol)
0.2
0.2
0
0△n(mol)
0.15
0.15
0.15
0.15
n末(mol)
0.05
0.05
0.15
0.15v(H2O)
=
△C(H2O)
=
△n(H2O)
△t
V·△t=
0.15mol
=
0.003
mol/(L·min)5L×10
minC末(H2)
=
n末(H2)=
0.15mol
=
0.03
mol/L
V
5Lα(CO)=△n(CO)×100%
=
0.15mol×100%
=
75%n始(CO)
0.2mol√正确思路二:先求出C始(CO)=n始(CO)=0.2mol
=
0.04mol/L
V
5LC始(H2O)=n始(H2O)
=
0.2mol
=
0.04mol/L,V
5L再代入三段式:
CO(g)
+
H2O(g)
CO2(g)
+
H2(g)C始(mol/L)
0.04
0.04
0
0△C(mol/L)
0.03
0.03
0.03
0.03
C末(mol/L)
0.01
0.01
0.03
0.03
v(H2O)=△C(H2O)
=
0.03mol/L
=0.003
mol/(L·min)
△t
10
minC末(H2)
=
0.03
mol/Lα(CO)=△C(CO)×100%=0.03mol/L×100%
=
75%C始(CO)
0.04mol/L填写学案基本步骤中的空格以及注意事项1:2.……(或C始、△C及C末)……3.……(或C始与C末的差的绝对值等于△C)…(或△C)……1.起始量、变化量、末尾量三者物理量及单位要统一,都是物质的量或物质的量浓度,否则无法计算。
根据例题1中介绍的基本步骤,举一反三。使学生们的思维发生碰撞,产生知识的火花。这是学生们最可能犯的错误。经过讨论得出来的正确答案,往往比老师讲解得来的答案,印象深刻。培养学生一题多解的能力。总结出,三段式的两种切入点,虽然所用的物理量不一样,但是计算出的结果是一模一样的,切记,一定要统一物理量及单位。
学生分组自主探究【例题3】,教师指导。(约6min)
【投影】在2L容器中,某可逆反应从0—2分钟进行过程中,
在不同反应时间各物质的量的变化情况如图所示。则该反应的的反应物是
,生成物是
,化学方程式为
;反应开始至2分钟时,C的反应速率为
;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了
状态。指导学生读图,分析A、B的物质的量随着反应的进行逐渐减少,为反应物;C的物质的量随着反应的进行逐渐增多,为反生成物。根据题意,依次在反应方程式下列出各反应物和生成物的n始、n末。根据n始与n末的差的绝对值等于△n填空再根据△n
之比等于对应物质的化学计量数之比,推到出该反应的化学方程式。
小组自主探究,讨论学习,达成共识。
___
A
+
___
B
___
C
n始(mol)
5
2
2
△n(mol)
n末(mol)
3
1
4
2
A
+
B
2
C
n始(mol)
5
2
2
△n(mol)
2
1
2
n末(mol)
3
1
4
v(C)=△C(C)
=△n(C)
=
2mol
=
0.5
mol/(L·min)
△t
V·△t
2L×2
min2分钟后,各组分的物质的量不再改变,说明已达到了化学平衡状态。
前两个例题都是已知化学方程式,计算化学反应速率及转化率等,该题首先通过读图,分析出反应物和生成物,再通过列出三段式,最后逆向思维推出反应的化学方程式。培养读图能力,复习化学平衡状态的判断依据。
学生分组自主探究【例题4】,教师指导。(约10min)
【投影】氢气是合成氨的重要原料,合成氨反应的化学方程式如下:N2(g)+3H2(g)2NH3(g)。(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。图中表示反应处于化学平衡状态的时间段(t1时刻后)为 。指导学生读图,复习化学平衡状态的判断依据。(2)在一定温度下,向一个容积为1
L的固定容器中通入2
mol氮气和8
mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%,N2的转化率为 。指导学生设未知数时,按照化学计量数之比,设△n分别为x、3x、2x根阿伏伽德罗定律的推论,恒温、恒容时混合气体的压强与其物质的量成正比:
?小组自主探究,讨论学习,达成共识。学生通过读图,分析出t2-t3、t4-t5中正逆反应速率相等,则表示已达到化学平衡状态。N2
(g)
+
3H2(g)
2NH3(g)n始(mol)
2
8
0
△n(mol)
n末(mol)
N2
(g)
+
3H2(g)
2NH3(g)n始(mol)
2
8
0
△n(mol)
x
3x
2x
n末(mol)
2-x
8-3x
2x
P末=
n末
80%=(2-x+8-3x+2x)mol
P始
n始
(2+8)
mol
x=1α(H2)
=
△n(H2)×100%
=
1mol×100%
=
50%n始(H2)
2mol填写学案基本步骤中的空格:2.……未知量可以设未知数表示;
培养读图能力,复习化学平衡状态的判断依据。遇到只告诉开始的物理量和压强比或者体积比的题目,需要设未知数进行计算。复习阿伏伽德罗定律的推论。
课堂小结(约3min)
提问:不同物质的起始量或末尾量与化学计量数有没有关系?总结:通过本节课学习“三段式”法在化学反应速率计算中的应用,同学们有没有觉得,计算也没有那么难?有没有觉得这是一个神奇的方法?希望大家课下再巩固、练习,将上次作业中的错题订正,为我们高二的学习奠定基础,
回顾例题1-2,思考,回答,没有关系。
填写学案注意事项中的空格:2.起始量、变化量、末尾量中,只有不同物质的变化量之比等于对应物质的化学计量数之比,不同物质的起始量或末尾量与化学计量数没有必然的关系,不能列比例计算。
学生学有所获,自己觉得很开心。
很多学生会认为起始量或末尾量之比等于化学计量数之比,这也是一个常见的误区。增加学生的自信心。再次加强巩固、练习,返回到加这一个课时的本意,解决问题。
六、教学设计反思
本课教学设计根据新课程倡导的以学生探究学习为主,教师指导为辅的理念,精选一道例题教师讲解,三道例题创设小组探究学习的情境,激发学生的学习兴趣,共同探讨如何利用三段式法解决化学反应速率计算中的相关问题,真正使学生转变思维方式,打开突破计算题的新视角。通过教学实践,我认为自己做的好的方面有:
1.依法治校,注重教育公平,因材施教
因为所教班级为普通班,学生基础较薄弱,所以教学进度适当的慢一点是可以的,针对学生在练习中体现出的问题,发现问题、解决问题,加了这一个课时,恰恰是因材施教,注重教育公平的最好体现,也是实践党中央依法治校的好机会。
2.小专题,大智慧
化学反应速率的计算,从工作开始的第一届学生到现在,每一届都会讲,但是之前的每一届都没有讲精,以至于好像什么都讲了,但学生还是怕,看到计算题就怕,稍微难一点的立即放弃,也许是当老师的觉得简单,就讲得快,恰恰忽略了这样的小专题,通过这一次精选例题,发现里面也有大智慧。今后的教学中,应该学会善于发现类似的小专题,组个突破,让学生感受到学习化学是有成就感的。
3.自主学习、探究学习,乐在其中
新课程改革倡导学生主动参与、乐于探究、培养学生分析和解决问题的能力以及交流与合作的能力。本节课力求使得学生在自主学习和探究合作学习的轻松切换中,成为自我引导的学习者、思考者,信息的使用者和生产者,学习的合作者和问题的解决者,而老师则是学生学习坚定的支持者、合作者和评价者。例题2的设计使学生思维碰撞出火花,产生争论,最后通过小组代表发言,说服其他组,学生会很有成就感,乐在其中。
4.利用多媒体和学案,辅助教学
本节课充分利用了多媒体技术的强大显示功能,不但将例题通过PPT投影,还利用电子白板笔可以直接在白板上书写,后期需要,还可翻看之前的板书。同时,准备学案,让学生能直观快速的看这例题讨论,并作答。
虽然课前做了精心的准备,但在实际的教学中还是凸显出了一些不足:
1.例题2讨论的时间过长,今后要注意把握好整节课的节奏。
2.例题3最初的设计是直接问该反应的化学方程式为,让部分学生又摸不清方向,后来修改为增加反应物和生成物分别是什么两问,让学生更容易上手。
通过本节课的教学设计,自己也成长了不少,愿每天心中开出一朵花,用此美丽的心情发现更多的小专题,哺育学生茁壮成长。
七、附学生学案:《“三段式”法在化学反应速率计算中的应用》
一.基本步骤:
1.写出正确的
;
2.根据题意,依次在反应方程式下列出各反应物和生成物的
、
及
(或
、
及
),未知量可以
表示;
3.根据
与
的差的绝对值等于
(或
与
的差的绝对值等于
)、
(或
)之比等于对应物质的
之比,列出关系式计算。
二.注意事项
1.起始量、变化量、末尾量三者
及
要统一,都是物质的量或物质的量浓度,否则无法计算。
2.起始量、变化量、末尾量中,只有不同物质的
之比等于对应物质的
之比,不同物质的起始量或末尾量与化学计量数没有必然的关系,不能列比例计算。
【例题1】一定条件下,向2L容器中通入3
mol氮气和10
mol氢气及催化剂反应,2
min
后,生成氨气的物质的量为2
mol,0-2min则内v(NH3)=___________,
2
min
末,C(N2)=____________,H2
的转化率为________。
N2
(g)
+
3H2(g)2NH3(g)
n始(mol)
3
10
0
△n(mol)
n末(mol)
2
【例题2】在某一容积为5
L的密闭容器内,加入0.2
mol的CO和0.2
mol的H2O(g),在催化剂存在的条件下高温加热,发生如下反应:CO(g)+H2O(g)
CO2(g)+H2(g),反应放出热量。反应中CO2的浓度随时间变化的情况如图所示:根据图中数据,从反应开始至达到平衡时,H2O的化学反应速率为________________________;反应平衡时c(H2)=______________,CO的转化率为______________。
【例题3】在2L容器中,某可逆反应从0—2分钟进行过程中,
在不同反应时间各物质的量的变化情况如右图所示。则该反应的的反应物是
,生成物是
,化学方程式为
;反应开始至2分钟时,C的反应速率为
;2分钟后A、B、C各物质的量不再随时间的变化而变化,说明在这个条件下,反应已达到了
状态。
【例题4】氢气是合成氨的重要原料,合成氨反应的化学方程式如下:N2(g)+3H2(g)2NH3(g)。
(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如图所示。图中表示反应处于化学平衡状态的时间段(t1时刻后)为 。
(2)在一定温度下,向一个容积为1
L的固定容器中通入2
mol氮气和8
mol氢气及固体催化剂,使之反应。已知平衡时容器内气体的压强为起始时的80%,N2的转化率为 。?
