鲁教版九年级下册化学 第九单元 金属 复习课件(19张PPT)
文档属性
| 名称 | 鲁教版九年级下册化学 第九单元 金属 复习课件(19张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-12 00:00:00 | ||
图片预览




文档简介
(共19张PPT)
52页
54页
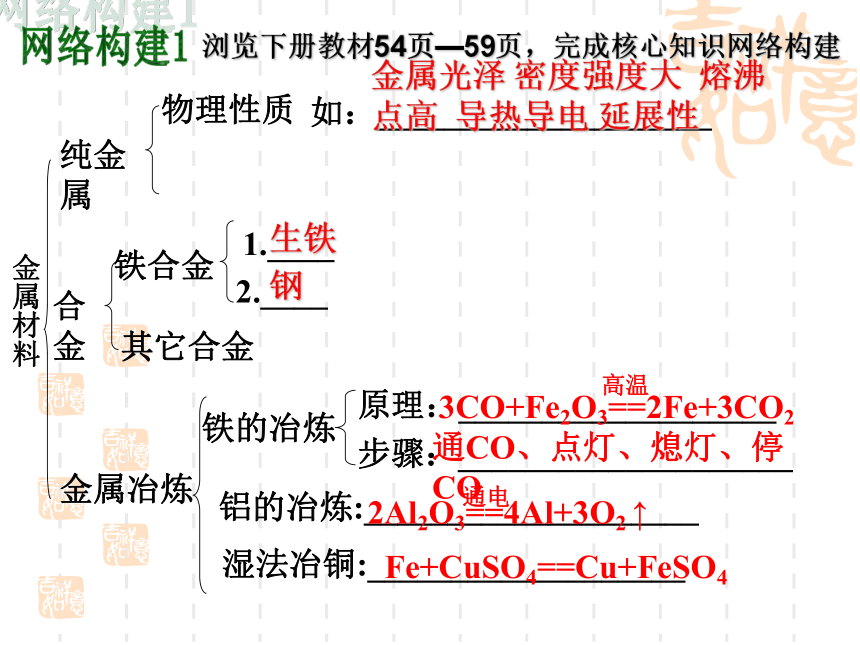
金属材料
纯金属
合金
物理性质
如:____________________
铁合金
1.____
2.____
其它合金
金属冶炼
原理:___________________
步骤:____________________
金属光泽
密度强度大
熔沸点高
导热导电
延展性
生铁
钢
3CO+Fe2O3==2Fe+3CO2
高温
通CO、点灯、熄灯、停CO
铁的冶炼
铝的冶炼:____________________
湿法冶铜:___________________
2Al2O3==4Al+3O2
↑
通电
Fe+CuSO4==Cu+FeSO4
浏览下册教材54页—59页,完成核心知识网络构建
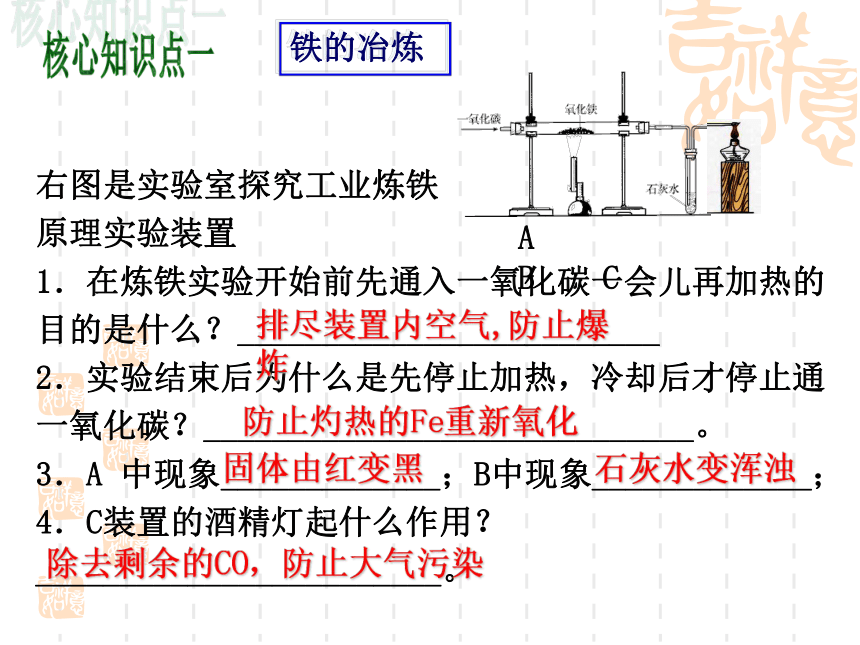
右图是实验室探究工业炼铁
原理实验装置
1.在炼铁实验开始前先通入一氧化碳一会儿再加热的目的是什么?_________________________
2.实验结束后为什么是先停止加热,冷却后才停止通一氧化碳?_____________________________。
3.A
中现象_____________;B中现象_____________;
4.C装置的酒精灯起什么作用?________________________。
A
B
C
固体由红变黑
石灰水变浑浊
排尽装置内空气,防止爆炸
铁的冶炼
防止灼热的Fe重新氧化
除去剩余的CO,防止大气污染
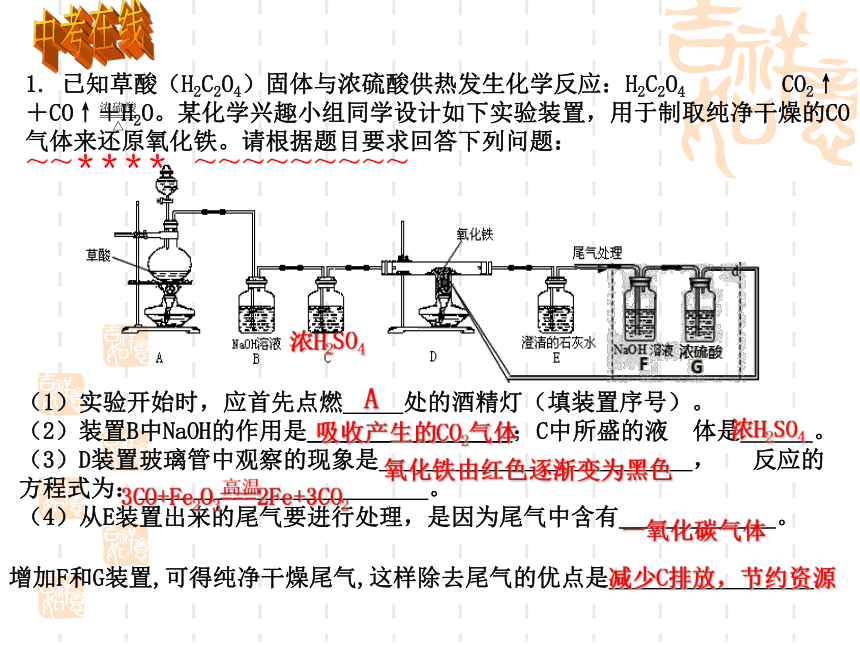
~~**** ~~~~~~~~~
一氧化碳气体
高温
3CO+Fe2O3===2Fe+3CO2
氧化铁由红色逐渐变为黑色
浓H2SO4
吸收产生的CO2气体
A
增加F和G装置,可得纯净干燥尾气,这样除去尾气的优点是_________________.
减少C排放,节约资源
浓H2SO4
(1)实验开始时,应首先点燃_____处的酒精灯(填装置序号)。
(2)装置B中NaOH的作用是_________________;C中所盛的液
体是______。
(3)D装置玻璃管中观察的现象是__________________________,
反应的方程式为:________________________。
(4)从E装置出来的尾气要进行处理,是因为尾气中含有_____________。
1.
已知草酸(H2C2O4)固体与浓硫酸供热发生化学反应:H2C2O4
CO2↑+CO↑+H2O。某化学兴趣小组同学设计如下实验装置,用于制取纯净干燥的CO气体来还原氧化铁。请根据题目要求回答下列问题:
金属材料
纯金属
合金
物理性质
如:____________________
化学性质
1.__________
2.__________
3.__________
铁合金
1.____
2.____
其它合金
金属冶炼
原理:____________
步骤:____________
金属光泽
密度强度大
熔沸点高
导热导电
延展性
氧化反应
与酸反应
与盐反应
生铁
钢
3CO+Fe2O3==2Fe+3CO2
高温
通CO、点灯、熄灯、停CO
金属活动性顺序:____________________________
铁的冶炼
铝的冶炼:_________________
湿法冶铜:_________________
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
2Al2O3==4Al+3O2
↑
通电
Fe+CuSO4==Cu+FeSO4
浏览教材61页—65页,补充完善核心知识网络构建
置换反应:A+BC=______
B+AC
金属的活动性顺序
k
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
金属活动性由强逐渐减弱
1.
常见金属的活动性顺序
能置换酸溶液中的氢
不能与酸反应
前面的金属能将后面的金属从其盐溶液中置换出来
置换反应前提
(1)金属和氧气的反应
(2)金属与酸的反应
(3)金属与盐的反应
按要求写出下列反应的化学方程式。
铝在氧气中点燃:__________________
铁在氧气中点燃:__________________
铁和盐酸反应:____________________
锌和硫酸反应:____________________
铁和硫酸铜溶液反应:_________________
铜和硝酸银溶液反应:_________________
2.
金属的活动性顺序应用
4Al+3O2==2Al2O3
1、现有X、Y、Z
三种金属,将X、Y分别放入稀硫酸中,结果Y表面产生气泡,X表面无明显现象;另取X放入Z的盐溶液中,结果X表面有Z析出。则X、Y、Z三种金属的活动性顺序是(
)
A.
Y>Z>X
B.
X>Y>Z
C.
X>Z>Y
D.
Y>X>Z
D
2、验证金属
Mg、Fe、Cu的活动性强弱,下列方案不能达到目的的是
(
)
A.
Mg、FeSO4溶液、Cu;
B.
MgCl2、Fe、Cu(NO3)2溶液;
C.
Mg、Fe、Cu、稀盐酸
D.
MgSO4溶液、Fe、Cu.
D
中间盐
两边金
中间金
两边盐
反应剧烈程度不同
3.
在盛有AgNO3和Mg(NO3)2的混合溶液的试管中,加入一定量的锌粉,充分反应后试管底部有少量的金属析出,过滤后,往滤液中滴加盐酸,有白色沉淀生成,则析出的少量金属一定有
(
)
A.
Mg
B.
Ag
C.
Zn和Ag
D.
Zn和Mg
固体:Ag
溶质:Zn2+
Mg2+
Ag+
NO3—
固体:Ag
溶质:Zn2+
Mg2+
NO3—
固体:Ag
Zn
溶质:Zn2+
Mg2+
NO3—
B
4.
根据金属活动顺序表的的有关知识,回答下列问题:
(1)用Mg、Zn、Cu三种金属分别于稀盐酸反应,根据金属与稀盐酸反应的_____________,可以判断金属活动性强弱的顺序。
(2)用Zn分别与MgCl2、CuCl2溶液反应,也能判断金属活动性顺序,其反应的化学方程式为______________,三种金属活动性由强到弱的顺序为
__________。若将一定质量的Zn放入CuCl2和MgCl2的混合溶液中,充分反应后过滤,所得固体中一定含有的物质是_________。
剧烈程度不同
Mg>Zn>Cu
Cu
Zn+CuCl2=Cu+ZnCl2
金属材料
纯金属
合金
物理性质
如:____________________
化学性质
1.____________
2.____________
3.____________
铁合金
1.____
2.____
其它合金
金属冶炼
原理:____________
步骤:____________
钢铁的锈蚀与防护
锈蚀因素:_____和_____等
防锈措施:_______、_____等
金属光泽
密度强度大
熔沸点高
导热导电
延展性
氧化反应
与酸反应
与盐反应
生铁
钢
3CO+Fe2O3==2Fe+3CO2
高温
通CO、点灯、熄灯、停CO
氧气
水
涂保护层
铐蓝
金属活动性顺序:____________________________
置换反应:A+BC=______
铁的冶炼
铝的冶炼
湿法炼铜
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
2Al2O3==4Al+3O2
↑
通电
Fe+CuSO4==Cu+FeSO4
B+AC
废旧金属的回收利用
浏览教材67页—70页,补充完善核心知识网络构建
某学习小组用相同的光亮铁钉探究铁生锈与哪些因素有关,设计的实验如图所示:
(1)一周后观察:试管①和③中的铁钉无明显变化,试管②中的铁钉明显生锈.探究发现铁生锈的主要条件是铁与____和_____直接接触,其中铁钉中的A、B、C三处中___处锈蚀最严重。若该试管中加少量盐溶液,会______生锈速率。
(2)试管①中加入的蒸馏水要事先煮沸,其目的是除去____________。
(3)沙漠地区的铁制品锈蚀较慢的原因是__________。
空气
B
水中的氧气
空气干燥
钢铁的锈蚀
水
加快
1.探究铜生成铜绿的条件
【查阅资料】铜绿的化学式是Cu2(OH)2CO3,它受热会分解生成三种氧化物。铜绿分解的化学方程式为____________________。
【猜想与假设】据铜绿的组成和查阅的资料判断,铜绿可能是铜与氧气及_____和________共同作用而形成的。
【设计与实验】借鉴课本“铁钉锈蚀条件的探究”实验,小梁设计了“铜片锈蚀条件的探究”实验,实验如下图所示:
实验较长时间后,发现???试管中铜片最先生锈(填试管字母编号)。
【评价与改进】?小区认为小梁设计的实验还不够完善,要得出正确的结论,还要补充一个实验。你认为要补充的一个实验是(用图表示亦可)___________________________________________。
Cu2(OH)2CO3△2CuO+H2O+CO2↑
水
D
把铜片置于装有干燥空气(或氧气和二氧化碳)的试管中,放置对比观察
二氧化碳
金属材料
纯金属
合金
物理性质
如:____________________
化学性质
1.____________
2.____________
3.____________
铁合金
1.____
2.____
其它合金
金属冶炼
原理:____________
步骤:____________
钢铁的锈蚀与防护
锈蚀因素:_____和_____等
防锈措施:_______、_____等
金属光泽
密度强度大
熔沸点高
导热导电
延展性
氧化反应
与酸反应
与盐反应
生铁
钢
3CO+Fe2O3==2Fe+3CO2
高温
通CO、点灯、熄灯、停CO
氧气
水
涂保护层
铐蓝
金属活动性顺序:____________________________
置换反应:A+BC=______
铁的冶炼
铝的冶炼
湿法炼铜
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
2Al2O3==4Al+3O2
↑
通电
Fe+CuSO4==Cu+FeSO4
B+AC
废旧金属的回收利用
浏览教材67页—70页,补充完善核心知识网络构建
1.有图为A~D物之间的转化关系,部分转化条件未标出。已知:A为黑色固体单质,B为红色粉末,A、D形成的合金是生产、生活中使用最多的金属材料,甲为常见的气体单质。请按要求完成下列空白:
(1)A的原子结构示意图为_______
(2)B+C=D+E的化学方程式为_______________________,
该反应_____(填“是”或“不是”)置换反应
(3)E与Ba(OH)2溶液反应的化学方程式为_______________________________
Fe2O3+3CO====2Fe+3CO2
高温
不是
CO2+Ba(OH)2=BaCO3↓+H2O
2.
A、B、C、D为金属活动顺序表中常见的四种金属。已知:①A+BSO4=ASO4+B
②C+H2SO4=CSO4+H2↑
③B+2DNO3=B(NO3)2+2D
请完成以下填空:
(1)金属C在金属活动顺序表中排在氢______(填“前面”或“后面”)。
(2)根据上述反应能判断出其中三种金属的活动性,其金属活动性由强到弱的顺序是______(用字母填写)。
(3)若A、B、C、D分别为锌、铁、铜、银中的一种,金属C与H2SO4反应后所得溶液呈浅绿色,则金属A为____,反应③的化学方程式为_______________。
前面
A>B>D
Zn
Cu+2AgNO3=2Ag+Cu(NO3)2
52页
54页
金属材料
纯金属
合金
物理性质
如:____________________
铁合金
1.____
2.____
其它合金
金属冶炼
原理:___________________
步骤:____________________
金属光泽
密度强度大
熔沸点高
导热导电
延展性
生铁
钢
3CO+Fe2O3==2Fe+3CO2
高温
通CO、点灯、熄灯、停CO
铁的冶炼
铝的冶炼:____________________
湿法冶铜:___________________
2Al2O3==4Al+3O2
↑
通电
Fe+CuSO4==Cu+FeSO4
浏览下册教材54页—59页,完成核心知识网络构建
右图是实验室探究工业炼铁
原理实验装置
1.在炼铁实验开始前先通入一氧化碳一会儿再加热的目的是什么?_________________________
2.实验结束后为什么是先停止加热,冷却后才停止通一氧化碳?_____________________________。
3.A
中现象_____________;B中现象_____________;
4.C装置的酒精灯起什么作用?________________________。
A
B
C
固体由红变黑
石灰水变浑浊
排尽装置内空气,防止爆炸
铁的冶炼
防止灼热的Fe重新氧化
除去剩余的CO,防止大气污染
~~**** ~~~~~~~~~
一氧化碳气体
高温
3CO+Fe2O3===2Fe+3CO2
氧化铁由红色逐渐变为黑色
浓H2SO4
吸收产生的CO2气体
A
增加F和G装置,可得纯净干燥尾气,这样除去尾气的优点是_________________.
减少C排放,节约资源
浓H2SO4
(1)实验开始时,应首先点燃_____处的酒精灯(填装置序号)。
(2)装置B中NaOH的作用是_________________;C中所盛的液
体是______。
(3)D装置玻璃管中观察的现象是__________________________,
反应的方程式为:________________________。
(4)从E装置出来的尾气要进行处理,是因为尾气中含有_____________。
1.
已知草酸(H2C2O4)固体与浓硫酸供热发生化学反应:H2C2O4
CO2↑+CO↑+H2O。某化学兴趣小组同学设计如下实验装置,用于制取纯净干燥的CO气体来还原氧化铁。请根据题目要求回答下列问题:
金属材料
纯金属
合金
物理性质
如:____________________
化学性质
1.__________
2.__________
3.__________
铁合金
1.____
2.____
其它合金
金属冶炼
原理:____________
步骤:____________
金属光泽
密度强度大
熔沸点高
导热导电
延展性
氧化反应
与酸反应
与盐反应
生铁
钢
3CO+Fe2O3==2Fe+3CO2
高温
通CO、点灯、熄灯、停CO
金属活动性顺序:____________________________
铁的冶炼
铝的冶炼:_________________
湿法冶铜:_________________
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
2Al2O3==4Al+3O2
↑
通电
Fe+CuSO4==Cu+FeSO4
浏览教材61页—65页,补充完善核心知识网络构建
置换反应:A+BC=______
B+AC
金属的活动性顺序
k
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
金属活动性由强逐渐减弱
1.
常见金属的活动性顺序
能置换酸溶液中的氢
不能与酸反应
前面的金属能将后面的金属从其盐溶液中置换出来
置换反应前提
(1)金属和氧气的反应
(2)金属与酸的反应
(3)金属与盐的反应
按要求写出下列反应的化学方程式。
铝在氧气中点燃:__________________
铁在氧气中点燃:__________________
铁和盐酸反应:____________________
锌和硫酸反应:____________________
铁和硫酸铜溶液反应:_________________
铜和硝酸银溶液反应:_________________
2.
金属的活动性顺序应用
4Al+3O2==2Al2O3
1、现有X、Y、Z
三种金属,将X、Y分别放入稀硫酸中,结果Y表面产生气泡,X表面无明显现象;另取X放入Z的盐溶液中,结果X表面有Z析出。则X、Y、Z三种金属的活动性顺序是(
)
A.
Y>Z>X
B.
X>Y>Z
C.
X>Z>Y
D.
Y>X>Z
D
2、验证金属
Mg、Fe、Cu的活动性强弱,下列方案不能达到目的的是
(
)
A.
Mg、FeSO4溶液、Cu;
B.
MgCl2、Fe、Cu(NO3)2溶液;
C.
Mg、Fe、Cu、稀盐酸
D.
MgSO4溶液、Fe、Cu.
D
中间盐
两边金
中间金
两边盐
反应剧烈程度不同
3.
在盛有AgNO3和Mg(NO3)2的混合溶液的试管中,加入一定量的锌粉,充分反应后试管底部有少量的金属析出,过滤后,往滤液中滴加盐酸,有白色沉淀生成,则析出的少量金属一定有
(
)
A.
Mg
B.
Ag
C.
Zn和Ag
D.
Zn和Mg
固体:Ag
溶质:Zn2+
Mg2+
Ag+
NO3—
固体:Ag
溶质:Zn2+
Mg2+
NO3—
固体:Ag
Zn
溶质:Zn2+
Mg2+
NO3—
B
4.
根据金属活动顺序表的的有关知识,回答下列问题:
(1)用Mg、Zn、Cu三种金属分别于稀盐酸反应,根据金属与稀盐酸反应的_____________,可以判断金属活动性强弱的顺序。
(2)用Zn分别与MgCl2、CuCl2溶液反应,也能判断金属活动性顺序,其反应的化学方程式为______________,三种金属活动性由强到弱的顺序为
__________。若将一定质量的Zn放入CuCl2和MgCl2的混合溶液中,充分反应后过滤,所得固体中一定含有的物质是_________。
剧烈程度不同
Mg>Zn>Cu
Cu
Zn+CuCl2=Cu+ZnCl2
金属材料
纯金属
合金
物理性质
如:____________________
化学性质
1.____________
2.____________
3.____________
铁合金
1.____
2.____
其它合金
金属冶炼
原理:____________
步骤:____________
钢铁的锈蚀与防护
锈蚀因素:_____和_____等
防锈措施:_______、_____等
金属光泽
密度强度大
熔沸点高
导热导电
延展性
氧化反应
与酸反应
与盐反应
生铁
钢
3CO+Fe2O3==2Fe+3CO2
高温
通CO、点灯、熄灯、停CO
氧气
水
涂保护层
铐蓝
金属活动性顺序:____________________________
置换反应:A+BC=______
铁的冶炼
铝的冶炼
湿法炼铜
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
2Al2O3==4Al+3O2
↑
通电
Fe+CuSO4==Cu+FeSO4
B+AC
废旧金属的回收利用
浏览教材67页—70页,补充完善核心知识网络构建
某学习小组用相同的光亮铁钉探究铁生锈与哪些因素有关,设计的实验如图所示:
(1)一周后观察:试管①和③中的铁钉无明显变化,试管②中的铁钉明显生锈.探究发现铁生锈的主要条件是铁与____和_____直接接触,其中铁钉中的A、B、C三处中___处锈蚀最严重。若该试管中加少量盐溶液,会______生锈速率。
(2)试管①中加入的蒸馏水要事先煮沸,其目的是除去____________。
(3)沙漠地区的铁制品锈蚀较慢的原因是__________。
空气
B
水中的氧气
空气干燥
钢铁的锈蚀
水
加快
1.探究铜生成铜绿的条件
【查阅资料】铜绿的化学式是Cu2(OH)2CO3,它受热会分解生成三种氧化物。铜绿分解的化学方程式为____________________。
【猜想与假设】据铜绿的组成和查阅的资料判断,铜绿可能是铜与氧气及_____和________共同作用而形成的。
【设计与实验】借鉴课本“铁钉锈蚀条件的探究”实验,小梁设计了“铜片锈蚀条件的探究”实验,实验如下图所示:
实验较长时间后,发现???试管中铜片最先生锈(填试管字母编号)。
【评价与改进】?小区认为小梁设计的实验还不够完善,要得出正确的结论,还要补充一个实验。你认为要补充的一个实验是(用图表示亦可)___________________________________________。
Cu2(OH)2CO3△2CuO+H2O+CO2↑
水
D
把铜片置于装有干燥空气(或氧气和二氧化碳)的试管中,放置对比观察
二氧化碳
金属材料
纯金属
合金
物理性质
如:____________________
化学性质
1.____________
2.____________
3.____________
铁合金
1.____
2.____
其它合金
金属冶炼
原理:____________
步骤:____________
钢铁的锈蚀与防护
锈蚀因素:_____和_____等
防锈措施:_______、_____等
金属光泽
密度强度大
熔沸点高
导热导电
延展性
氧化反应
与酸反应
与盐反应
生铁
钢
3CO+Fe2O3==2Fe+3CO2
高温
通CO、点灯、熄灯、停CO
氧气
水
涂保护层
铐蓝
金属活动性顺序:____________________________
置换反应:A+BC=______
铁的冶炼
铝的冶炼
湿法炼铜
K
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
(H)
Cu
Hg
Ag
Pt
Au
2Al2O3==4Al+3O2
↑
通电
Fe+CuSO4==Cu+FeSO4
B+AC
废旧金属的回收利用
浏览教材67页—70页,补充完善核心知识网络构建
1.有图为A~D物之间的转化关系,部分转化条件未标出。已知:A为黑色固体单质,B为红色粉末,A、D形成的合金是生产、生活中使用最多的金属材料,甲为常见的气体单质。请按要求完成下列空白:
(1)A的原子结构示意图为_______
(2)B+C=D+E的化学方程式为_______________________,
该反应_____(填“是”或“不是”)置换反应
(3)E与Ba(OH)2溶液反应的化学方程式为_______________________________
Fe2O3+3CO====2Fe+3CO2
高温
不是
CO2+Ba(OH)2=BaCO3↓+H2O
2.
A、B、C、D为金属活动顺序表中常见的四种金属。已知:①A+BSO4=ASO4+B
②C+H2SO4=CSO4+H2↑
③B+2DNO3=B(NO3)2+2D
请完成以下填空:
(1)金属C在金属活动顺序表中排在氢______(填“前面”或“后面”)。
(2)根据上述反应能判断出其中三种金属的活动性,其金属活动性由强到弱的顺序是______(用字母填写)。
(3)若A、B、C、D分别为锌、铁、铜、银中的一种,金属C与H2SO4反应后所得溶液呈浅绿色,则金属A为____,反应③的化学方程式为_______________。
前面
A>B>D
Zn
Cu+2AgNO3=2Ag+Cu(NO3)2
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
