人教版高中化学选修4第四章第四节 金属的电化学腐蚀与防护(共20张PPT)
文档属性
| 名称 | 人教版高中化学选修4第四章第四节 金属的电化学腐蚀与防护(共20张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 891.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-13 00:00:00 | ||
图片预览








文档简介
(共20张PPT)
【小测】写出以下溶液的电解总反应式
①NaCl(水溶液)
②
NaCl(熔融)
③Al2O3(熔融)
2NaCl+2H2O
=
2NaOH+H2↑+Cl2↑
电解
电解
阳极:
6O
2-
-12e-
=
3
O2↑
阴极:
4Al3+
+
12e-
=
4Al
总反应:
阳极:
2Cl
-
-2e-
=
Cl2↑
阴极:
2Na+
+
2e-
=
2Na
总反应:
电解
第4节:金属的电化学腐蚀与防护
钢铁生锈
金属的腐蚀在生活中非常普遍
铜器生锈
铜器表面生成铜绿
2007年8月1日,美国明尼苏达州一座跨越密西西比河的大桥发生坍塌。事故造成6人死亡。
【阅读课本】P84-85回答以下问题:
1.
什么是金属腐蚀?其本质是什么?
2.
金属的腐蚀可分为化学腐蚀和电化学腐蚀,两者有何不同?
3.
电化学腐蚀(以钢铁腐蚀为例)可分为哪些种类?它们的区别在哪里?
一、金属的电化学腐蚀
一、什么是金属腐蚀?其本质是什么?
1.
概念:金属与周围的气体或液体物质发生氧化还原反应而引起损耗的现象
2.
本质:
金属原子失去电子被氧化的过程
二、金属腐蚀的类型
1.化学腐蚀:
SO2等)
或非电解液(如石油)等直接发生反应而引起的腐蚀
金属与接触到的干燥气体(如O2、Cl2
2.电化学腐蚀:
会发生原电池反应,比较活泼的金属失电子而被
氧化的腐蚀
不纯的金属跟电解质溶液接触时,
金属跟干燥气体或非电解质液体直接接触
不纯金属或合金
跟电解质溶液接触
无电流产生
有微弱电流产生
金属被氧化
较活泼金属被氧化
与接触物质的氧化性及温度有关
与电解质溶液的酸碱性及金属活性有关
两者往往同时发生,电化学腐蚀更普遍
化学腐蚀
电化学腐蚀
条件
现象
本质
影响
因素
联系
三、电化学腐蚀(金属腐蚀)的分类
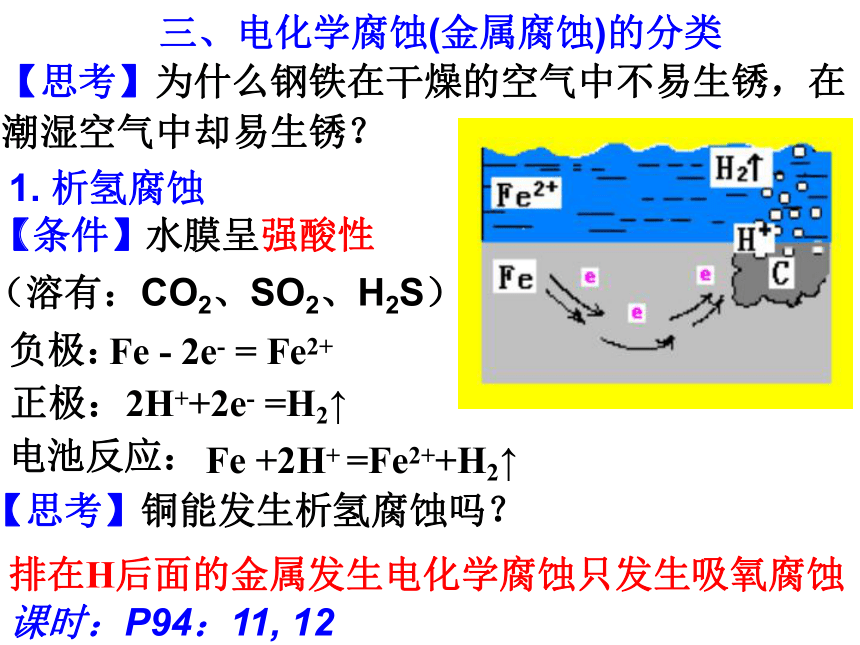
【思考】为什么钢铁在干燥的空气中不易生锈,在潮湿空气中却易生锈?
1.
析氢腐蚀
【条件】
(溶有:CO2、SO2、H2S)
水膜呈强酸性
正极:
负极:
电池反应:
Fe
-
2e-
=
Fe2+
2H++2e-
=H2↑
Fe
+2H+
=Fe2++H2↑
【思考】铜能发生析氢腐蚀吗?
排在H后面的金属发生电化学腐蚀只发生吸氧腐蚀
课时:P94:11,
12
三、电化学腐蚀(金属腐蚀)的分类
2.
吸氧腐蚀
【条件】
性或碱性
水膜呈中性或弱酸
负极:
正极:
电池反应:
进一步:
2Fe
-
4e-
=
2Fe2+
O2
+
2H2O
+
4e-
=
4OH-
2Fe+
O2+2H2O
=2Fe(OH)2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
2Fe(OH)3
=
Fe2O3·nH2O
+
(3-n)H2O
吸氧腐蚀实验
导管内水柱上升
【交流讨论】属部件采用了什么样的防护措施吗?
烤蓝是用化学方法在铁表面"镀"上一层致密的四氧化三铁(Fe3O4)
四、金属的防护
1、目的:
2、依据:
3、方法:
(1)制耐腐蚀合金:不锈钢等
(2)隔离法防护:电镀、喷漆、涂油等
(3)电化学保护法:
防止金属被氧化
依据金属腐蚀的化学反应原理和腐蚀类型来确定金属防护的方法
【阅读课本】P86,填空:
五、金属的电化学防护
1.牺牲阳极的阴极保护法
原理:
应用
原理,让被保护金属作
极,
原电池
正
负
找另一种活泼性较强金属作
级
原理:应用
原理,将被保护的钢铁设备做
极,用惰性电极做辅助
极,在外加直流电作用下,电子被迫流向被保护的钢铁设备,使钢铁表面的腐蚀电流降至零或接近等于零。
2.
外加电流的阴极保护法
阴
阳
电解池
1.牺牲阳极的阴极保护法
原理:
用
原理,被保护金属作
极(阴极),
原电池
正
负
找较活泼金属作
极(阳极),牺牲阳极
原理:用
原理,将被保护的钢铁设备做
极,用惰性电极做辅助
极,在外加直流电作用下,电子被迫流向
钢铁设备,使钢铁表面的腐蚀电流降至零或接近等于零。
2.
外加电流的阴极保护法
阴
阳
电解池
被保护的阴极
讨论与交流下列各情况,在其中Fe片腐蚀由快到慢的顺序__________________
(5)>(2)>(1)>(3)>(4)
电解池
电解池
原电池
原电池
小结:金属腐蚀快慢的判断依据:
(1)
活泼性不同的两金属,活泼性差别越大,氧化还原反应的速率越
,活泼金属被腐蚀的速度越
。
(2)
同一电解质溶液中,
电解池原理(阳极)引起的腐蚀
原电池原理(负极)引起的腐蚀
化学腐蚀
有防腐措施的腐蚀(电解池的阴极、原电池的正极及加有镀层的金属)。
(3)
同一种金属的腐蚀:在强电解质中
弱电解质中
非电解质中
>
>
>
>
>
快
快
【练习】下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是________________________
(4)>(2)>(1)>(3)
小结:金属的防护方法
1、在金属表面覆盖保护层:油、油漆、塑料、搪瓷、镀一层金属
2、改变金属的内部组织结构:如制成合金
3、电化学保护法
(1)牺牲阳极的阴极保护法
(原电池原理)
(例:轮船船身上的锌块、地下钢铁管道接镁块)
(2)外加电流的阴极保护法
(电解池原理)
【小测】写出以下溶液的电解总反应式
①NaCl(水溶液)
②
NaCl(熔融)
③Al2O3(熔融)
2NaCl+2H2O
=
2NaOH+H2↑+Cl2↑
电解
电解
阳极:
6O
2-
-12e-
=
3
O2↑
阴极:
4Al3+
+
12e-
=
4Al
总反应:
阳极:
2Cl
-
-2e-
=
Cl2↑
阴极:
2Na+
+
2e-
=
2Na
总反应:
电解
第4节:金属的电化学腐蚀与防护
钢铁生锈
金属的腐蚀在生活中非常普遍
铜器生锈
铜器表面生成铜绿
2007年8月1日,美国明尼苏达州一座跨越密西西比河的大桥发生坍塌。事故造成6人死亡。
【阅读课本】P84-85回答以下问题:
1.
什么是金属腐蚀?其本质是什么?
2.
金属的腐蚀可分为化学腐蚀和电化学腐蚀,两者有何不同?
3.
电化学腐蚀(以钢铁腐蚀为例)可分为哪些种类?它们的区别在哪里?
一、金属的电化学腐蚀
一、什么是金属腐蚀?其本质是什么?
1.
概念:金属与周围的气体或液体物质发生氧化还原反应而引起损耗的现象
2.
本质:
金属原子失去电子被氧化的过程
二、金属腐蚀的类型
1.化学腐蚀:
SO2等)
或非电解液(如石油)等直接发生反应而引起的腐蚀
金属与接触到的干燥气体(如O2、Cl2
2.电化学腐蚀:
会发生原电池反应,比较活泼的金属失电子而被
氧化的腐蚀
不纯的金属跟电解质溶液接触时,
金属跟干燥气体或非电解质液体直接接触
不纯金属或合金
跟电解质溶液接触
无电流产生
有微弱电流产生
金属被氧化
较活泼金属被氧化
与接触物质的氧化性及温度有关
与电解质溶液的酸碱性及金属活性有关
两者往往同时发生,电化学腐蚀更普遍
化学腐蚀
电化学腐蚀
条件
现象
本质
影响
因素
联系
三、电化学腐蚀(金属腐蚀)的分类
【思考】为什么钢铁在干燥的空气中不易生锈,在潮湿空气中却易生锈?
1.
析氢腐蚀
【条件】
(溶有:CO2、SO2、H2S)
水膜呈强酸性
正极:
负极:
电池反应:
Fe
-
2e-
=
Fe2+
2H++2e-
=H2↑
Fe
+2H+
=Fe2++H2↑
【思考】铜能发生析氢腐蚀吗?
排在H后面的金属发生电化学腐蚀只发生吸氧腐蚀
课时:P94:11,
12
三、电化学腐蚀(金属腐蚀)的分类
2.
吸氧腐蚀
【条件】
性或碱性
水膜呈中性或弱酸
负极:
正极:
电池反应:
进一步:
2Fe
-
4e-
=
2Fe2+
O2
+
2H2O
+
4e-
=
4OH-
2Fe+
O2+2H2O
=2Fe(OH)2
4Fe(OH)2+2H2O+O2=4Fe(OH)3
2Fe(OH)3
=
Fe2O3·nH2O
+
(3-n)H2O
吸氧腐蚀实验
导管内水柱上升
【交流讨论】属部件采用了什么样的防护措施吗?
烤蓝是用化学方法在铁表面"镀"上一层致密的四氧化三铁(Fe3O4)
四、金属的防护
1、目的:
2、依据:
3、方法:
(1)制耐腐蚀合金:不锈钢等
(2)隔离法防护:电镀、喷漆、涂油等
(3)电化学保护法:
防止金属被氧化
依据金属腐蚀的化学反应原理和腐蚀类型来确定金属防护的方法
【阅读课本】P86,填空:
五、金属的电化学防护
1.牺牲阳极的阴极保护法
原理:
应用
原理,让被保护金属作
极,
原电池
正
负
找另一种活泼性较强金属作
级
原理:应用
原理,将被保护的钢铁设备做
极,用惰性电极做辅助
极,在外加直流电作用下,电子被迫流向被保护的钢铁设备,使钢铁表面的腐蚀电流降至零或接近等于零。
2.
外加电流的阴极保护法
阴
阳
电解池
1.牺牲阳极的阴极保护法
原理:
用
原理,被保护金属作
极(阴极),
原电池
正
负
找较活泼金属作
极(阳极),牺牲阳极
原理:用
原理,将被保护的钢铁设备做
极,用惰性电极做辅助
极,在外加直流电作用下,电子被迫流向
钢铁设备,使钢铁表面的腐蚀电流降至零或接近等于零。
2.
外加电流的阴极保护法
阴
阳
电解池
被保护的阴极
讨论与交流下列各情况,在其中Fe片腐蚀由快到慢的顺序__________________
(5)>(2)>(1)>(3)>(4)
电解池
电解池
原电池
原电池
小结:金属腐蚀快慢的判断依据:
(1)
活泼性不同的两金属,活泼性差别越大,氧化还原反应的速率越
,活泼金属被腐蚀的速度越
。
(2)
同一电解质溶液中,
电解池原理(阳极)引起的腐蚀
原电池原理(负极)引起的腐蚀
化学腐蚀
有防腐措施的腐蚀(电解池的阴极、原电池的正极及加有镀层的金属)。
(3)
同一种金属的腐蚀:在强电解质中
弱电解质中
非电解质中
>
>
>
>
>
快
快
【练习】下列装置中四块相同的Zn片,放置一段时间后腐蚀速率由慢到快的顺序是________________________
(4)>(2)>(1)>(3)
小结:金属的防护方法
1、在金属表面覆盖保护层:油、油漆、塑料、搪瓷、镀一层金属
2、改变金属的内部组织结构:如制成合金
3、电化学保护法
(1)牺牲阳极的阴极保护法
(原电池原理)
(例:轮船船身上的锌块、地下钢铁管道接镁块)
(2)外加电流的阴极保护法
(电解池原理)
