人教版高中化学选修4第四章第三节电解池(共18张PPT)
文档属性
| 名称 | 人教版高中化学选修4第四章第三节电解池(共18张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-13 00:00:00 | ||
图片预览





文档简介
(共18张PPT)
第三节
电解池
电解的应用
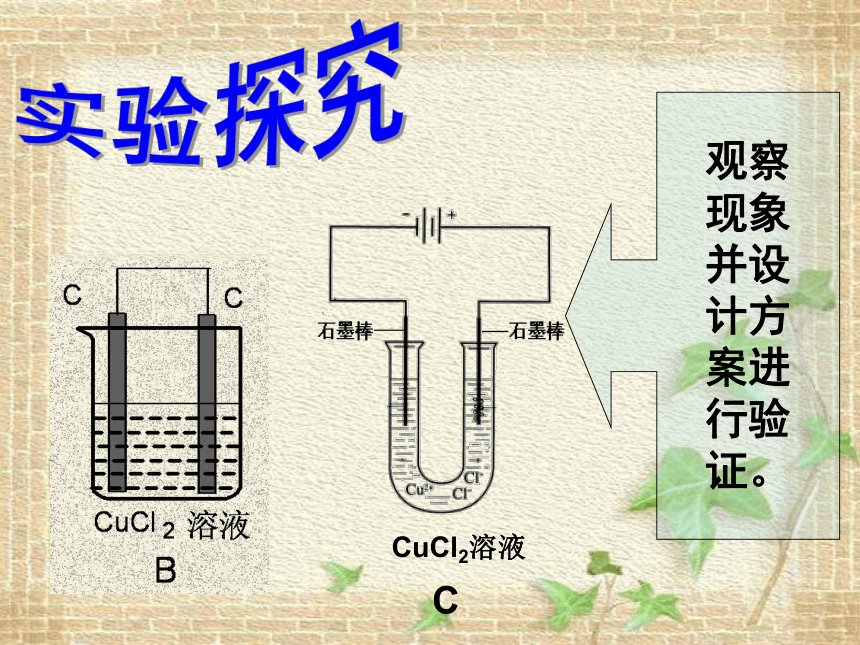
观察
现象
并设
计方
案进
行验
证。
探究实验
--
CuCl2溶液
+
-
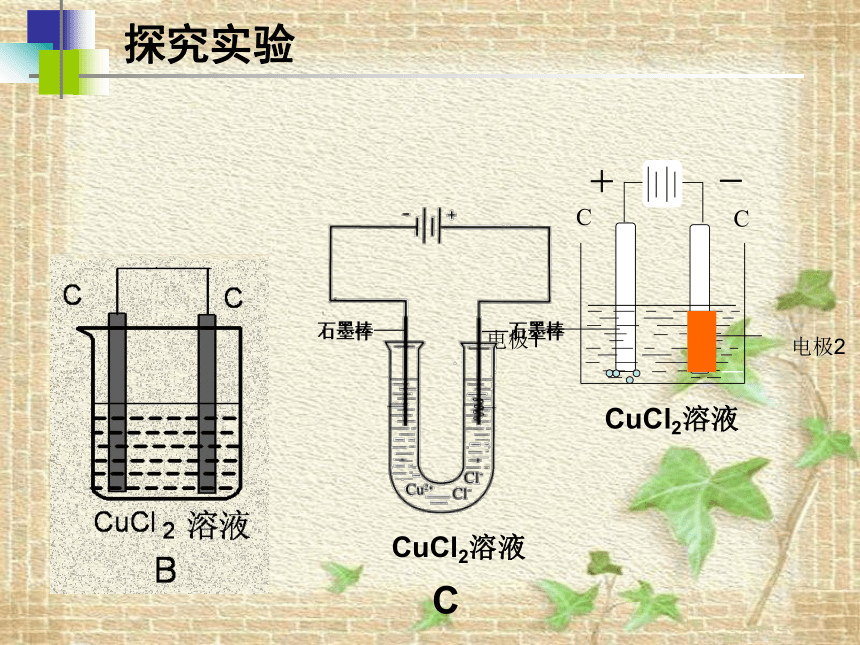
电极1
电极2
练习:书写刚才实验中的电极反应式
(氧化反应)
(还原反应)
我要试一试
一、电解原理
1、电解:
2、电解池:
3、电极:
阴极:
阳极:
使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程。
将电能转化为化学能的装置。
与电源负极相连,发生还原反应。
与电源正极相连,发生氧化反应。
4、构成电解池的条件:
①直流电源;
②两个电极(必须能导电,电极材料可以相同,可以不同);
③电解质溶液或熔融电解质;
④形成闭合回路。
思考:判断下列哪些装置能构成电解池
Cu2+
oooooooooooooooooooo
-
+
-
+
阴极
阳极
Cu
Cl2
e-
e-
5、电子流动方向
电子从负极流向阴极,经溶液离子导电,再从阳极流回正极
6、离子放电顺序
金属>S2->I->Br->Cl->OH->
NO3->SO42->F-
(1)阳极:还原性强的离子先失电子
(2)阴极:氧化性强的离子先得电子
越活泼的金属,其阳离子越难得到电子,但Fe3+氧化性较Cu2+强。
Ag+>Hg2+>Fe3+>Cu2+
>
H+>Pb2+>Sn2+>Fe2+>Zn2+
>
Al3+>Mg2+>Na+>Ca2+>K+
7
电极反应式的书写
1列物质,选离子
2标得失,配电荷
3配个数,巧用水
4两式加,验总式
[例]以石墨碳棒为电极,请写出电解NaOH
、HCl、
Na2SO4溶液时,在阴、阳两极上发生的电极反应式
及总的化学方程式。
想一想、做一做
(包括水的电离,并分
成阳离子组和阴离子组)
②明确溶液中存在哪些离子
③判断阴阳离子的放电顺序
④根据阳极氧化,阴极还原完成电极反应式
书写电极反应式及总方程式的方法小结
①判断电极材料
(注意得失电子守恒)
⑤由阴阳两电极反应式,合并得总反应式
(弱电解质的须保持分子形式)
练习:
PH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的PH>a,则该电解质可能是(
)
A.NaOH
B.H2SO4
C.AgNO3
D.Na2SO4
A
练
习:下图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。下列说法正确的是
(
)
A.X是正极,Y是负极
B.X是负极,Y是正极
C.CuSO4溶液的PH值逐渐减小
D.CuSO4溶液的PH值不变
AC
从H+
、Cu2+
、Na+
、Cl-、SO42-五种离子中
选出两种离子组成电解质,按下列要求进行电
解,用电解质的化学式填空(使用惰性电极电解)
(1)电解过程中溶液的pH增大的有_
_____;
(2)电解过程中溶液的pH减小的有
;
(3)电解过程中溶液的pH不变的有
。
电解时有何规律?请小结
NaCl
、HCl
CuSO4、H2SO4
Na2SO4
思
考:
再
见
第三节
电解池
电解的应用
观察
现象
并设
计方
案进
行验
证。
探究实验
--
CuCl2溶液
+
-
电极1
电极2
练习:书写刚才实验中的电极反应式
(氧化反应)
(还原反应)
我要试一试
一、电解原理
1、电解:
2、电解池:
3、电极:
阴极:
阳极:
使电流通过电解质溶液而在阴、阳两极引起氧化还原反应的过程。
将电能转化为化学能的装置。
与电源负极相连,发生还原反应。
与电源正极相连,发生氧化反应。
4、构成电解池的条件:
①直流电源;
②两个电极(必须能导电,电极材料可以相同,可以不同);
③电解质溶液或熔融电解质;
④形成闭合回路。
思考:判断下列哪些装置能构成电解池
Cu2+
oooooooooooooooooooo
-
+
-
+
阴极
阳极
Cu
Cl2
e-
e-
5、电子流动方向
电子从负极流向阴极,经溶液离子导电,再从阳极流回正极
6、离子放电顺序
金属>S2->I->Br->Cl->OH->
NO3->SO42->F-
(1)阳极:还原性强的离子先失电子
(2)阴极:氧化性强的离子先得电子
越活泼的金属,其阳离子越难得到电子,但Fe3+氧化性较Cu2+强。
Ag+>Hg2+>Fe3+>Cu2+
>
H+>Pb2+>Sn2+>Fe2+>Zn2+
>
Al3+>Mg2+>Na+>Ca2+>K+
7
电极反应式的书写
1列物质,选离子
2标得失,配电荷
3配个数,巧用水
4两式加,验总式
[例]以石墨碳棒为电极,请写出电解NaOH
、HCl、
Na2SO4溶液时,在阴、阳两极上发生的电极反应式
及总的化学方程式。
想一想、做一做
(包括水的电离,并分
成阳离子组和阴离子组)
②明确溶液中存在哪些离子
③判断阴阳离子的放电顺序
④根据阳极氧化,阴极还原完成电极反应式
书写电极反应式及总方程式的方法小结
①判断电极材料
(注意得失电子守恒)
⑤由阴阳两电极反应式,合并得总反应式
(弱电解质的须保持分子形式)
练习:
PH=a的某电解质溶液中,插入两支惰性电极通直流电一段时间后,溶液的PH>a,则该电解质可能是(
)
A.NaOH
B.H2SO4
C.AgNO3
D.Na2SO4
A
练
习:下图所示装置中,a、b都是惰性电极,通电一段时间后,b极附近溶液呈红色。下列说法正确的是
(
)
A.X是正极,Y是负极
B.X是负极,Y是正极
C.CuSO4溶液的PH值逐渐减小
D.CuSO4溶液的PH值不变
AC
从H+
、Cu2+
、Na+
、Cl-、SO42-五种离子中
选出两种离子组成电解质,按下列要求进行电
解,用电解质的化学式填空(使用惰性电极电解)
(1)电解过程中溶液的pH增大的有_
_____;
(2)电解过程中溶液的pH减小的有
;
(3)电解过程中溶液的pH不变的有
。
电解时有何规律?请小结
NaCl
、HCl
CuSO4、H2SO4
Na2SO4
思
考:
再
见
