人教版高二化学选修4第三章 第三节 盐类的水解(共22张PPT)
文档属性
| 名称 | 人教版高二化学选修4第三章 第三节 盐类的水解(共22张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-15 00:00:00 | ||
图片预览







文档简介
(共22张PPT)
新课程高中化学《选修4》
第三章
水溶液中的离子平衡
第三节
盐类的水解
明矾是传统的净水剂,一直被人们所广泛使用。
近年来发现,明矾中含有的铝对人体有害。长期
饮用明矾净化的水,可能会引起老年性痴呆症。
你知道明矾净水的原理吗?
【生活小常识】
明
矾
KAl(SO4)2·12H2O
第三节
盐
类
的
水
解
①升温,促进水的电离;
②
加入酸或碱,抑制水的电离;
2、若在水中加入盐,所得的盐溶液是否
一定呈中性?
3、可以用什么方法来检验?
复习提问
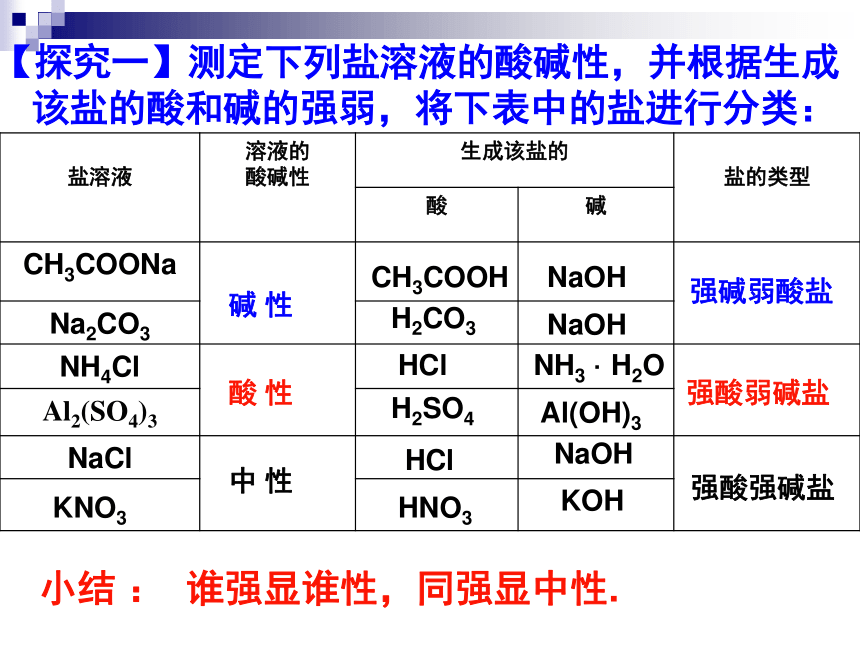
【探究一】测定下列盐溶液的酸碱性;并根据生成该盐的酸和碱的强弱,将下表中的盐进行分类:
碱
性
碱
性
中
性
中
性
酸
性
酸
性
KNO3
盐溶液
溶液的
酸碱性
生成该盐的
盐的类型
酸
碱
CH3COONa
Na2CO3
NH4Cl
Al2(SO4)3
NaCl
【探究一】测定下列盐溶液的酸碱性,并根据生成该盐的酸和碱的强弱,将下表中的盐进行分类:
碱
性
中
性
酸
性
强碱弱酸盐
强酸强碱盐
强酸弱碱盐
NaOH
CH3COOH
H2CO3
NaOH
HCl
NH3
·
H2O
H2SO4
Al(OH)3
HCl
NaOH
HNO3
KOH
KNO3
小结
:
谁强显谁性,同强显中性.
盐溶液
溶液的
酸碱性
生成该盐的
盐的类型
酸
碱
CH3COONa
Na2CO3
NH4Cl
Al2(SO4)3
NaCl
c(H+)
=c(OH-)
c(OH-)
>c(H+)
1、在水中没有加入CH3COONa之前显什么性?
2、加入CH3COONa之后,显碱性,说明什么?
【探究二】盐溶液呈不同酸碱性的原因:
【问题一】强碱弱酸盐溶液为什么呈碱性?
以
CH3COONa(aq)为例分析:
【思考】
CH3COONa
=
CH3COO_
+Na+
+
CH3COOH
使
c(OH-)
>
c(H+),显碱性。
【思考】
【分组讨论】
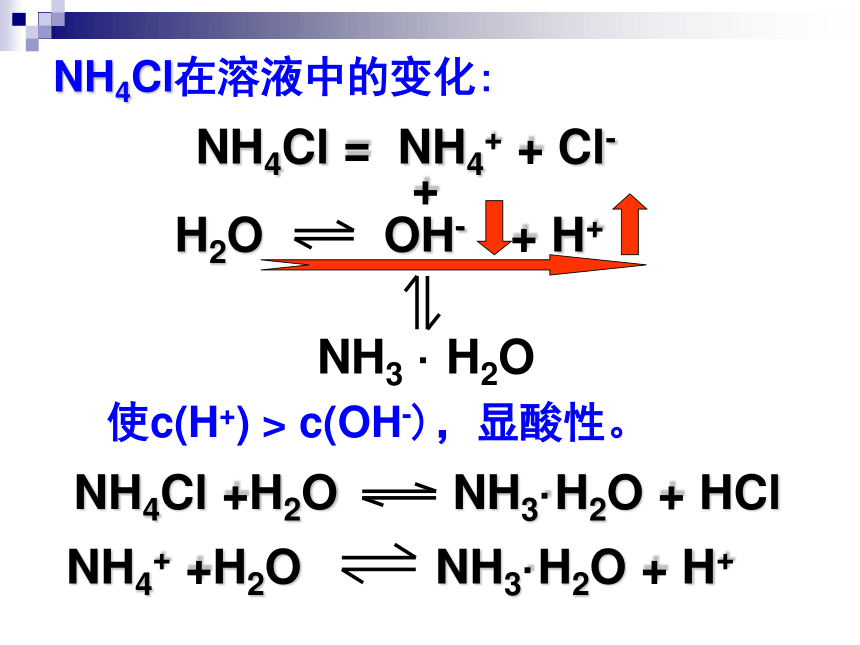
【问题二】强酸弱碱盐溶液为什么显酸性?
以NH4Cl(aq)为例分析。
【问题三】强酸强碱盐溶液为什么显中性?
以NaCl(aq)为例分析。
结合以下几个问题思考:
1、盐溶液中存在哪几种电离?
2、盐溶液中存在哪些离子?
哪些离子可以相互结合?
3、若结合,对水的电离平衡有什么影响?
NH4Cl
=
NH4+
+
Cl-
+
NH3
·
H2O
使c(H+)
>
c(OH-),显酸性。
NH3·H2O
+
HCl
NH4Cl在溶液中的变化:
NaCl
=
Na+
+
Cl-
因此c(H+)
=c(OH-),显中性。
NaCl
在溶液中的变化:
1、定义:溶液中盐电离出来的____跟水所电离出来的_________结合生成___________的反应,叫做盐类的水解。
一、盐类的水解
弱酸或弱碱
离子
H+
或OH-
弱电解质
2、水解的条件:
生成弱电解质。
【思考】1、哪些离子能与H+结合生成弱酸?
2、哪些离子能与OH-结合生成弱碱?
----弱碱阳离子
如:CH3COO-、CO32-、S2-、
PO43-、ClO-、F-
等
---弱酸阴离子
如:NH4+、Al3+、Fe3+、Fe2+、Mg2+等
3、水解的本质:促进水的电离。
4、水解的特点:
⑵
吸热反应
⑶
水解程度一般很微弱。
⑴
可逆反应(
)
水
解
中
和
【思考】盐中的离子对水的电离起什么作用?
盐的水解反应是中和反应的逆反应。
(一般不标“↓”或“↑”)
【分析表格】归纳盐类水解的规律:
能
能
不水解
Al3+
无
无
弱
碱Al(OH)3
弱
酸CH3COOH
碱
性
酸
性
中
性
5、水解的规律:
有弱才水解,无弱不水解;
谁弱谁水解,谁强显谁性;
同强显中性.
Al2(SO4)3
强碱弱酸盐
强酸弱碱盐
强酸强碱盐
KNO3
CH3COONa
CH3COO-
实
例
类
型
能否
水
解
水
解
的离
子
生成的
弱电解质
溶液的
酸碱性
明矾的净水原理:
KAl(SO4)2
=
Al(OH)3胶体具有很强的吸附能力,可以吸附水中的悬浮杂质,从而使水澄清。
K+
+
Al3+
+
2SO42-
Al(OH)3
+
H+
(胶
体)
3
3
【小组讨论】
【课堂总结】
盐类的水解:
1、概念:溶液中盐电离出来的离子跟水所
电离出来的
H+或OH-结合生成弱电解质的反应。
2、水解的条件:生成弱电解质。
3、水解的实质:促进水的电离。
4、水解的特点:
⑴
可逆反应
⑵
吸热反应
⑶
水解程度一般很微弱
5、水解的规律:有弱才水解,无弱不水解;
谁弱谁水解,谁强显谁性;
同强显中性.
影响水的电离平衡的因素:
①.升温,促进水的电离;
②.加入酸或碱,抑制水的电离;
小结
H2O
H++OH-
③.加入能水解的盐,促进水的电离。
1.指出下列盐的类型并判断其
溶液的酸碱性:
(1)CuCl2
(2)
NaF
(3)
Fe2(SO4)3
(4)NaClO
(5)Na2SO4
强酸弱碱盐
强酸强碱盐
强碱弱酸盐
强酸弱碱盐
强碱弱酸盐
显碱性
显酸性
显碱性
显酸性
显中性
练一练:
2、在溶液中,不能发生水解的
离子是(
)
A、ClO
–
B、CO3
2
–
C、Fe
3+
D、SO4
2
–
练一练:
D
3.
下列溶液能使酚酞指示剂显
红色的是(
)
A
、Na2SO3(aq)
B、NaHSO4(aq)
C、
K2S
(aq)
D、FeCl3(aq)
练一练:
A
C
4.
常温下,某溶液中由水电离产生的c(H+)
=1×
10-9mol·L-1,该溶液可能为(
)
A
、
NH4Cl
(aq)
B、HCl
(aq)
C
、
NaCl
(aq)
D
、NaOH(aq)
练一练:
B
D
5.常温下,某溶液中由水电离产生的c(H+)
=1×
10-5mol·L-1,该溶液可能为?(
)
A
、NH4NO3
(aq)
B
、H2SO4
(aq)
C
、NaHSO4
(aq)
D
、CH3COONa(aq)
练一练:
A
D
【布置作业】新思维P58--59
【课后思考与交流】
同属于盐类,NaCl和C5H8NO4Na(谷氨
酸一钠,味精)可以用于调味;
Na2CO3俗称“纯碱”,明明是盐,而在日常生活中却被视
为“碱”用于清洗油污和制作面食。
请同学们课后思考并解释原因。
新课程高中化学《选修4》
第三章
水溶液中的离子平衡
第三节
盐类的水解
明矾是传统的净水剂,一直被人们所广泛使用。
近年来发现,明矾中含有的铝对人体有害。长期
饮用明矾净化的水,可能会引起老年性痴呆症。
你知道明矾净水的原理吗?
【生活小常识】
明
矾
KAl(SO4)2·12H2O
第三节
盐
类
的
水
解
①升温,促进水的电离;
②
加入酸或碱,抑制水的电离;
2、若在水中加入盐,所得的盐溶液是否
一定呈中性?
3、可以用什么方法来检验?
复习提问
【探究一】测定下列盐溶液的酸碱性;并根据生成该盐的酸和碱的强弱,将下表中的盐进行分类:
碱
性
碱
性
中
性
中
性
酸
性
酸
性
KNO3
盐溶液
溶液的
酸碱性
生成该盐的
盐的类型
酸
碱
CH3COONa
Na2CO3
NH4Cl
Al2(SO4)3
NaCl
【探究一】测定下列盐溶液的酸碱性,并根据生成该盐的酸和碱的强弱,将下表中的盐进行分类:
碱
性
中
性
酸
性
强碱弱酸盐
强酸强碱盐
强酸弱碱盐
NaOH
CH3COOH
H2CO3
NaOH
HCl
NH3
·
H2O
H2SO4
Al(OH)3
HCl
NaOH
HNO3
KOH
KNO3
小结
:
谁强显谁性,同强显中性.
盐溶液
溶液的
酸碱性
生成该盐的
盐的类型
酸
碱
CH3COONa
Na2CO3
NH4Cl
Al2(SO4)3
NaCl
c(H+)
=c(OH-)
c(OH-)
>c(H+)
1、在水中没有加入CH3COONa之前显什么性?
2、加入CH3COONa之后,显碱性,说明什么?
【探究二】盐溶液呈不同酸碱性的原因:
【问题一】强碱弱酸盐溶液为什么呈碱性?
以
CH3COONa(aq)为例分析:
【思考】
CH3COONa
=
CH3COO_
+Na+
+
CH3COOH
使
c(OH-)
>
c(H+),显碱性。
【思考】
【分组讨论】
【问题二】强酸弱碱盐溶液为什么显酸性?
以NH4Cl(aq)为例分析。
【问题三】强酸强碱盐溶液为什么显中性?
以NaCl(aq)为例分析。
结合以下几个问题思考:
1、盐溶液中存在哪几种电离?
2、盐溶液中存在哪些离子?
哪些离子可以相互结合?
3、若结合,对水的电离平衡有什么影响?
NH4Cl
=
NH4+
+
Cl-
+
NH3
·
H2O
使c(H+)
>
c(OH-),显酸性。
NH3·H2O
+
HCl
NH4Cl在溶液中的变化:
NaCl
=
Na+
+
Cl-
因此c(H+)
=c(OH-),显中性。
NaCl
在溶液中的变化:
1、定义:溶液中盐电离出来的____跟水所电离出来的_________结合生成___________的反应,叫做盐类的水解。
一、盐类的水解
弱酸或弱碱
离子
H+
或OH-
弱电解质
2、水解的条件:
生成弱电解质。
【思考】1、哪些离子能与H+结合生成弱酸?
2、哪些离子能与OH-结合生成弱碱?
----弱碱阳离子
如:CH3COO-、CO32-、S2-、
PO43-、ClO-、F-
等
---弱酸阴离子
如:NH4+、Al3+、Fe3+、Fe2+、Mg2+等
3、水解的本质:促进水的电离。
4、水解的特点:
⑵
吸热反应
⑶
水解程度一般很微弱。
⑴
可逆反应(
)
水
解
中
和
【思考】盐中的离子对水的电离起什么作用?
盐的水解反应是中和反应的逆反应。
(一般不标“↓”或“↑”)
【分析表格】归纳盐类水解的规律:
能
能
不水解
Al3+
无
无
弱
碱Al(OH)3
弱
酸CH3COOH
碱
性
酸
性
中
性
5、水解的规律:
有弱才水解,无弱不水解;
谁弱谁水解,谁强显谁性;
同强显中性.
Al2(SO4)3
强碱弱酸盐
强酸弱碱盐
强酸强碱盐
KNO3
CH3COONa
CH3COO-
实
例
类
型
能否
水
解
水
解
的离
子
生成的
弱电解质
溶液的
酸碱性
明矾的净水原理:
KAl(SO4)2
=
Al(OH)3胶体具有很强的吸附能力,可以吸附水中的悬浮杂质,从而使水澄清。
K+
+
Al3+
+
2SO42-
Al(OH)3
+
H+
(胶
体)
3
3
【小组讨论】
【课堂总结】
盐类的水解:
1、概念:溶液中盐电离出来的离子跟水所
电离出来的
H+或OH-结合生成弱电解质的反应。
2、水解的条件:生成弱电解质。
3、水解的实质:促进水的电离。
4、水解的特点:
⑴
可逆反应
⑵
吸热反应
⑶
水解程度一般很微弱
5、水解的规律:有弱才水解,无弱不水解;
谁弱谁水解,谁强显谁性;
同强显中性.
影响水的电离平衡的因素:
①.升温,促进水的电离;
②.加入酸或碱,抑制水的电离;
小结
H2O
H++OH-
③.加入能水解的盐,促进水的电离。
1.指出下列盐的类型并判断其
溶液的酸碱性:
(1)CuCl2
(2)
NaF
(3)
Fe2(SO4)3
(4)NaClO
(5)Na2SO4
强酸弱碱盐
强酸强碱盐
强碱弱酸盐
强酸弱碱盐
强碱弱酸盐
显碱性
显酸性
显碱性
显酸性
显中性
练一练:
2、在溶液中,不能发生水解的
离子是(
)
A、ClO
–
B、CO3
2
–
C、Fe
3+
D、SO4
2
–
练一练:
D
3.
下列溶液能使酚酞指示剂显
红色的是(
)
A
、Na2SO3(aq)
B、NaHSO4(aq)
C、
K2S
(aq)
D、FeCl3(aq)
练一练:
A
C
4.
常温下,某溶液中由水电离产生的c(H+)
=1×
10-9mol·L-1,该溶液可能为(
)
A
、
NH4Cl
(aq)
B、HCl
(aq)
C
、
NaCl
(aq)
D
、NaOH(aq)
练一练:
B
D
5.常温下,某溶液中由水电离产生的c(H+)
=1×
10-5mol·L-1,该溶液可能为?(
)
A
、NH4NO3
(aq)
B
、H2SO4
(aq)
C
、NaHSO4
(aq)
D
、CH3COONa(aq)
练一练:
A
D
【布置作业】新思维P58--59
【课后思考与交流】
同属于盐类,NaCl和C5H8NO4Na(谷氨
酸一钠,味精)可以用于调味;
Na2CO3俗称“纯碱”,明明是盐,而在日常生活中却被视
为“碱”用于清洗油污和制作面食。
请同学们课后思考并解释原因。
