人教版高二化学选修4第四章第一节 原 电 池(共21张PPT)
文档属性
| 名称 | 人教版高二化学选修4第四章第一节 原 电 池(共21张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 658.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-15 12:59:40 | ||
图片预览







文档简介
(共21张PPT)
第四章
电化学基础
第1节
原电池
实验:将锌片和铜片用导线连接(导线中间接入一个电流表),平行插入盛有稀硫酸的烧杯中,观察现象
[实验现象]:铜片上有气泡产生,锌片不断溶解,电流表的指针发生偏转。
[实验结论]:导线中有电流通过
为什么会出现上面的现象?
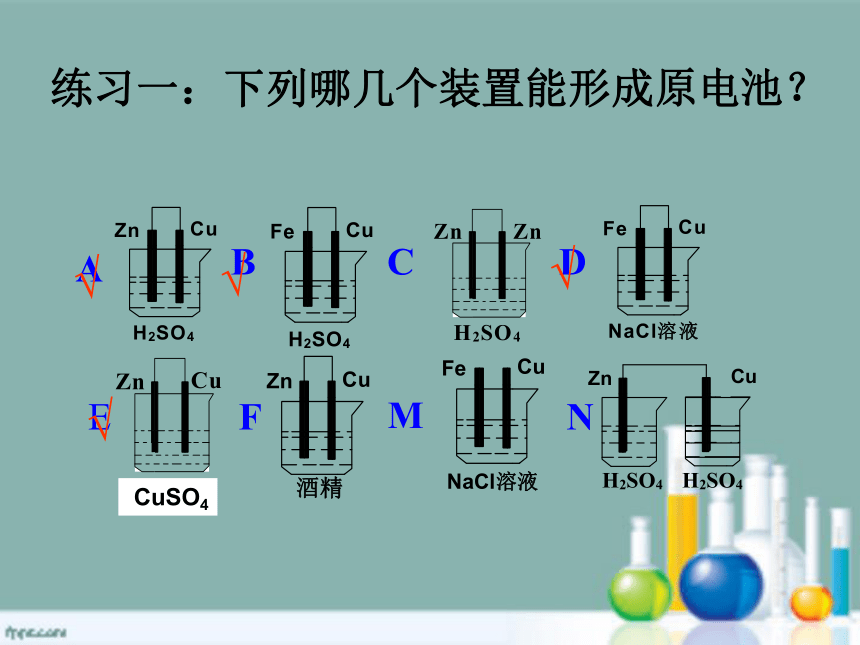
二、原电池的构成条件
一、原电池:
是将化学能转化为电能的装置
1.两种不同的金属
(或一种金属与石墨或金属氧化物)做电极
2.用导线相连(或直接接触)形成闭合回路
3.电极插入电解质溶液里
4.能自发进行氧化还原反应
练习一:下列哪几个装置能形成原电池?
A
B
C
D
E
F
M
N
CuSO4
√
√
√
√
Cu
Zn
Zn2+
H+
H+
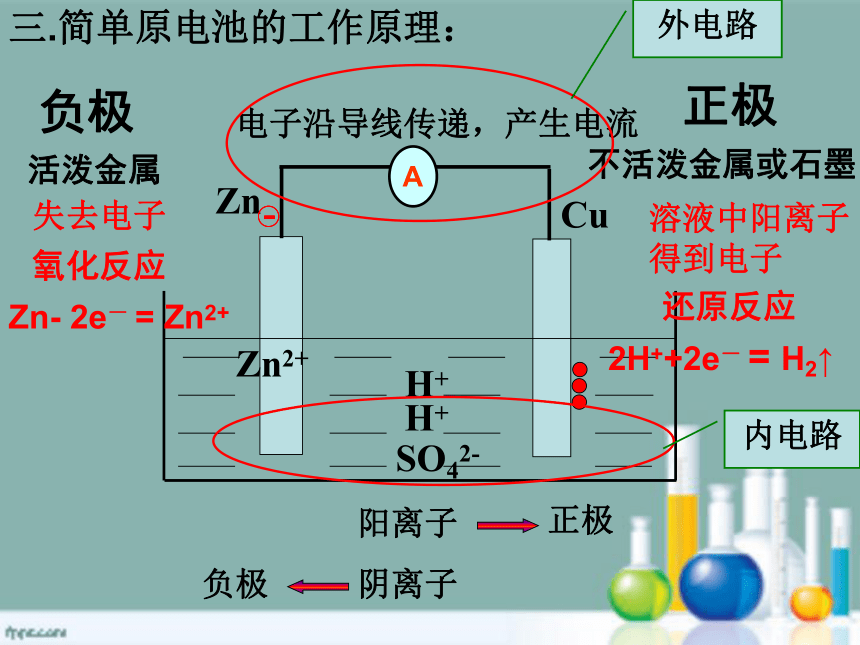
Zn-
2e-
=
Zn2+
2H++2e-
=
H2↑
氧化反应
还原反应
负极
正极
电子沿导线传递,产生电流
阳离子
失去电子
溶液中阳离子得到电子
阴离子
正极
负极
SO42-
活泼金属
不活泼金属或石墨
三.简单原电池的工作原理:
外电路
内电路
A
原理总结:
1.电路:
外电路
内电路
失电子的一极向得电子的一极(从负极到正极)
与电子流动方向相反(从正极到负极)
阴离子流向负极
阳离子流向正极
2.电极:
电子流入的一极
电子流出的一极
3.电极反应式:
正极:
2H++
2e-=
H2↑
负极:
Zn-2e-=
Zn2+
4.总反应式:
Zn+
2H+
=
Zn2+
+
H2↑
电子流向:
电流流向:
负极:
正极:
练习二
(2011年高考全国理综卷)在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是
(
)
A.正极附近的SO42
-离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
D
写出下面原电池的电极反应方程式
负极:Zn-2e-=
Zn2+
正极:Cu2++2e-
=
Cu
电池总反应:
Zn+Cu2+=
Zn2++Cu
为什么电流表读数不断减小?
因为铜在锌表面析出后,与CuSO4溶液一起形成了原电池,产生的电流并没有经过电流表,所以电流表的读数不断减小。当锌片表面完全被铜覆盖后,相当于两个电极都是铜,已不能发生原电池反应,所以最后无电流产生。
一段时间后
我们设计原电池时把氧化反应和还原反应分开在不同区域进行,再以适当方式连接,可以获得电流。如下图所示的原电池装置
Cu
Zn
CuSO4溶液
Zn2+
SO42-
A
实验设计
1.安培表指针会偏转吗?为什么
2.怎样构成闭合回路?
四、盐桥原电池的构成和反应原理
改进后的装置为什么能够持续、稳定的产生电流?盐桥成分及在此的作用是什么?
参考教材P72得出结论
盐桥的作用:
(1)使整个装置构成闭合回路。
(2)使两溶液保持电中性(平衡电荷)。
盐桥成分:含琼胶的KCl饱和溶液
SO42-
Zn2+
e-
e-
SO42-
Cu2+
K+
盐桥工作示意图
Cu
Zn
K+
Cl-
K+
Cl-
K+
Cl-
K+
Cl-
K+
Cl-
Cl-
K+
K+
Cl-
K+
K+
K+
Cl-
Cl-
K+
Cl-
Cl-
Cl-
1、原理分析总结:
由于盐桥(如KCl)的存在,其中阴离子Cl-向ZnSO4溶液扩散和迁移,阳离子K+则向CuSO4溶液扩散和迁移,分别中和过剩的电荷,保持溶液的电中性,因而放电作用不间断进行,一直到锌片全部溶解或
CuSO4溶液中的
Cu2+几乎完全沉淀下来。
在整个装置的电流回路中,溶液中的电流通路是靠离子迁移完成的。取出盐桥,Zn失去电子形成的Zn2+进入ZnSO4溶液,ZnSO4溶液因Zn2+增多而带正电荷。同时,CuSO4则由于Cu2+
变为Cu
,使得
SO42-相对较多而带负电荷。溶液不保持电中性,这两种因素均会阻止电子从锌片流向铜片,造成电流中断。
锌半电池
铜半电池
电极反应:
负极:
正极:
总反应:
Cu2++2e-
=Cu
Zn-2e-
=Zn2+
Zn
+
Cu2+=
Zn2+
+
Cu
锌铜原电池(盐桥)
2、加入盐桥后由两个半电池组成的原电池工作原理:
半电池中:还原性强的材料作负极,失电子被氧化
另半电池:电解质溶液中氧化性强的离子在正极得电子被还原
外电路中:电子由负极经导线流向正极
内电路中:两极之间通过盐桥构成闭合回路。
优点:
1.有效避免了电极材料与电解质溶液的直接反应,
增加了原电池的使用寿命。
2.离子在盐桥中作定向移动,使离子移动更加有序,电流持续稳定
,提高了原电池的使用效率。
相同点:电极反应本质相同
不同点:
构造不同
(高考真题)依据氧化还原反应:
2Ag+(aq)
+
Cu(s)
==
Cu2+(aq)
+
2Ag(s)
设计的原电池如图所示,请回答下列问题:
(1)电极X的材料是??????????
;
电解质溶液Y是???????????
;
(2)银电极为电池的?????????极,
发生的电极反应为???????????
X电极上发生的电极反应为
??????;
(3)外电路中的电子是从?????????电极
流向??????????电极。
Cu
AgNO3
正
X
Ag
Cu
–
2e-
=
Cu2+
2Ag+
+
2e-
=
2
Ag
练习三
1、构成原电池的条件
2、探究“单液电池”,寻找
改进方法—“双液电池”
3、具有盐桥原电池的反应原理作用
课堂小结:
第四章
电化学基础
第1节
原电池
实验:将锌片和铜片用导线连接(导线中间接入一个电流表),平行插入盛有稀硫酸的烧杯中,观察现象
[实验现象]:铜片上有气泡产生,锌片不断溶解,电流表的指针发生偏转。
[实验结论]:导线中有电流通过
为什么会出现上面的现象?
二、原电池的构成条件
一、原电池:
是将化学能转化为电能的装置
1.两种不同的金属
(或一种金属与石墨或金属氧化物)做电极
2.用导线相连(或直接接触)形成闭合回路
3.电极插入电解质溶液里
4.能自发进行氧化还原反应
练习一:下列哪几个装置能形成原电池?
A
B
C
D
E
F
M
N
CuSO4
√
√
√
√
Cu
Zn
Zn2+
H+
H+
Zn-
2e-
=
Zn2+
2H++2e-
=
H2↑
氧化反应
还原反应
负极
正极
电子沿导线传递,产生电流
阳离子
失去电子
溶液中阳离子得到电子
阴离子
正极
负极
SO42-
活泼金属
不活泼金属或石墨
三.简单原电池的工作原理:
外电路
内电路
A
原理总结:
1.电路:
外电路
内电路
失电子的一极向得电子的一极(从负极到正极)
与电子流动方向相反(从正极到负极)
阴离子流向负极
阳离子流向正极
2.电极:
电子流入的一极
电子流出的一极
3.电极反应式:
正极:
2H++
2e-=
H2↑
负极:
Zn-2e-=
Zn2+
4.总反应式:
Zn+
2H+
=
Zn2+
+
H2↑
电子流向:
电流流向:
负极:
正极:
练习二
(2011年高考全国理综卷)在盛有稀H2SO4的烧杯中放入用导线连接的锌片和铜片,下列叙述正确的是
(
)
A.正极附近的SO42
-离子浓度逐渐增大
B.电子通过导线由铜片流向锌片
C.正极有O2逸出
D.铜片上有H2逸出
D
写出下面原电池的电极反应方程式
负极:Zn-2e-=
Zn2+
正极:Cu2++2e-
=
Cu
电池总反应:
Zn+Cu2+=
Zn2++Cu
为什么电流表读数不断减小?
因为铜在锌表面析出后,与CuSO4溶液一起形成了原电池,产生的电流并没有经过电流表,所以电流表的读数不断减小。当锌片表面完全被铜覆盖后,相当于两个电极都是铜,已不能发生原电池反应,所以最后无电流产生。
一段时间后
我们设计原电池时把氧化反应和还原反应分开在不同区域进行,再以适当方式连接,可以获得电流。如下图所示的原电池装置
Cu
Zn
CuSO4溶液
Zn2+
SO42-
A
实验设计
1.安培表指针会偏转吗?为什么
2.怎样构成闭合回路?
四、盐桥原电池的构成和反应原理
改进后的装置为什么能够持续、稳定的产生电流?盐桥成分及在此的作用是什么?
参考教材P72得出结论
盐桥的作用:
(1)使整个装置构成闭合回路。
(2)使两溶液保持电中性(平衡电荷)。
盐桥成分:含琼胶的KCl饱和溶液
SO42-
Zn2+
e-
e-
SO42-
Cu2+
K+
盐桥工作示意图
Cu
Zn
K+
Cl-
K+
Cl-
K+
Cl-
K+
Cl-
K+
Cl-
Cl-
K+
K+
Cl-
K+
K+
K+
Cl-
Cl-
K+
Cl-
Cl-
Cl-
1、原理分析总结:
由于盐桥(如KCl)的存在,其中阴离子Cl-向ZnSO4溶液扩散和迁移,阳离子K+则向CuSO4溶液扩散和迁移,分别中和过剩的电荷,保持溶液的电中性,因而放电作用不间断进行,一直到锌片全部溶解或
CuSO4溶液中的
Cu2+几乎完全沉淀下来。
在整个装置的电流回路中,溶液中的电流通路是靠离子迁移完成的。取出盐桥,Zn失去电子形成的Zn2+进入ZnSO4溶液,ZnSO4溶液因Zn2+增多而带正电荷。同时,CuSO4则由于Cu2+
变为Cu
,使得
SO42-相对较多而带负电荷。溶液不保持电中性,这两种因素均会阻止电子从锌片流向铜片,造成电流中断。
锌半电池
铜半电池
电极反应:
负极:
正极:
总反应:
Cu2++2e-
=Cu
Zn-2e-
=Zn2+
Zn
+
Cu2+=
Zn2+
+
Cu
锌铜原电池(盐桥)
2、加入盐桥后由两个半电池组成的原电池工作原理:
半电池中:还原性强的材料作负极,失电子被氧化
另半电池:电解质溶液中氧化性强的离子在正极得电子被还原
外电路中:电子由负极经导线流向正极
内电路中:两极之间通过盐桥构成闭合回路。
优点:
1.有效避免了电极材料与电解质溶液的直接反应,
增加了原电池的使用寿命。
2.离子在盐桥中作定向移动,使离子移动更加有序,电流持续稳定
,提高了原电池的使用效率。
相同点:电极反应本质相同
不同点:
构造不同
(高考真题)依据氧化还原反应:
2Ag+(aq)
+
Cu(s)
==
Cu2+(aq)
+
2Ag(s)
设计的原电池如图所示,请回答下列问题:
(1)电极X的材料是??????????
;
电解质溶液Y是???????????
;
(2)银电极为电池的?????????极,
发生的电极反应为???????????
X电极上发生的电极反应为
??????;
(3)外电路中的电子是从?????????电极
流向??????????电极。
Cu
AgNO3
正
X
Ag
Cu
–
2e-
=
Cu2+
2Ag+
+
2e-
=
2
Ag
练习三
1、构成原电池的条件
2、探究“单液电池”,寻找
改进方法—“双液电池”
3、具有盐桥原电池的反应原理作用
课堂小结:
