人教版高二化学选修4第三章 第三节 盐类的水解 课件 (共20张PPT)
文档属性
| 名称 | 人教版高二化学选修4第三章 第三节 盐类的水解 课件 (共20张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-15 16:30:40 | ||
图片预览






文档简介
(共20张PPT)
盐类的水解
【联想·质疑】
酸溶液呈酸性,碱溶液呈碱性,那么盐溶液是否呈中性呢?
〖学生实验〗
用PH试纸检验CH3COONa、Na2CO3、NH4Cl、
Al2(SO4)3
、
NaCl、KNO3溶液的酸碱性。
讨论:
试用归纳法找出盐的类型与盐溶液的酸碱性的关系。
酸碱
性
盐类
型
强碱弱
酸盐
强碱弱
酸盐
强酸弱
碱盐
强酸弱
碱盐
强酸强
碱盐
强酸强
碱盐
碱性
碱性
酸性
酸性
中性
中性
【活动·探究】
用什么简便方法检验盐溶液的酸碱性?
盐
CH3COONa
Na2CO3
NH4Cl
Al2(SO4)3
NaCl
KNO3
盐有哪些类型
CH3COONa:
NH4Cl:
NaCl:
(强碱弱酸盐)
(强酸弱碱盐)
(强酸强碱盐)
弱酸
强碱
弱碱
强酸
强碱
强酸
CH3COONH4:
弱酸
弱碱
(弱酸弱碱盐)
探究问题1:
什么原因造成不同类型的盐溶液中c(H+)或
c(OH-)的差异呢?
谁强显谁性
都强显中性
【归纳·规律】
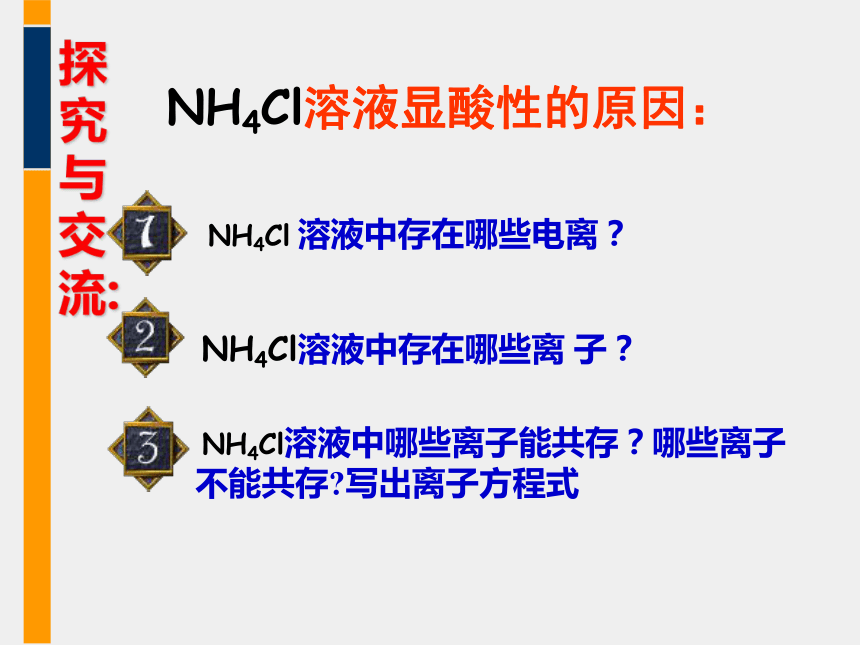
探究与交流:
NH4Cl溶液显酸性的原因:
NH4Cl
=
Cl-
+
NH4+
+
NH3·H2O
c(H+)
>
c(OH-)
溶液呈酸性
平衡向右移动
离子方程式:
化学方程式:
NH4Cl
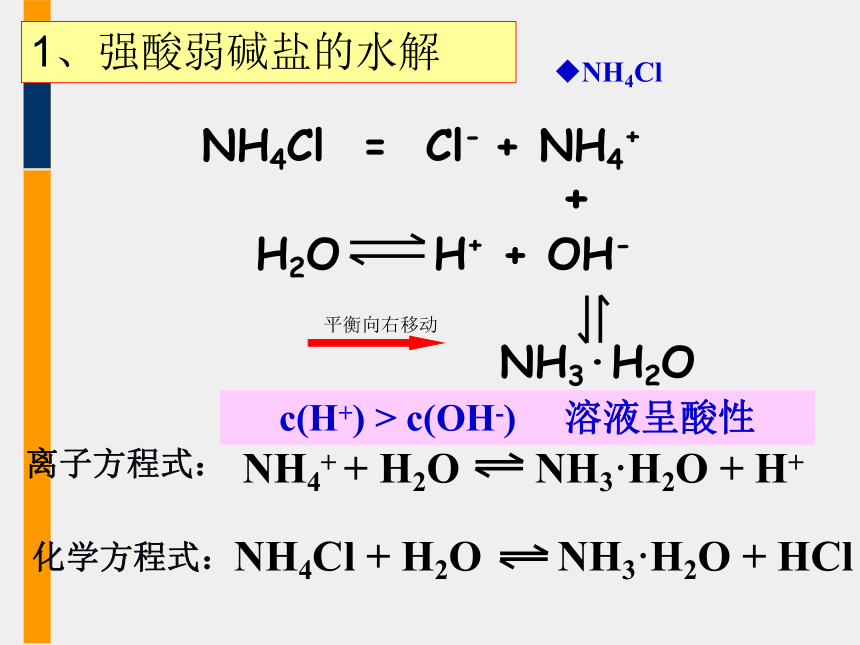
1、强酸弱碱盐的水解
探究与交流:
CH3COONa溶液显碱性的原因:
CH3COONa溶液中哪些离子能共存?哪些离子不能共存?写出离子方程式
CH3COONa
CH3COO-
H2O
H+
+
CH3COOH
Na+
+
OH-
+
溶液中:C(OH-)>C(H+),呈碱性。
CH3COO-+H2O
CH3COOH+OH-
CH3COONa+H2O
CH3COOH+NaOH
化学方程式:
离子方程式:
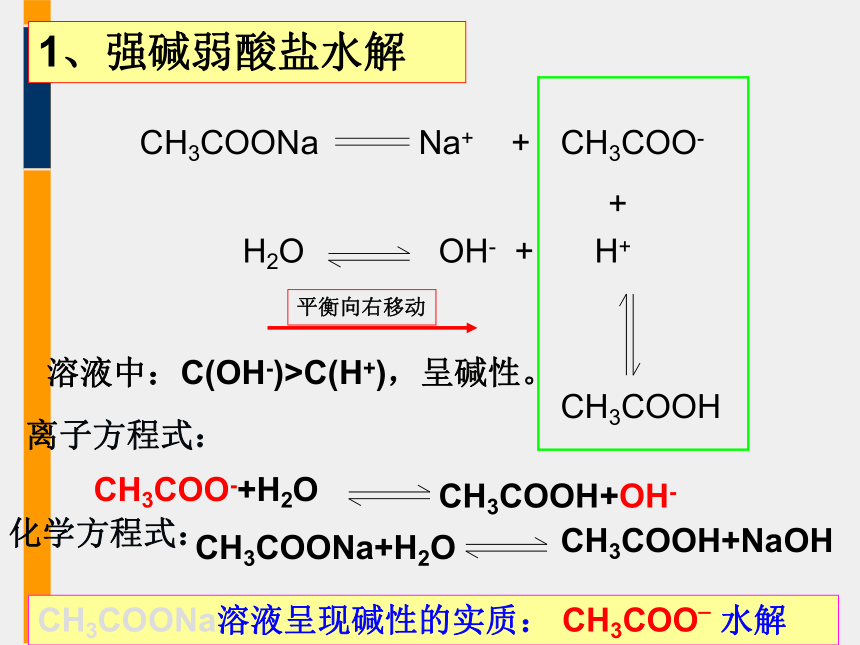
1、强碱弱酸盐水解
CH3COONa溶液呈现碱性的实质:
CH3COO_
水解
NaCl
结论:对水的电离平衡无影响,溶液显中性
3、强酸强碱盐
4、弱酸弱碱盐:
双水解,水解程度增大。
盐类的水解:
在溶液中盐电离出来的离子跟水所电离出来的H+
或OH-结合生成弱电解质的反应,叫做盐类的水解。
【概念】
弱酸阴离子或
弱碱阳离子
1、盐类水解的条件和实质是什么?
在盐溶液中,盐电离出的离子(弱酸阴离子或弱碱阳离子)跟水所电离出的H+或OH-结合生成弱电解质分子的反应就叫做盐类的水解。
水解的条件:
水解的实质:
破坏了水的电离平衡,
促进了水的电离。
分组讨论…
(1)必须溶于水;
(2)必须含弱酸阴离子或
弱碱阳离子.
2、盐类水解反应与中和反应的关系如何?
CH3COOH+NaOH
CH3COONa+H2O
CH3COONa+H2O
CH3COOH+NaOH
水解
中和
水解
中和
强酸强碱盐
强碱弱酸盐
强酸弱碱盐
弱酸弱碱盐
否
(无弱不水解)
中性
是
(酸弱酸水解)
碱性
(NaCl)
(CH3COONa)
(NH4Cl)
是
(碱弱碱水解)
(CH3COONH4)
酸性
是
(都弱都水解)
谁强显谁性
盐类水解有何规律?
【拓展·延伸】
酸
碱
盐的类型
是否水解
盐溶液的
酸碱性
强酸
强碱
弱酸
强碱
强酸
弱碱
弱酸
弱碱
判断:请大家利用水解规律推测Na2
CO3
,FeCl3,
Ba(NO3)2溶液的酸碱性。
【水解规律】
都弱都水解
无弱不水解
都强显中性
越弱越水解
谁强显谁性
有弱才水解
二、
水解方程式的书写
先找“弱”离子
(1)用化学方程式表示:
盐+水
酸+碱
(2)用离子方程式表示:
盐的离子+水
弱酸(或弱碱)+OH-(或H+)
NH4Cl
+
H2O
NH3·H2O
+
HCl
NH4+
+
H2O
NH3·H2O
+
H+
CH3COONa+H2O
CH3COOH+NaOH
CH3COO-+H2O
CH3COOH+OH-
如:碳酸钠在溶液中的变化:
第一步是Na2CO3在水溶液里电离出来的CO32-发生水解:
多元弱酸阴离子或多元弱碱阳离子是分步水解的,一步比一步的程度小。
【补充说明】
如:
CO32?+
H2O
HCO3?
+OH?
HCO3?
+H2O
H2CO3
+
OH?
多元碱的盐也是分步水解的,由于中间过程复杂,可写成一步,如:
Cu2+
+
2H2O
Cu(OH)2
+
2H+
Al3+
+
3H2O
Al(OH)3
+
3H+
2.多元弱酸根离子分步水解,第一步较易发生,水解方程式一般只需写第一步的水解.
-----不能标
1.用可逆符号:
书写水解离子方程式的注意事项
3.对于沉淀气体符号↓或↑
原因:一般盐类的水解的程度很小,水解产物也很少,通常不生成沉淀或气体,也不发生分解(如NH3·H2O、H2CO3)
。
1.判断下列盐溶液的酸碱性,若能水解的写出水解反应的离子方程式。
NaHCO3
NH4NO3
Na2S
FeCl3
Na2SO4
HCO3-+H2O
H2CO3+OH—
NH4++H2O
NH3.H2O
+H+
S
2-+H2O
HS—+OH—
Fe
3++3H2O
Fe(OH)3+3H+
盐类的水解
【联想·质疑】
酸溶液呈酸性,碱溶液呈碱性,那么盐溶液是否呈中性呢?
〖学生实验〗
用PH试纸检验CH3COONa、Na2CO3、NH4Cl、
Al2(SO4)3
、
NaCl、KNO3溶液的酸碱性。
讨论:
试用归纳法找出盐的类型与盐溶液的酸碱性的关系。
酸碱
性
盐类
型
强碱弱
酸盐
强碱弱
酸盐
强酸弱
碱盐
强酸弱
碱盐
强酸强
碱盐
强酸强
碱盐
碱性
碱性
酸性
酸性
中性
中性
【活动·探究】
用什么简便方法检验盐溶液的酸碱性?
盐
CH3COONa
Na2CO3
NH4Cl
Al2(SO4)3
NaCl
KNO3
盐有哪些类型
CH3COONa:
NH4Cl:
NaCl:
(强碱弱酸盐)
(强酸弱碱盐)
(强酸强碱盐)
弱酸
强碱
弱碱
强酸
强碱
强酸
CH3COONH4:
弱酸
弱碱
(弱酸弱碱盐)
探究问题1:
什么原因造成不同类型的盐溶液中c(H+)或
c(OH-)的差异呢?
谁强显谁性
都强显中性
【归纳·规律】
探究与交流:
NH4Cl溶液显酸性的原因:
NH4Cl
=
Cl-
+
NH4+
+
NH3·H2O
c(H+)
>
c(OH-)
溶液呈酸性
平衡向右移动
离子方程式:
化学方程式:
NH4Cl
1、强酸弱碱盐的水解
探究与交流:
CH3COONa溶液显碱性的原因:
CH3COONa溶液中哪些离子能共存?哪些离子不能共存?写出离子方程式
CH3COONa
CH3COO-
H2O
H+
+
CH3COOH
Na+
+
OH-
+
溶液中:C(OH-)>C(H+),呈碱性。
CH3COO-+H2O
CH3COOH+OH-
CH3COONa+H2O
CH3COOH+NaOH
化学方程式:
离子方程式:
1、强碱弱酸盐水解
CH3COONa溶液呈现碱性的实质:
CH3COO_
水解
NaCl
结论:对水的电离平衡无影响,溶液显中性
3、强酸强碱盐
4、弱酸弱碱盐:
双水解,水解程度增大。
盐类的水解:
在溶液中盐电离出来的离子跟水所电离出来的H+
或OH-结合生成弱电解质的反应,叫做盐类的水解。
【概念】
弱酸阴离子或
弱碱阳离子
1、盐类水解的条件和实质是什么?
在盐溶液中,盐电离出的离子(弱酸阴离子或弱碱阳离子)跟水所电离出的H+或OH-结合生成弱电解质分子的反应就叫做盐类的水解。
水解的条件:
水解的实质:
破坏了水的电离平衡,
促进了水的电离。
分组讨论…
(1)必须溶于水;
(2)必须含弱酸阴离子或
弱碱阳离子.
2、盐类水解反应与中和反应的关系如何?
CH3COOH+NaOH
CH3COONa+H2O
CH3COONa+H2O
CH3COOH+NaOH
水解
中和
水解
中和
强酸强碱盐
强碱弱酸盐
强酸弱碱盐
弱酸弱碱盐
否
(无弱不水解)
中性
是
(酸弱酸水解)
碱性
(NaCl)
(CH3COONa)
(NH4Cl)
是
(碱弱碱水解)
(CH3COONH4)
酸性
是
(都弱都水解)
谁强显谁性
盐类水解有何规律?
【拓展·延伸】
酸
碱
盐的类型
是否水解
盐溶液的
酸碱性
强酸
强碱
弱酸
强碱
强酸
弱碱
弱酸
弱碱
判断:请大家利用水解规律推测Na2
CO3
,FeCl3,
Ba(NO3)2溶液的酸碱性。
【水解规律】
都弱都水解
无弱不水解
都强显中性
越弱越水解
谁强显谁性
有弱才水解
二、
水解方程式的书写
先找“弱”离子
(1)用化学方程式表示:
盐+水
酸+碱
(2)用离子方程式表示:
盐的离子+水
弱酸(或弱碱)+OH-(或H+)
NH4Cl
+
H2O
NH3·H2O
+
HCl
NH4+
+
H2O
NH3·H2O
+
H+
CH3COONa+H2O
CH3COOH+NaOH
CH3COO-+H2O
CH3COOH+OH-
如:碳酸钠在溶液中的变化:
第一步是Na2CO3在水溶液里电离出来的CO32-发生水解:
多元弱酸阴离子或多元弱碱阳离子是分步水解的,一步比一步的程度小。
【补充说明】
如:
CO32?+
H2O
HCO3?
+OH?
HCO3?
+H2O
H2CO3
+
OH?
多元碱的盐也是分步水解的,由于中间过程复杂,可写成一步,如:
Cu2+
+
2H2O
Cu(OH)2
+
2H+
Al3+
+
3H2O
Al(OH)3
+
3H+
2.多元弱酸根离子分步水解,第一步较易发生,水解方程式一般只需写第一步的水解.
-----不能标
1.用可逆符号:
书写水解离子方程式的注意事项
3.对于沉淀气体符号↓或↑
原因:一般盐类的水解的程度很小,水解产物也很少,通常不生成沉淀或气体,也不发生分解(如NH3·H2O、H2CO3)
。
1.判断下列盐溶液的酸碱性,若能水解的写出水解反应的离子方程式。
NaHCO3
NH4NO3
Na2S
FeCl3
Na2SO4
HCO3-+H2O
H2CO3+OH—
NH4++H2O
NH3.H2O
+H+
S
2-+H2O
HS—+OH—
Fe
3++3H2O
Fe(OH)3+3H+
