人教化学选修4第四章第三节电解池(共18张PPT)
文档属性
| 名称 | 人教化学选修4第四章第三节电解池(共18张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-06-15 10:59:35 | ||
图片预览






文档简介
(共18张PPT)
电解池
一、电解原理
我是一名科学家
水很稳定
难以用一般的方法分解。
却可以用电解的方法分解。
史
实
直到1800年,英国科学家用伏打电池第一次实现了水的电解。
令整个科学界为之震惊!
英国的另一个科学家戴维敏感的捕捉到,既然电解可以把水这种难以分解的物质分解掉,那么其它的难以分解的物质应该也可以被分解。
在历史上,人们曾一度认为水是不能够被分解的物质。
他开始电解这些物质的水溶液。
--
如图所示,在U形管中注入CuCl2溶液,分别插入两根连有导线的石墨棒做电极,把带红夹的导线与电源正极相连接,把带黑夹的导线与电源负极相连接,打开直流电源开关,将电源调节为6V,接通直流电源,一段时间后,观察现象。
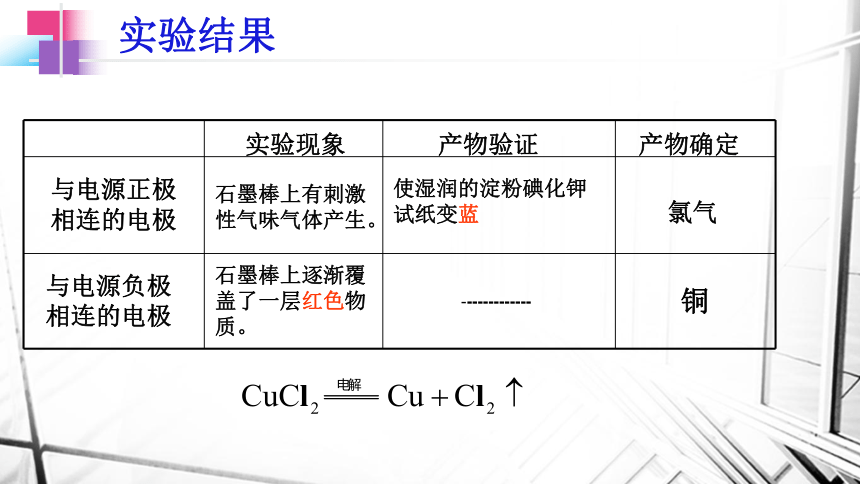
实验结果
氯气
铜
使湿润的淀粉碘化钾试纸变蓝
与电源正极相连的电极
-------------
与电源负极相连的电极
实验现象
产物验证
产物确定
石墨棒上逐渐覆盖了一层红色物质。
石墨棒上有刺激性气味气体产生。
阳极:与电源正极相连的电极。
阴极:与电源负极相连的电极。
阳极
电极反应:
与电源正极相连的电极:
与电源负极相连的电极:
阳极:
阴极:
(氧化反应)
(还原反应)
阴极
总反应:
电流通过电解质溶液而在阴、阳
两极引起氧化还原反应的过程。
电解池:把电能转化为化学能的装置。
【思
考】
电解池的构成条件?
1、直流电源
2、电解质溶液
3、两个电极
4、闭合回路
电解:
阴极
阳极
1、通电前,溶液中存在哪些离子?
离子如何运动?
(1)阳离子:
阴离子:
(2)自由运动
2、通电后,离子又是怎么运动的?
离子作定向移动,阳离子趋向
阴极,
阴离子趋向阳极。
交流与讨论
3、通电后,当这些离子到达电极表
面,发生了什么化学反应?
阳离子得到电子或阴离子失去电子
的过程叫做放电。
4、在电解过程中,
是如
何形成闭合回路的?
交流与讨论
阳极:
阴极:
电子、离子
4、在电解过程中,电子、离子是如何
形成闭合回路的?
电子从电源负极
流入电解池的阴极,
经过阴阳离子定向移动形成内电路,
电子从电解池的阳极流出
电源正极。
电解质溶液的导电过程,就是电解质溶液的
电解过程。
沿导线
沿导线
交流与讨论
Cu2+
H+
Cl-
OH-
阴极
还原反应
阳极
氧化反应
氧化性强的物质发生反应
还原性强的物质发生反应
Cu2+>H+
Cl->OH-
离子放电顺序
阴极上,金属阳离子得电子能力(氧化性)越强,越先放电。
常见阳离子的放电顺序为:
Ag+>
Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
阳极材料为石墨时,电解质溶液中的阴离子失电子的能力(还原性)越强,越先放电。
常见阴离子的放电顺序为:
S2->I->Br->Cl->OH->SO42-
从草木灰里提取出来,在当时也被认为是不可分解的KOH能不能也被分解呢?于是他转到了对电解KOH饱和溶液的研究当中。
结合放电顺序,分析电解饱和KOH溶液能将KOH分解吗?
常见阳离子的放电顺序为:
Ag+>
Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
常见阴离子的放电顺序为:
S2->I->Br->Cl->OH->SO42-
戴维试验了好几十次,都没有得到K,反而是两种气体,经分析确定是H2和O2。
假说推理
小科学家们,请帮助戴维利用电解制取K。
戴维通过仔细研究,认为有可能是水的影响导致无法制取K,于是他决定用纯净的KOH,经过不断的尝试,最终通过电解熔融的KOH得到了K。
对于一些非常活泼的金属,如K、Na,常用电解法将它们从化合物中还原出来。
电解法是最强有力的氧化还原手段
课后作业:
完成课本P83
1,并对比原电池与电解池的异同,完成以下表格
电解池
原电池
能量转化
电极名称
电子流向
电极反应
构成条件
生活运用
THE
END
THANK
YOU!
电解池
一、电解原理
我是一名科学家
水很稳定
难以用一般的方法分解。
却可以用电解的方法分解。
史
实
直到1800年,英国科学家用伏打电池第一次实现了水的电解。
令整个科学界为之震惊!
英国的另一个科学家戴维敏感的捕捉到,既然电解可以把水这种难以分解的物质分解掉,那么其它的难以分解的物质应该也可以被分解。
在历史上,人们曾一度认为水是不能够被分解的物质。
他开始电解这些物质的水溶液。
--
如图所示,在U形管中注入CuCl2溶液,分别插入两根连有导线的石墨棒做电极,把带红夹的导线与电源正极相连接,把带黑夹的导线与电源负极相连接,打开直流电源开关,将电源调节为6V,接通直流电源,一段时间后,观察现象。
实验结果
氯气
铜
使湿润的淀粉碘化钾试纸变蓝
与电源正极相连的电极
-------------
与电源负极相连的电极
实验现象
产物验证
产物确定
石墨棒上逐渐覆盖了一层红色物质。
石墨棒上有刺激性气味气体产生。
阳极:与电源正极相连的电极。
阴极:与电源负极相连的电极。
阳极
电极反应:
与电源正极相连的电极:
与电源负极相连的电极:
阳极:
阴极:
(氧化反应)
(还原反应)
阴极
总反应:
电流通过电解质溶液而在阴、阳
两极引起氧化还原反应的过程。
电解池:把电能转化为化学能的装置。
【思
考】
电解池的构成条件?
1、直流电源
2、电解质溶液
3、两个电极
4、闭合回路
电解:
阴极
阳极
1、通电前,溶液中存在哪些离子?
离子如何运动?
(1)阳离子:
阴离子:
(2)自由运动
2、通电后,离子又是怎么运动的?
离子作定向移动,阳离子趋向
阴极,
阴离子趋向阳极。
交流与讨论
3、通电后,当这些离子到达电极表
面,发生了什么化学反应?
阳离子得到电子或阴离子失去电子
的过程叫做放电。
4、在电解过程中,
是如
何形成闭合回路的?
交流与讨论
阳极:
阴极:
电子、离子
4、在电解过程中,电子、离子是如何
形成闭合回路的?
电子从电源负极
流入电解池的阴极,
经过阴阳离子定向移动形成内电路,
电子从电解池的阳极流出
电源正极。
电解质溶液的导电过程,就是电解质溶液的
电解过程。
沿导线
沿导线
交流与讨论
Cu2+
H+
Cl-
OH-
阴极
还原反应
阳极
氧化反应
氧化性强的物质发生反应
还原性强的物质发生反应
Cu2+>H+
Cl->OH-
离子放电顺序
阴极上,金属阳离子得电子能力(氧化性)越强,越先放电。
常见阳离子的放电顺序为:
Ag+>
Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
阳极材料为石墨时,电解质溶液中的阴离子失电子的能力(还原性)越强,越先放电。
常见阴离子的放电顺序为:
S2->I->Br->Cl->OH->SO42-
从草木灰里提取出来,在当时也被认为是不可分解的KOH能不能也被分解呢?于是他转到了对电解KOH饱和溶液的研究当中。
结合放电顺序,分析电解饱和KOH溶液能将KOH分解吗?
常见阳离子的放电顺序为:
Ag+>
Fe3+>Cu2+>H+>Pb2+>Sn2+>Fe2+>Zn2+>Al3+>Mg2+>Na+>Ca2+>K+
常见阴离子的放电顺序为:
S2->I->Br->Cl->OH->SO42-
戴维试验了好几十次,都没有得到K,反而是两种气体,经分析确定是H2和O2。
假说推理
小科学家们,请帮助戴维利用电解制取K。
戴维通过仔细研究,认为有可能是水的影响导致无法制取K,于是他决定用纯净的KOH,经过不断的尝试,最终通过电解熔融的KOH得到了K。
对于一些非常活泼的金属,如K、Na,常用电解法将它们从化合物中还原出来。
电解法是最强有力的氧化还原手段
课后作业:
完成课本P83
1,并对比原电池与电解池的异同,完成以下表格
电解池
原电池
能量转化
电极名称
电子流向
电极反应
构成条件
生活运用
THE
END
THANK
YOU!
